厌氧消化池产甲烷菌的筛选及特性研究
2012-09-11金映虹黎佳媛王锐萍谢秀祯黄循吟
金映虹,黎佳媛,王锐萍,谢秀祯,黄循吟
(海南师范大学 生 命科学学院,海南 海口 571158)
厌氧消化池产甲烷菌的筛选及特性研究
金映虹,黎佳媛,王锐萍,谢秀祯,黄循吟*
(海南师范大学 生 命科学学院,海南 海口 571158)
从厌氧消化池活性污泥中采集样品,利用特定培养基进行厌氧培养,分离筛选得到2株菌,分别编号为A、B.通过特定荧光反应检测鉴定A、B均为产甲烷菌.利用甲醇液体培养基对A、B两种菌株进行培养,20 d后两株菌均产生甲烷,且通过自制气体收集装置测定其产气量发现,B菌株的产气量高于A菌株.
厌氧消化池;产甲烷菌;筛选
沼气发酵是自然环境中极其典型,且又十分普遍的厌氧消化反应,是一种由多种不同种类的微生物交替联合作用来分解代谢各类有机质成分,从而不断产生沼气的反应过程.在沼气发酵的过程中,产甲烷菌作为核心沼气发酵微生物,不仅是一种能够利用有机或无机化合物通过厌氧发酵,从而将其转化成甲烷和二氧化碳的菌,而且产甲烷菌属于水生古细菌门(Euryarchaecta),能够在各种各样的自然环境中生存,例如人类的消化系统中、反刍动物的瘤胃中、湖泊、稻田或海底的沉积物中、盐池和热油层等极端自然环境中[1],以及沼气反应装置和污泥消化等人造的环境中.虽然产甲烷菌形态极不相同,但是其生理功能却惊人的相似,即均能够产生甲烷气体.产甲烷菌作为自然界碳素循环中厌氧生物链中的最后一位成员,对其的研究能够帮助了解其发酵的过程,优化发酵条件,进而提高沼气的产量[2],有利于大量生产这种可再生能源.
人类于1899年开始对产甲烷菌进行研究.俄国著名微生物学家的奥姆良(B.L.Omelauskie)将微生物中能够厌氧分解纤维素的菌分为两类:一类是产甲烷细菌,后来被称为奥氏甲烷杆菌(Mel-hano⁃bacillus Omelauskii);另一类是能够产生许多氢的细菌,后来被称为产氢产乙酸菌.1901年,孙根(Sohngen)对产甲烷菌的特征,以及产甲烷菌对物质的转化做了更加详细地研究[3-4].由于厌氧分离甲烷菌的设备和技术尚不完备,对奥氏甲烷菌所做的分离研究工作并未取得重大的进展[3],直到20世纪70年代中期,产甲烷菌只有一个科,被称作甲烷杆菌科,并且分成三个属,九个种[4].1950年,科学家亨格特(Hungate)首次创造了严格无氧分离技术,这一技术对于甲烷菌的研究具有十分重要的意义[3].随后,人们从各种不同的厌氧生态环境中分离得到的甲烷菌分为5个目,依次是甲烷球菌目(Methanococcales)、甲烷杆菌目(Methanobacteria⁃les)、甲烷超高温菌(Methanopyrales)、甲烷微菌目(Methanomicrobiales)和甲烷八叠球菌目(Methano⁃sarcinales)[5].1974年,生物学家Bryant第一次提出了产甲烷菌(Methanotrops)这一词,从而将之与以甲烷为能量来源的嗜甲烷菌(Methanotrophs)区分开来.Schnellen第一个从消化污泥中分离纯化得到巴氏甲烷八叠球菌(Methanosa rcina barker)以及甲酸甲烷杆菌(Methanobact erium formicium),到目前为止,通过一代又一代的学者的努力,经过分离鉴定的产甲烷菌总共有200多种[6],随着研究的深入研究数目也在不断地增加中.
20世纪以来,全球范围内出现了严重的能源危机,这就迫使各国竭力寻找新能源和可再生能源.与此同时,环境问题也严重威胁到人类的生命健康安全和生存发展,由此,各个国家越来越重视生物能源和可再生能源利用的研究工作和进展.厌氧消化技术在环境保护和能源生产等领域具有十分显著的优势.产甲烷菌能够有效地分解粪便和污泥中的有机质成分,从而产生沼气,这样不但减少了环境污染,而且能够提供廉价的可再生能源.因此,对其研究工作一直在进行中.但是,由于产甲烷菌的培养必须在严格厌氧的环境中方能够进行,这就导致对其研究主要集中于产甲烷菌的分类学研究方面[7-12],应用方面则尚有一定的难度.
改革开放以来,我国经济飞速发展,人民生活水平不断提高,污水排放量急剧增加,污水处理厂作为污水处理的最重要环节,其生存和发展问题理应受到政府各部门的重视和扶持.海南省白沙门污水处理厂担负着海口市城市80%以上污水处理量,但是污水处理费用的收取问题、电力投入不足的问题等问题一直制约着污水厂的发展,如果能够提高厌氧消化的产甲烷量,利用甲烷气体燃烧发电,为污水处理提供部分电能,那么就能够降低污水处理的成本,提高污水处理厂的经济效益,必然有益于其长远发展.
本研究通过对白沙门污水处理厂的活性污泥进行分离纯化,筛选出2株产甲烷气体的菌株,通过特定荧光反应检测鉴定A、B均为产甲烷菌,且2株菌均能产生大量甲烷气体,通过自制气体收集装置测定其产气量发现,B菌株的产气量高于A菌株,这为后续实验提供高产菌株,以便与硫酸盐还原菌、脱氮硫杆菌进行混合培养,提高污水处理过程中的甲烷气体产量,抑制硫化氢的产生,降低设备的耗损,进而降低白沙门污水处理厂的成本等奠定了研究基础[13].
1 材料与方法
1.1 菌株分离及鉴定
1.1.1 菌种来源
菌种来源于海口市白沙门污水处理厂厌氧消化池的活性污泥.
1.1.2 培养及筛选
将筛选培养基(氯化镁:0.1 g/L;乙酸:3.5 mL/L;甲醇:3.5 mL/L;磷酸二氢钾:0.4 g/L;磷酸氢二钾:0.4 g/L;氯化铵:1 g/L;酵母浸膏:1 g/L;pH:7~8;固体培养基中加入琼脂,20 g/L),灭菌后,向培养基中加入事先配制好的、经过过滤除菌的硫化钠溶液,每1000 mL加入20 mL质量分数3%的硫化钠.
将取来的污泥稀释适当倍数,涂布在筛选培养基平板上,用蜡将培养皿封口,倒置置于35℃培养箱中,或直接放入厌氧培养箱,培养48 h,使仅能够利用特定有机碳源和由氯化铵提供氮源的菌株成为优势菌株.经过多次挑菌画线培养,分离纯化目的菌株[14-15].
1.1.3 革兰氏染色
将分离纯化后的菌株进行革兰氏染色,观察染色结果.
1.1.4 特定荧光反应检测
利用接种针进行无菌操作挑取少许菌体,置于已经滴有一滴碳酸盐缓冲液(0.5 mol/L pH 9.0~9.5)的载玻片上,均匀涂布,然后滴加一滴甘油,并用接种针均匀涂布,盖上盖玻片,贴上标签纸,写好菌号.荧光显微镜需预热5~15 min,在制片完成以后,将片置于荧光显微镜的置物台上,首先在低倍镜下找到观察目标,然后转换为高倍镜,最后将激发滤片转换为紫外激发滤片.由于荧光具有专一性的特定,一般都比激发光弱,为了能够方便地观察到专一荧光,需在物镜后面加阻断(或者是压制)滤光片,同时调节波长至420 nm,通过目镜观察菌落是否激发产生了兰—绿色荧光,若有,则说明菌为产甲烷菌,若无,则不是.
1.2 产气性能测定
1.2.1 预培养
将筛选培养基中的3.5 mL乙醇替换成3.5 mL甲醇,使培养基中甲醇的量增加至7 mL,灭菌后加入硫化钠.将菌接种到含有50 mL该液体培养基的三角瓶中,然后置于厌氧培养箱中,进行预培养.
1.2.2 气体收集实验
培养结束后,将菌液通过无菌操作转移入集气装置中含500 mL甲醇培养基的培养瓶中,通过无菌操作将集气装置连接,利用夹子控制气体收集,装置连接完毕后,利用石蜡将装置的接口处(如瓶口与橡皮塞之间、玻璃管与橡皮管之间)密封起来,防止气体外泄.置于室温进行培养.
2 结果与讨论
2.1 产甲烷菌分离及鉴定
2.1.1 初筛
通过筛选培养基以及提供低氧培养条件进行初筛,得到四株菌株,其菌落形态见图1.
由图1可见:(a)菌的菌落呈黄色,边缘光滑;(b)菌的菌落呈褐黄色,边缘呈不平整;(c)菌的菌落呈乳白色,且边缘为褶皱状;(d)菌的菌落呈绿色.


图1 初筛所得菌株菌落形态观察Fig.1 Shape of the preliminary screening strains colony
2.1.2 复筛
在初筛所得菌株的基础上,通过画线接种纯化,提供严格厌氧的培养条件,最终从初筛的c菌复筛得到A菌株,从初筛的a菌复筛得到B菌株.它们的菌落形态见图2.

图2 复筛所得菌株菌落形态观察Fig.2 Shape of the repeat screening strains colony
A菌株的菌落边缘平滑;B菌株的菌落边缘光滑.两株菌生长初期,菌落为乳白色,8 d后全部变为淡黄色.
2.1.3 革兰氏染色和细胞形态观察
通过革兰氏染色镜检,A菌株为球菌,革兰氏染色为阴性;B菌株也是球菌,但革兰氏染色为阳性(见图3).
2.1.4 特定荧光反应观察结果
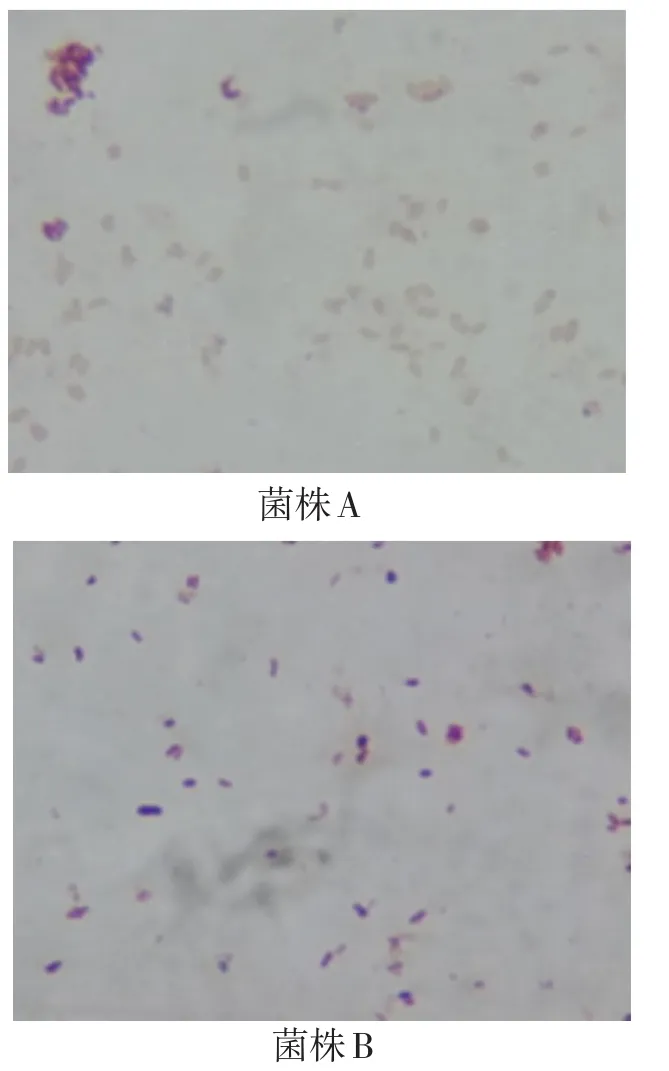
图3 革兰氏染色和细胞形态观察结果Fig.3 Results of shape of cell and Gram stain
研究成果表明,到目前为止,除了产甲烷菌外,尚未发现其他专性厌氧的微生物含有其他在420 nm激发能够发射荧光的物质以及辅酶F420,而辅酶F420和甲基喋呤类化合物则为大多数产甲烷菌所含有,这就使得仅仅产甲烷菌能够在420 nm紫外光激发下产生兰—绿色荧光,利用荧光显微镜检测,观察菌落是否产生荧光,这项检测项目已经成为鉴定产甲烷菌的一种重要的技术手段[13].
由图4可知,A菌株和B菌株均观察到了兰—绿色荧光反应,由此可以初步确定A菌株和B菌株均为产甲烷菌.
2.2 产气性能试验结果
2.2.1 菌株在甲醇培养基中的生长情况
A菌株接种到甲醇液体培养基培养24 h后,观察到有白色絮状物质,且是直立状生于瓶内.培养6 d后,观察到白色絮状物质增多,且均匀分布于培养基内,液体底部、中部和表面均有菌生长;而B菌株接种到甲醇液体培养基中,经过24 h后,未能观察到明显的菌落生长.培养6 d后,观察到液体培养基中均有黄色菌落分布,主要沉集在瓶子的底部,且液体表面亦有一层菌落(见图5).
由培养结果可知,A、B菌株均能在此甲醇液体培养基中生长,且比在筛选培养基上生长周期更短,因此利用甲醇液体培养基进行产气性能试验.

图4 A、B菌株荧光反应检测结果Fig.4 Results of the specific fluoroscopy test of strain A and B

图5 两菌株在甲醇培养基中的培养结果观察Fig.5 Results of cultivated strain A and B in methane mediun
2.2.2 产气性能试验结果
在第一次产气实验中,菌体首先经过1 d的预培养,然后接种到集气装置的培养瓶中进行培养.培养8 d并未观察到明显的菌生长,直至第11天,培养液开始变浑浊,说明菌已经开始生长.继续培养至第15天,打开装置上的夹子后,并未观察到集气装置中液面的上升.随后关闭夹子,继续培养.第22天时,打开A菌株、B菌株的集气装置,均观察到液面的上移,记录产气量(见表1).

表1 气体收集结果Tab.1 Gas collection results
根据第一次实验结果,使用相同的集气装置,将菌体的预培养时间延长至15天,再进行转接.培养至第15天,打开夹子后,并未观察到集气装置中液面的上升.随后关闭夹子,继续培养.第20天时,打开A菌株、B菌株的集气装置橡皮管上的夹子,均观察到液面的上移,记录产气量(见表1).
据两次试验的结果可知,A、B两株菌均能够产生甲烷气体,且B菌株的产气能力比A菌株高.
3 结论
从海南省白沙门污水处理厂的厌氧消化池污泥中分离筛选得到的两株菌(编号为A菌株和B菌株).根据革兰氏染色结果,A菌株为球状革兰氏阴性菌,B菌株为球状革兰氏阳性菌,完全符合对甲烷球菌属的描述——球形细胞,革兰氏阳性或阴性;并且通过荧光反应检测,进一步确定两株菌均为产甲烷菌,因此,初步把A菌株和B菌株都归为甲烷球菌属.
通过甲醇液体培养基培养20 d左右后,2株菌均能产生甲烷气体,且B菌株产气量比A菌株高.根据《伯杰氏手册》中产甲烷菌的相关内容,经过15 d的培养后,即可观察到气体生成[16],然而本实验结果显示培养15 d后未有气体产生,需要继续培养至20 d左右.其原因可能有两方面:1)由于集器气装置是置于室温下,平均温度达不到35℃,而产甲烷菌的最适生长温度为35℃,较低的培养温度延缓了产甲烷菌地生长;2)由于装置过大,无法放入厌氧培养箱中培养,装置中无法保持较好的厌氧环境,这也抑制了产甲烷菌的生长.
在此基础上,本研究组将进一步优化产甲烷菌培养条件,提高产甲烷能力,为后续实验提供高产菌株,以便与硫酸盐还原菌、脱氮硫杆菌进行混合培养,提高污水处理过程中的甲烷气体产量,抑制硫化氢的产生,降低设备的耗损,进而为降低污水处理厂的成本等奠定了研究基础.
[1]公维佳,李文哲,刘建禹.厌氧消化中的产甲烷菌研究进展[J].东北农业大学学报,2006,37(6):838-841.
[2]林代炎,林新坚,杨菁,等.产甲烷菌在厌氧消化中的应用研究进展[J].福建农业学报,2008,23(1):106-110.
[3]郝鲜俊,洪坚平,高文俊.产甲烷菌的研究进展[J].贵州农业科学,2007,35(1):111-113.
[4]李美群,邓洁红,熊兴耀,等.产甲烷菌的研究进展[J].酿酒科技,2009(5):90-93.
[5]傅霖,辛明秀.产甲烷菌的生态多样性及工业应用[J].应用与环境生物学报,2009,15(4):574-578.
[6]刘亭亭,曹靖俞.产甲烷菌的分离及其生长条件研究[J].黑龙江水专学报,2007,34(4):121-122.
[7]田沈,赵军,曹亚丽,等.产甲烷菌固定化新方法及其甲烷化特点[J].太阳能学报,2002,23(6):778-781.
[8]郭立峰,李永峰,高大文.制药废水中产甲烷菌的分离与鉴定[J].哈尔滨商业大学学报:自然科学版,2008,24(1):29-31.
[9]崔晓光.沼气池中产甲烷菌的分离鉴定及其分布的研究[D].大连:大连理工大学,2007.
[10]杨光.低温对沼气菌群产气能力的影响以及差甲烷菌的分离[D].西安:西北农林科技大学,2008.
[11]Gareia J L Patel K C,OIIivier B.Taxonomic:phylogenet⁃ic and ecological diversity of methanogenic Archaea[J].Anaereber,2000,6(4):205-226.
[12]汪婷.沼气发酵过程中产甲烷菌分子多样性研究及产甲烷菌的分离[D].南京:南京农业大学,2005.
[13]徐祖波,祖建,周富春,等.产甲烷菌的生理生化特性[J].环境科学与技术,2008,31(3):6-7.
[14]庞德公,杨红建.产甲烷菌的分离纯化培养及培养基对菌株的选择作用[J].中国畜牧兽医,2010,37(6):32-35.
[15]张国政.产甲烷菌的一般特征探讨[J].中国沼气,1990,8(2):4-8.
[16]R.E.布坎南,N.E.击本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:652-660.
责任编辑:黄 澜
Research on Screening and Properties of Methanogen from Anaerobic Digester
JIN Yinghong,LI Jiayuan,WANG Ruiping,XIE Xiuzhen,HUANG Xunyin*
(College of Life Science,Hainan Normal University,Hhaikou 571158,China)
Two strains of Methanogen were isolated from anaerobic digester by anaerobic culture,and identified by the specific fluoroscopy.They were marked as strain A and strain B.A gas collector was designed to collect the methane which was produced by strain A or B.The results showed that strain A and B both could produce gas after about 20 days cultivation with methanol liquid medium,and the gas production of B strain was more than A strain’s.
anaerobic digester;methanogen;screening
Q 939.9
A
1674-4942(2012)03-0295-05
2012-06-28
海口市重点科技计划项目(2009030)
*
