肺隐球菌病1例
2012-09-11王爱平李丽丽万喆陈伟李若瑜
王爱平 李丽丽 万喆 陈伟 李若瑜
(北京大学第一医院皮肤性病科,北京 100034)
1 临床资料
患者男,35岁,辽宁沈阳人,干部。因发现右肺下叶阴影1个月余,于2010年1月10日就诊我院胸外科。患者1个月前体检胸片显示右肺下叶有一阴影改变,除伴有间断性干咳外,不伴其他不适感。曾经口服莫西沙星400 mg/d治疗11 d,肺部阴影未改变,遂以“右肺占位,肺癌可能性大”收入我院胸外科。发病以来,患者无发热、头痛、头晕等神经及精神方面异常,饮食起居正常。既往体健,否认有其他系统疾病史,否认养鸽子和接触禽类史。体格检查:一般情况良好,全身浅表淋巴结未触及肿大,心、肺、腹及神经系统检查未见明显异常,全身皮肤未见皮损。实验室检查:血常规、血生化全项及凝血功能筛查未见异常;HIV检查阴性;PPD阴性;肿瘤标记物包括癌胚抗原、CA19-9、鳞状细胞癌相关抗原、细胞角蛋白19片段、神经元特异性烯醇酶、组织多肽抗原及胃泌素释放肽前体未见异常。胸部CT显示右肺尖陈旧性病变,右肺下叶团片影及结节影 (见图1)。PET/CT显示右肺下叶后基底段软组织影,代谢增高,右肺下叶背段密度增高,右肺门淋巴结代谢增高。
为明确诊断,给予患者胸腔镜下行右肺下叶切除术,术后静滴哌拉西林钠-舒巴坦预防细菌感染。切除的右肺下叶肺组织中可见2处灰白色结节,大小分别为2.5 cm ×2 cm ×1.5 cm 及4 cm×2 cm×1.8 cm。冰冻与石蜡组织病理切片显示肺内纤维组织增生,肺泡腔内及肺间隔中多量多核巨细胞聚集,胞浆中及渗出物中可见小球状结构 (见图2a);PAS染色阳性 (见图2b);抗酸染色阴性;Giemasa染色阴性。支气管断端无著变;纵膈淋巴结3枚,其中1枚可见肉芽肿形成,多核巨细胞及小球状病原体结构。提示肺部为感染性病变,首先考虑隐球菌感染。患者遂就诊我科,因患者肺部病变组织没有进行真菌培养,因此,我们给予患者进行了真菌相关的血清学试验,结果显示血清隐球菌荚膜多糖抗原乳胶凝集试验阳性(++);半乳糖甘露聚糖试验 (GM试验)为0.94 ng/mL为阳性;β-1,3-D-葡聚糖试验(G试验)阴性。对肺部病变组织切片进行免疫组化染色阳性 (见图2c);黏蛋白卡红染色阳性 (见图2d):阿申蓝染色阳性 (见图2e)。最后诊断:肺隐球菌病。给予患者口服氟康唑400 mg/d治疗3个月,服药期间患者无不适感。停药后2个月患者复查血清隐球菌荚膜多糖抗原乳胶凝集试验阴性;GM试验阴性。随访2 a余患者无复发。
2 讨 论
肺隐球菌病在免疫功能正常的宿主年发病率为0.4/10万~0.9/10万,而有免疫功能损害者特别是人类免疫缺陷病毒 (HIV)感染者,发病率为6% ~10%[1]。肺隐球菌病临床表现和影像学表现均无特异性,如果中年 (40~60岁)男性患者,因发热、咳嗽、咳痰就诊,血白细胞分类增高,影像学表现为单个或多发结节或是斑片状阴影,抗菌药物治疗无效,应高度怀疑本病。应尽快行血清隐球菌荚膜多糖抗原乳胶凝集试验、肺活检或手术病理和组织真菌培养[2]。
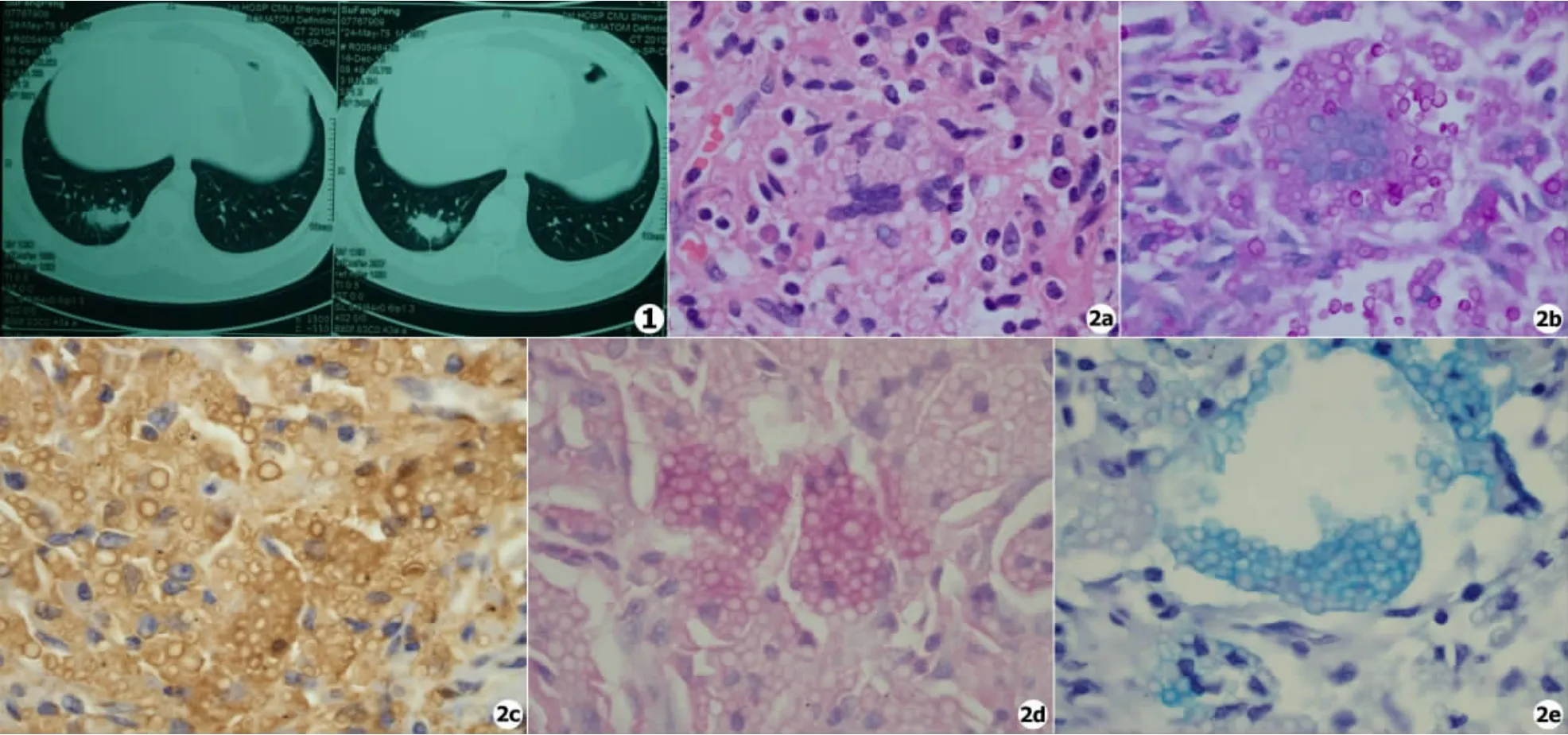
图1 胸部CT显示右肺下叶团片影及结节影 图2 a.组织病理学 (HE染色×1 000);b.PAS染色阳性 (×1 000);c.免疫组化染色阳性(×1 000);d.黏蛋白卡红染色阳性 (×1 000);e.阿申兰染色阳性 (×1000)Fig.1 Chest CT reveals single nodular lesion in right lung Fig.2 a.Histologic pathology(HE stain ×1 000);b.PAS stain positive(×1 000);c.Immunohistochemistry stain positive(×1 000);d.Mucicarmine stain positive(×1 000);e.Alcian blue stain positive(×1 000)
血清或脑脊液乳胶凝集试验检测隐球菌荚膜多糖抗原,是一种简便、快速、有效、方便诊断隐球菌病的实验方法,其特异性及敏感性100%[1]。由于疾病的进展通常伴有抗原滴度的增高,而临床表现的改善伴有滴度的下降,因此,乳胶凝集试验有诊断和估计预后的价值。治疗不彻底及复发者通常伴有连续几次标本滴度不变或升高 (必须用同一厂商提供的试剂盒)。当真菌镜检和培养全部转阴时,其结果仍呈阳性,最低滴度为1∶40,可能因为死亡的隐球菌仍持续释放荚膜多糖抗原,而CSF中清除此类抗原缓慢的缘故[3]。夏敬文等[2]对 32例肺隐球菌病患者的血清进行检测,隐球菌乳胶凝集试验均为阳性,滴度均大于1∶80。对于开始标本抗原阳性的患者,多数在成功治愈后仍会有长达6个月的抗体水平。乳胶凝集试验对于鉴别诊断意义重大,可以作为一种早期无创性的诊断方法,具有很大优势,并可作为一种筛查和监测方法[1]。肺隐球菌病也易误诊为肺结核,乳胶凝集试验和T细胞斑点试验联合检测对肺结核合并肺隐球菌病具有诊断价值[4]。研究表明RF阳性血清和TB患者血清可引起隐球菌荚膜多糖抗原乳胶凝集试验假阳性,随着RF浓度的升高,其假阳性率也呈逐步上升的趋势。RF组9例假阳性标本和TB组2例假阳性标本作1∶4稀释时均呈阴性结果,而28例隐球菌感染患者的标本在1∶40稀释后仍然是阳性。因此,隐球菌荚膜多糖抗原阳性患者的抗原滴度均在1∶40以上,而假阳性滴度均 <1∶40,提示1∶4稀释可以用于消除RF、TB所造成的假阳性干扰[5]。本文报道的病例系体检发现肺部阴影,曾给予患者抗菌药物治疗以除外细菌感染,但未曾想到有真菌感染的可能,建议今后对这样的病例,应常规给予患者进行真菌相关的血清学试验。
GM试验主要用于监测侵袭性曲霉病 (IA)高危免疫抑制患者GM抗原血症的发展,作为IA的早期诊断标志物;此外还可用于监测抗真菌药物治疗的疗效。源于真菌的抗生素可能与假阳性结果有关,如氨苄西林/舒巴坦、阿莫西林/克拉维酸和哌拉西林/他唑巴坦等。有报道在停用β内酰胺类抗生素10 d后GM仍持续阳性[6]。除曲霉外,其他真菌也能在生长过程中产生GM,尤其是青霉,但其他真菌释出的GM量值与曲霉和青霉相比较低,约一半组织胞浆菌病患者可出现假阳性,在隐球菌、地丝菌属感染患者中也有假阳性[6]。本文报道的病例GM试验显示阳性,患者在手术后使用了哌拉西林钠-舒巴坦,且在氟康唑治疗3个月后复查阴转,我们判断其为假阳性。
(1,3)-β-D葡聚糖是几乎所有真菌均具有的一种特异性的细胞壁成分,检测 (1-3)-β-D葡聚糖作为系统性真菌感染诊断手段,具有早期、快速及适用范围广的优势。目前主要用于深部念珠菌和曲霉感染的诊断,高危人群的监测以及疗效、预后的评价。但由于其不能将真菌分类,故不适于流行病学研究。由于隐球菌具有较厚的荚膜,(1-3)-β-D葡聚糖含量也少,故该成分不能作为隐球菌感染指标[7]。本文报道的病例G试验显示阴性。
肺隐球菌病组织病理多显示为肉芽肿型,可见大小不等的结核样肉芽肿,一般无干酪样坏死,多形成凝固坏死,可见黏液样物、上皮样细胞及多核巨细胞弥漫分布,多核巨细胞体积巨大,核多,呈异物巨细胞样,于增生的组织细胞及多核巨细胞浆内可见大量酵母细胞和芽孢[1]。HE染色酵母细胞壁淡蓝或淡红色,荚膜不着色;PAS染色呈红色;GMS染色呈黑色;黏蛋白卡红染色呈红色;阿申蓝染色呈蓝色[8],是与其他真菌感染、结核和其他肉芽肿性病变鉴别的重要特点[1]。本文报道的病例冰冻和石蜡切片组织病理均符合肺隐球菌病改变,病理科医生应该提示手术医生对患者病变组织进行真菌培养,以明确致病菌。但本病例未进行真菌培养,说明医生对真菌病的认识不够。事后我们对组织病理切片进行了针对隐球菌的免疫组化染色,结果显示阳性,此外PAS、黏蛋白卡红和阿申兰染色亦显示阳性。
对肺隐球菌病的治疗药物包括两性霉素B、两性霉素B脂质体、伊曲康唑、氟康唑、氟胞嘧啶、伏立康唑等[2]。对于免疫健全患者,如果无症状可无需治疗,密切观察;或氟康唑200~400 mg/d治疗3~6个月 (AIII)。如果症状轻至中度,氟康唑200~400 mg/d治疗6~12个月(AIII);或伊曲康唑200~400 mg/d治疗6~12个月(BIII)。如果重症或合并中枢神经系统感染者,两性霉素B 0.7~1 mg/(kg·d)加5氟胞嘧啶 (5-FC)100 mg/(kg·d)治疗2周,随后氟康唑400 mg/d治疗10周,再200 mg/d治疗6~12个月 (AI)[9-10]。对于肺部病灶局限,而内科治疗效果不佳的患者,可考虑手术治疗。因剖胸探查或误诊为肿瘤或其他病变行病灶手术切除者,建议术后常规应用抗真菌药物治疗至少2个月[10]。可检测血清乳胶凝集试验判断疗效,只要经积极治疗抗原滴度会下降[1]。但血清乳胶凝集试验持续阳性不能作为维持治疗的指标[10]。黄绍萍等[3]随访8例患者血清乳胶凝集试验阳性持续时间分别为2~12个月,3例患者病灶在3~5个月内消失,其余病例病灶吸收较慢,随访12个月病灶均未完全消失。本文报道的病例系体检发现肺部阴影,自觉症状不明显,病灶已经手术切除,因此,我们给予患者口服氟康唑400 mg/d治疗3个月,在停药后2个月复查血清隐球菌乳胶凝集试验阴转,获得痊愈,且随访2 a余患者无复发。
[1]孟凡亮,张勇.原发性肺隐球菌病的临床和乳胶凝集试验分析[J].临床肺科杂志,2009,14(12):1646-1647.
[2]夏敬文,陈小东,张斯为,等.32例肺隐球菌病的临床分析[J].复旦学报(医学版),2009,36(1):103-106.
[3]卢洪洲,曹天高,周颖杰,等.乳胶凝集试验对新生隐球菌性脑膜炎诊断及治疗的意义[J].中华传染病杂志,2005,23(3):209-211.
[4]黄绍萍,卢水华,朱召芹,等.T细胞斑点试验联合隐球菌乳胶凝集试验对肺结核合并肺隐球菌病诊断的初步研究[J].中国感染与化疗杂志,2009,9(4):252-255.
[5]王露霞,刘海英,石凌波,等.隐球菌荚膜多糖抗原乳胶凝集试验干扰因素的探讨[J].临床检验杂志,2010,,2(2):159.
[6]史利宁,李芳秋.ELISA法检测曲霉半乳甘露聚糖的影响因素[J].中国实验诊断学,2010,14(3):465-468.
[7]李军,席丽艳.真菌抗原成分及代谢产物在系统性真菌感染诊断方面的应用进展[J].国外医学皮肤性病学分册,2004,30(4):254-255.
[8]王端礼.医学真菌学-实验室检验指南[M].北京:人民卫生出版社,2005:216-226.
[9]盛华,瞿介明.肺隐球菌病的诊断和治疗[J].中国呼吸与危重监护杂志,2010,9(1):107-109.
[10]中国真菌学杂志编辑委员会.隐球菌感染诊治专家共识[J].中国真菌学杂志,2010,5(2):65-68.
