响应面法优化枇杷花黄酮提取工艺研究
2012-09-07谢田伟陈发河吴光斌
谢田伟,陈发河,吴光斌
(集美大学生物工程学院,福建厦门361021)
响应面法优化枇杷花黄酮提取工艺研究
谢田伟,陈发河,吴光斌
(集美大学生物工程学院,福建厦门361021)
采用超声波辅助提取法对枇杷花黄酮的提取工艺进行了研究.在单因素实验的基础上,采用四因素三水平的响应面法优化枇杷花黄酮提取工艺条件.结果表明,枇杷花黄酮提取的最佳工艺条件为:乙醇体积分数为64%,料液比为1∶44(g∶mL),超声温度为59℃,超声时间为38 min.在此条件下,枇杷花黄酮得率为106.422 mg/g.
枇杷花;黄酮;超声波辅助;响应面
0 引言
枇杷花,又名土冬花,具有“止渴下气、利肺、止吐逆、去焦热、润五脏、治头风”等功效[1].现代药理研究表明,枇杷花在抑菌、抗炎、止咳、镇痛、平喘、祛痰等方面有显著效果[2].有研究报道,枇杷花的药理作用与其含有较多的黄酮类化合物密切相关[3],枇杷花黄酮类化合物具有一定的止咳、抗炎作用[4].目前,黄酮类化合物的提取方法主要有水和溶剂浸提法[5-6]、碱液提取法[7]、超声波法[8-9]、微波辅助提取法[10-11]、超临界流体萃取法[12-13]、酶解法[14-15]等.超声波辅助法由于超声波在提取溶剂中产生空化效应、机械作用、搅拌作用,破坏植物细胞,使黄酮类化合物溶入溶剂中,同时传递能量给植物和溶剂,加速细胞内黄酮类化合物的溶解和释放,从而加速黄酮类化合物的浸出.该法具有提取率高、提取时间短、有效成分不易变性等优点[16-18],因此,近年来该方法作为提取天然植物中黄酮类化合物的新手段被广泛应用.目前对枇杷花的开发利用主要集中在枇杷花茶的加工,其他有诸如枇杷花醋[19]、枇杷花酒及蜜酒[20]、枇杷花露[21]、蜜炼枇杷膏[22]等产品以及枇杷花总皂苷[23]及用于治疗咽炎的枇杷花提取物[24]等.为充分利用枇杷花资源,提高枇杷花的利用价值,有必要对枇杷花主要活性成分黄酮的提取工艺进行优化研究.本文通过研究超声波辅助提取枇杷花黄酮工艺,在单因素实验的基础上,对影响枇杷花黄酮得率的溶剂浓度、料液比、超声温度和超声时间等因素进行初步研究,再采用Box-Behnken中心组合设计原理,响应面法优化枇杷花黄酮提取工艺,以期获得最佳工艺参数.
1 材料与方法
1.1 材料、试剂与仪器
枇杷花采自福建云霄,芦丁对照品 (中国药品生物制品鉴定所),无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠等药品均为分析纯.
KQ5200DE数控超声波清洗器 (昆山市超声仪器有限公司);FW100高速万能粉碎机 (天津市泰斯特仪器有限公司);UV-2600A型紫外可见分光光度计 (尤尼柯上海仪器有限公司);RE-52AA旋转蒸发仪 (上海亚荣生化仪器厂);HH-4数显恒温水浴锅 (国华电器有限公司);SHB-Ⅲ循环水式真空泵 (郑州长城科工贸有限公司);电子天平 (梅特勒-托利多食品 (上海)有限公司).
1.2 方法
1.2.1 原料预处理 将晒干的枇杷花去除枝干,粉碎后放入保鲜袋中,于干燥皿中保存.
1.2.2 标准溶液的制备和标准曲线的确定 精确称取芦丁标准品20 mg,用体积分数40%乙醇溶解于100 mL容量瓶中,定容,摇匀,制得质量浓度为206.5 mg/L的芦丁对照品溶液.精确移取0.1、0.5、1.0、2.0、3.0、4.0和5.0 mL上述对照品溶液置于10 mL容量瓶中,进行编号.加质量分数为5%的NaNO2溶液0.3 mL,摇匀放置6 min;再加质量分数为10%的Al(NO3)3溶液0.3 mL,摇匀,放置6 min;再加质量分数为4%的NaOH溶液4 mL,摇匀放置15 min后,用体积分数为40%的乙醇定容.以同法配制空白对照,在510 nm波长处测定吸光度值,以芦丁浓度为横坐标、吸光度值为纵坐标绘制标准曲线,并作线性回归,得芦丁浓度C和吸光度值A的标准曲线线性回归方程.
1.2.3 枇杷花中黄酮的提取及测定 精确称取0.5 g枇杷花粉末,以乙醇溶液为溶剂,在一定条件下进行超声辅助浸提,浸提液经抽滤后,加入相应浓度的乙醇定容于50 mL待测.精确吸取0.5 mL提取液于10 mL容量瓶中,按1.2.2方法测提取液中黄酮的含量,再下式计算枇杷花提取黄酮得率:黄酮得率(mg/g)=提取得到的黄酮质量(mg)/枇杷花质量(g).
1.2.4 试验设计 在单因素实验的基础上,对乙醇体积分数、料液比、提取温度、提取时间等4个影响枇杷花黄酮得率的因素进行优化实验.采用Box-Behnken方法,响应面因素水平编码表如表1所示.
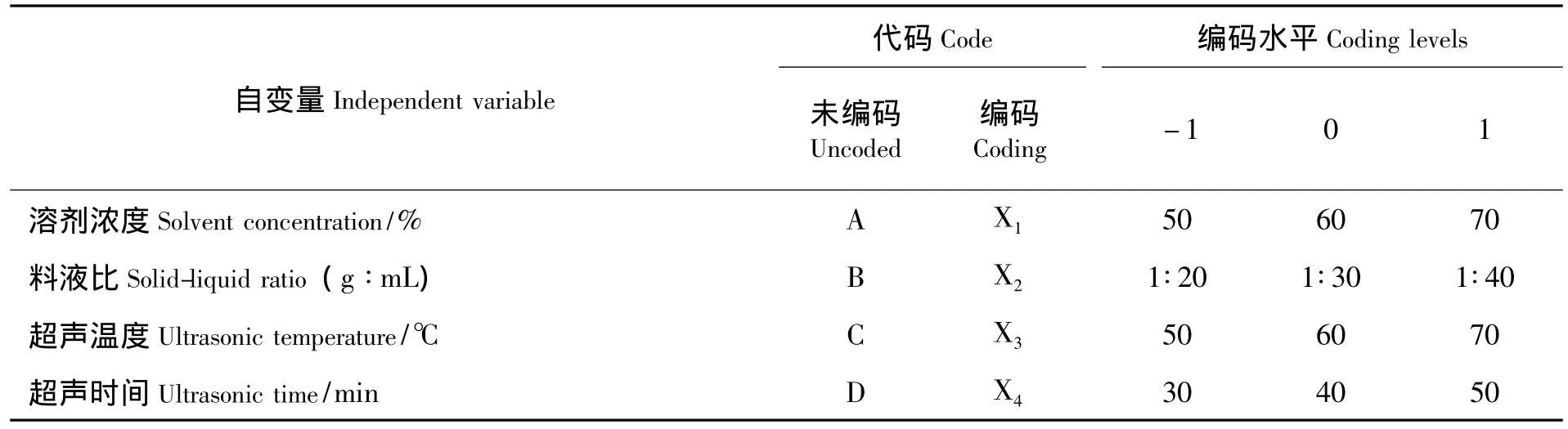
表1 响应面分析因素和水平表Tab.1 Factors and levels of response surface methodology
2 结果与分析
2.1 芦丁标准曲线的绘制
绘制的芦丁标准曲线如图1所示,浓度ρ与吸光度值A之间关系的回归方程为:A=0.010 2ρ-0.009 6,相关系数R2=0.999 7,说明在2.065~103.250 mg/L范围内,溶液浓度与吸光度值有良好的线性关系.
2.2 单因素实验结果及其分析
2.2.1 乙醇体积分数对枇杷花黄酮得率的影响
固定料液比为1∶30(g∶mL),提取温度为60℃,提取时间为40 min,选取体积分数分别为30%、40%、50%、60%、70%乙醇进行提取,其提取结果如图2所示.

图1 芦丁标准曲线Fig.1 Standard curve of rutin
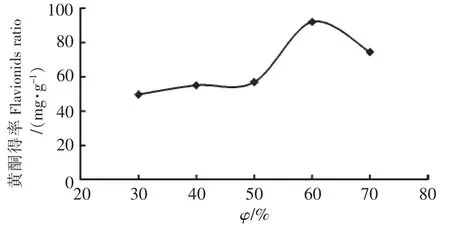
图2 乙醇体积分数对黄酮得率的影响Fig.2 Effect of the ethanol concentration on extraction ratio of flavonoids
由图2可知,随着乙醇体积分数的增加,提取液中黄酮得率先增大,但当乙醇体积分数达到60%时,枇杷花黄酮得率达到峰值,而后黄酮得率又随着乙醇体积分数的增大而呈现下降趋势.分析其原因,可能是由于乙醇体积分数是影响乙醇和黄酮间亲和力的一种因素,而60%的乙醇和黄酮间亲和力最大,溶解性最好.而一旦乙醇体积分数过高时极性发生改变,使提取液中的一些脂溶性物质溶出增加,从而影响了总黄酮的浸出.综合考虑,选取60%乙醇溶液进行后续实验.
2.2.2 料液比对枇杷花黄酮得率的影响
固定乙醇体积分数为60%,提取温度为60℃,提取时间为40 min,选取料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)进行提取,提取结果如图3所示.由图3可知,随着料液比的升高,枇杷花总黄酮得率也不断增加,但当料液比达到1∶30(g∶mL)时,继续增大料液比,黄酮得率并没有增大,反而有所下降.这可能是由于随着料液比的增加,枇杷花中的黄酮溶出量逐渐增加,但当提取溶剂量达到一定程度时,枇杷花中的黄酮已基本溶出,而过多的提取溶剂,使得提取液中脂溶性物质溶出量增大,对黄酮提取工作的影响增大.同时溶剂量过大,不利于降低生产成本和之后的浓缩工作量.所以,综合考虑,料液比为1∶30(g∶mL)较适宜.

图3 料液比对黄酮得率的影响Fig.3 Effect of solid-liquid ratio on extraction ratio of flavonoids
2.2.3 超声时间对枇杷花黄酮得率的影响
固定乙醇体积分数为60%,料液比为1∶30(g∶mL),提取温度为60℃,选取提取时间分别为20、30、40、50、60 min进行提取,其提取结果如图4所示.由图4可知,随着时间的延长,黄酮得率在逐渐增大,在40 min时达到最大,之后随着提取时间的延长,黄酮得率呈现下降的趋势.原因可能是当时间过短时,枇杷花黄酮提取不够充分,没有完全溶出,而时间过长,又可能引起黄酮结构的一些变化进而使黄酮得率降低,故枇杷花黄酮适宜的提取时间为40 min.
2.2.4 超声温度对枇杷花黄酮得率的影响
固定乙醇体积分数为60%,料液比为1∶30(g∶mL),提取时间为40 min,选取提取温度分别为40℃、50℃、60℃、70℃、75℃进行提取,其提取结果如图5所示.由图5可知,随着提取温度的升高,黄酮得率逐渐增大,但当温度升到60℃时,再提高提取温度,黄酮得率略有下降.可能是由于原料受热使枇杷花中一些黄酮类化合物发生氧化而被破坏,且温度过高导致溶剂挥发损失,同时温度过高使枇杷花中其他成分的溶解度增大,从而使黄酮得率有所下降.综合考虑,提取温度选取60℃比较适宜.
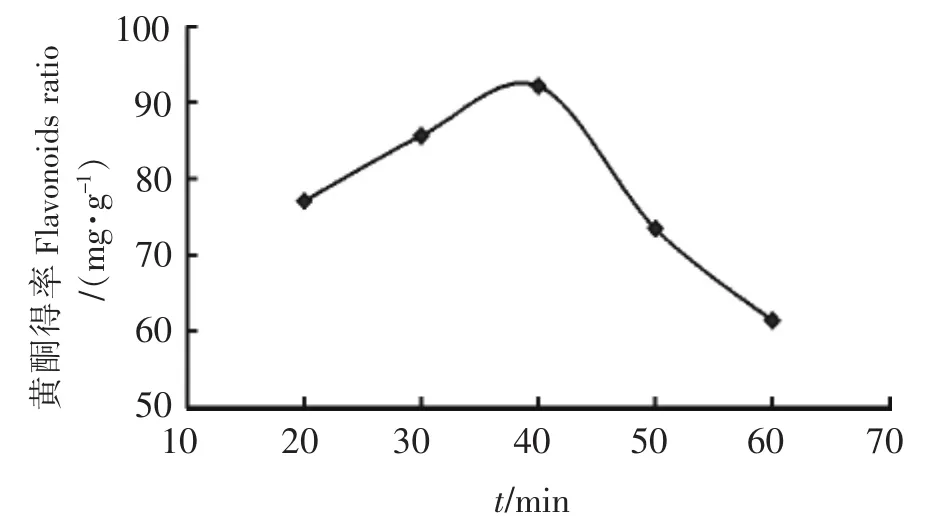
图4 超声时间对黄酮得率的影响Fig.4 Effect of extracting time on the ratio of flavonoids
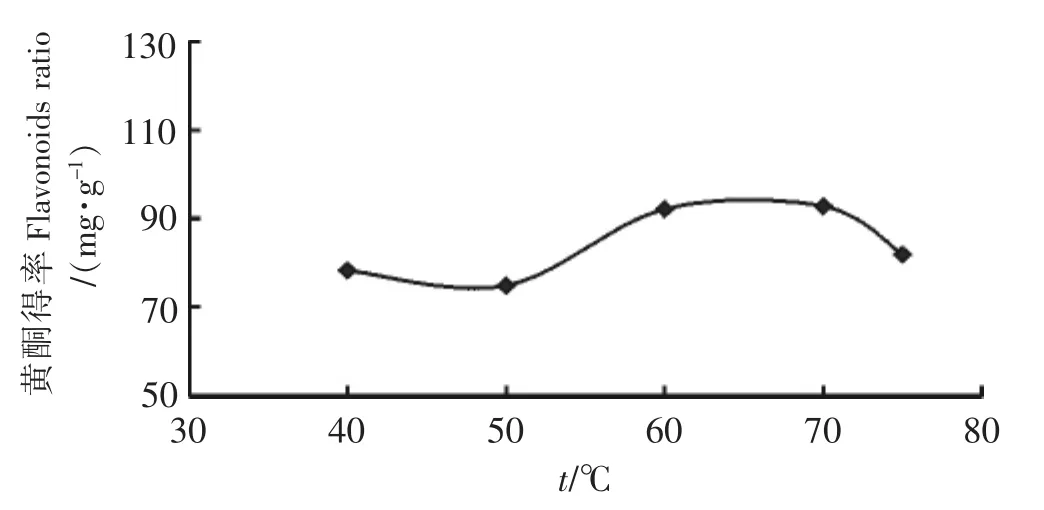
图5 超声温度对黄酮得率的影响Fig.5 Effect of temperature on the extraction ratio of flavonoids
2.2.5 超声辅助提取法和乙醇浸提法对枇杷花黄酮得率的影响
以体积分数60%乙醇溶液为提取溶剂,料液比为1∶30(g∶mL),在60℃的恒温水浴中浸提2 h,乙醇浸提法得到黄酮得率为91.041 mg/g;其他条件相同,280 W超声波超声提取40 min,超声辅助提取法得到黄酮得率102.094 mg/g,超声波法的提取效果比乙醇浸提法提高了12.14%.在其他提取条件相同的前提下,超声波法提取时间仅需40 min,与传统浸提法相比,具有省时、提取率高、设备简单等优点.
2.3 响应面实验结果与分析
2.3.1 响应面实验结果
Box-Behnken中心组合试验设计以及实验结果如表2所示.通过Design Expert 7.0软件对表2实验数据进行多元回归拟合及对模型进行方差分析,得到以下回归方程:y=276.48371+3.19886a-2.28722b - 7.17210c - 0.53878d+0.042030ab - 0.031266ac+0.025978ad+0.012988bc+0.004147bd- 0.017562cd -0.033086a2-0.014787b2+0.078044c2-0.003351d2.其中:y为黄酮得率 (mg/g);a为乙醇体积分数 (%);b为料液比 (g∶mL);c为超声温度 (℃);d为超声时间 (min).
P水平是检验回归系数的标准,P<0.05、P<0.01和P>0.05分别表明回归方程显著、极显著和不显著[25].由表3可知,A(乙醇体积分数)、B(料液比)、D(超声时间)对Y(黄酮得率)影响极显著,而C(超声温度)不显著,AB、AC项P<0.01,说明乙醇体积分数和料液比、乙醇体积分数和超声温度两因素间的交互作用影响极显著,AD项P<0.05,说明乙醇体积分数和超声时间两因素间的交互作用影响显著,而其他因素间交互影响均不显著.
从整体分析,该回归模型F检验极显著(P<0.01),其失拟项检验P=0.062 6>0.05,不显著,表明该模型与实际情况拟合程度较好,可用此模型对试验进行分析和预测.其决定系数R2=0.949 8,说明预测值和实测值之间具有高度相关性,响应值的变化有94.98%与所选变量相关,仅有10.03%的变异不能由该模型解释(=0.899 7),变异系数为1.90%,说明实验有较好的精确度和可靠性,可以用该回归方程代替真实试验点对试验结果进行分析和预测.因此,此模型能较好地描述各因素与响应值之间的关系,可用此模型对枇杷花黄酮得率进行分析预测.
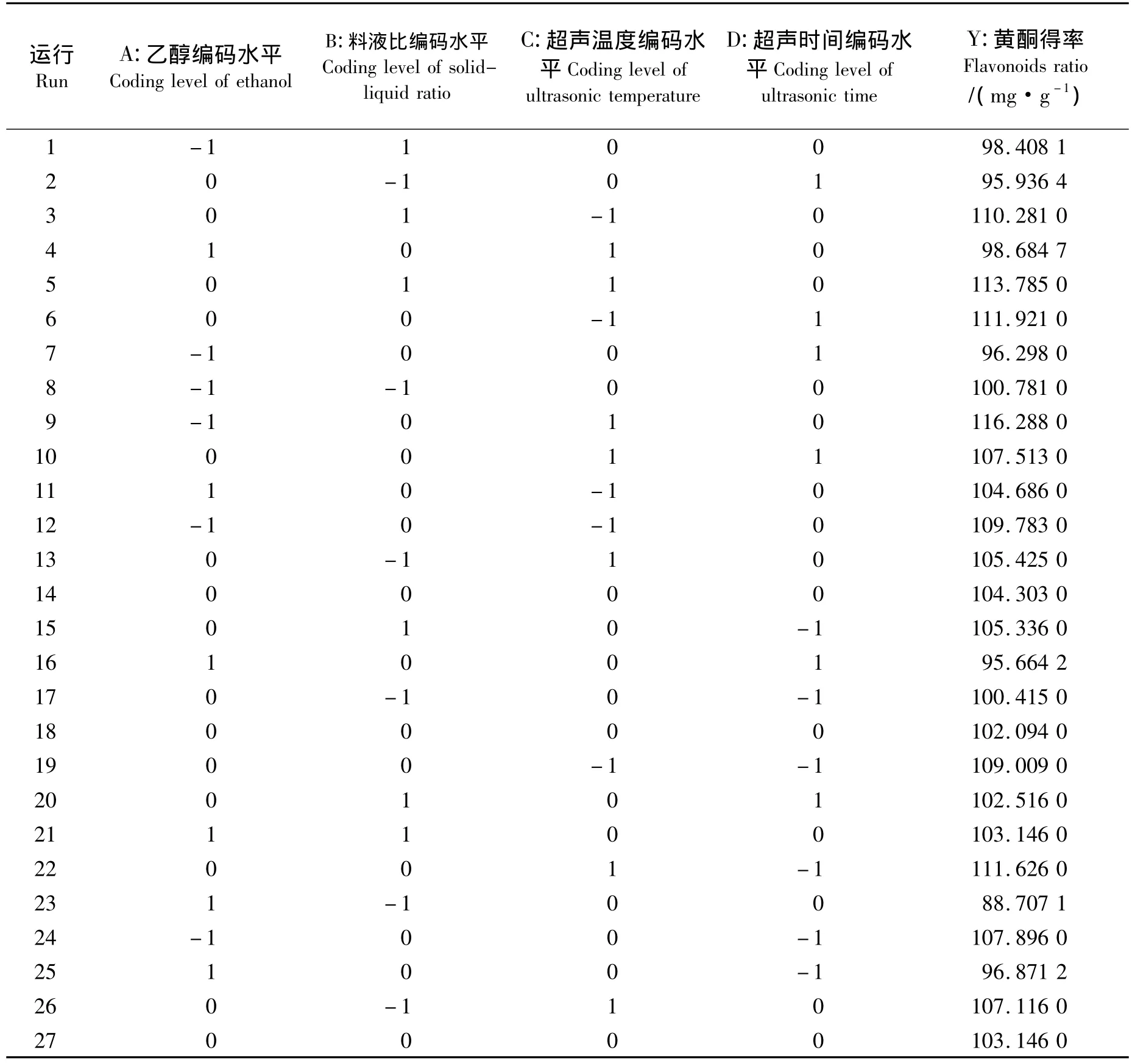
表2 响应面试验方案和结果Tab.2 The plan and results for response surface methodology
2.3.2 黄酮得率的方差分析
对得到的多元二次回归模型进行方差分析,方差分析结果及模型系数显著性如表3所示.
2.4 枇杷花黄酮提取的响应面分析与优化
根据回归模型预测各因素对黄酮得率的影响如图6所示.图6的6组图分别显示了不同交叉因素对黄酮得率的交互作用影响趋势,响应面图根据曲面的倾斜程度来反映两因素交互作用的显著程度,当曲面越陡,交互作用越显著,而曲面越光滑,交互作用就越小.由图6b可知,当浸提温度为50℃时,黄酮得率随着乙醇体积分数的增大而增大,超声温度与乙醇体积分数间有简单的线性关系,但随着温度的升高,这种简单的线性关系被破坏,而当温度达到60℃时,乙醇体积分数对黄酮得率的影响大大减弱.图6c为料液比为1∶30(g∶mL)、超声温度为60℃时,乙醇体积分数和超声时间两因素的交互作用,可知其交互作用显著.在较低的因子水平时,随着乙醇体积分数和超声时间的增大,黄酮得率逐渐升高.但当固定乙醇体积分数时,黄酮得率随着超声时间的延长先上升后下降;而当固定超声时间时,枇杷花黄酮得率随着乙醇体积分数的增大同样呈现出先增后降的趋势,这两种变化均与单因素实验分析的结果是一致的.因此,通过对各因素交互作用影响的响应面图和等高线图的分析,可以直观地判断各因素间的交互作用显著程度以及各单因素的变化趋势.
由SAS典型性分析知,四因素的特征值有正有负,表明二次响应面为鞍面,无极值存在.通过岭脊分析得到最大响应值时A、B、C、D对应的编码值分别为0.361491、1.448172、-0.069884、-0.168775,转化为非编码值分别为63.614907、44.481717、59.301162、38.312252.考虑实际操作的局限性,将各因素理论值修正为:乙醇体积分数为64%,料液比为1∶44(g∶mL),超声温度59℃,超声时间38 min.而模型预测枇杷花黄酮得率为104.384 mg/g.在此最优条件下进行验证实验,3次平行实验测得黄酮得率分别为:108.702、106.763、103.802 mg/g,3次取平均值为106.422 mg/g,与理论预测值误差为1.9%,验证了模型能较好地预测实际黄酮得率.
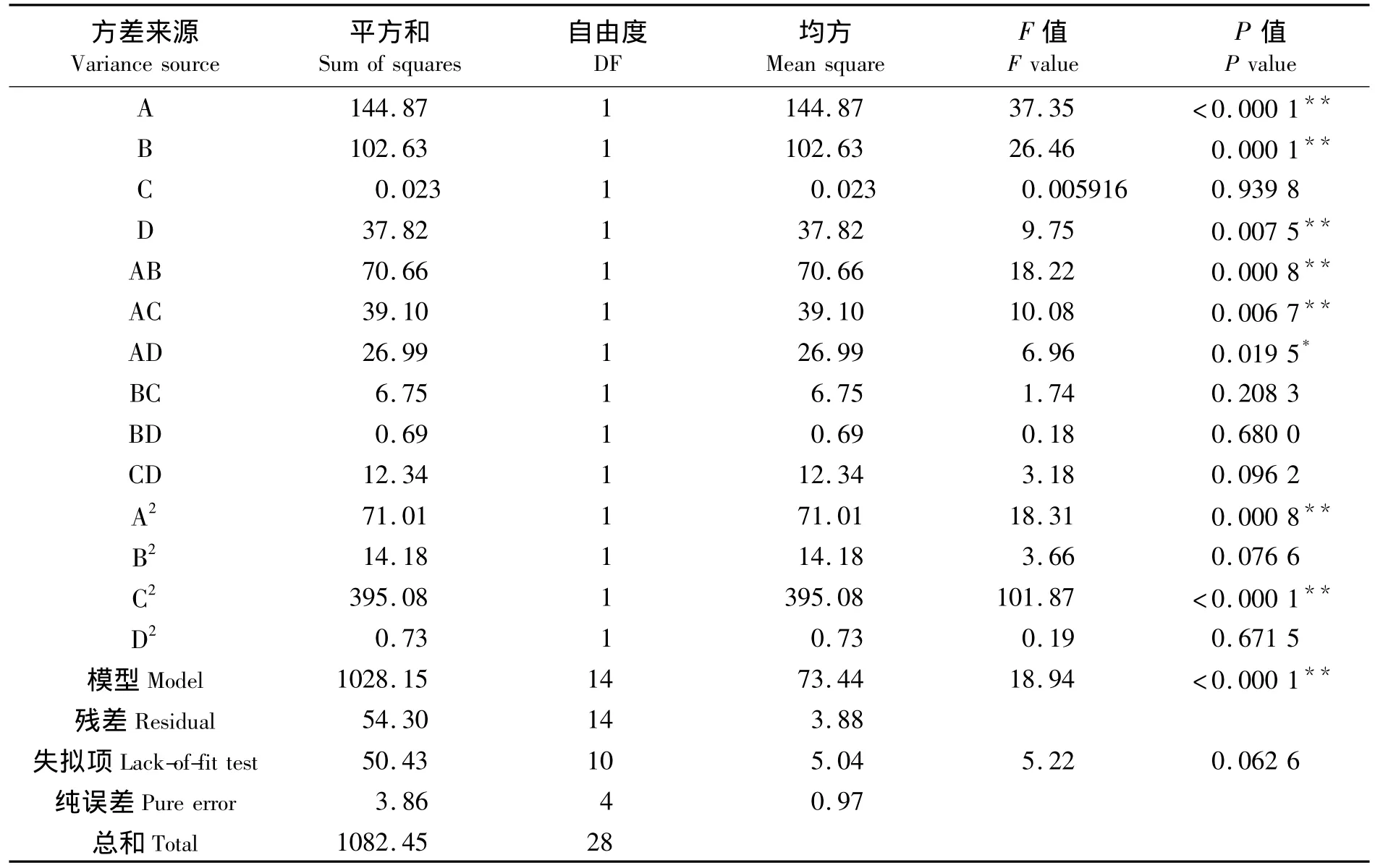
表3 回归模型方差分析表Tab.3 Variance analysis of the regression equation
3 结论
通过中心组合试验设计和响应面分析法考查乙醇体积分数、料液比、提取时间及提取温度对枇杷花黄酮得率的影响,得到枇杷花黄酮超声波辅助提取工艺的多元二次回归模型:y=276.48371+3.19886a - 2.28722b - 7.17210c - 0.53878d+0.042030ab - 0.031266ac+0.025978ad+0.012988bc+0.004147bd - 0.017562cd - 0.033086a2- 0.014787b2+0.078044c2- 0.003351d2.其中:y为黄酮得率 (mg/g);a为乙醇体积分数 (%);b为料液比 (g∶mL);c为超声温度 (℃);d为超声时间(min).
方差分析结果表明,该模型F检验极显著,其失拟项检验不显著,决定系数R2为0.9498,表明该模型能较好地预测枇杷花黄酮得率随各因素变化的规律.
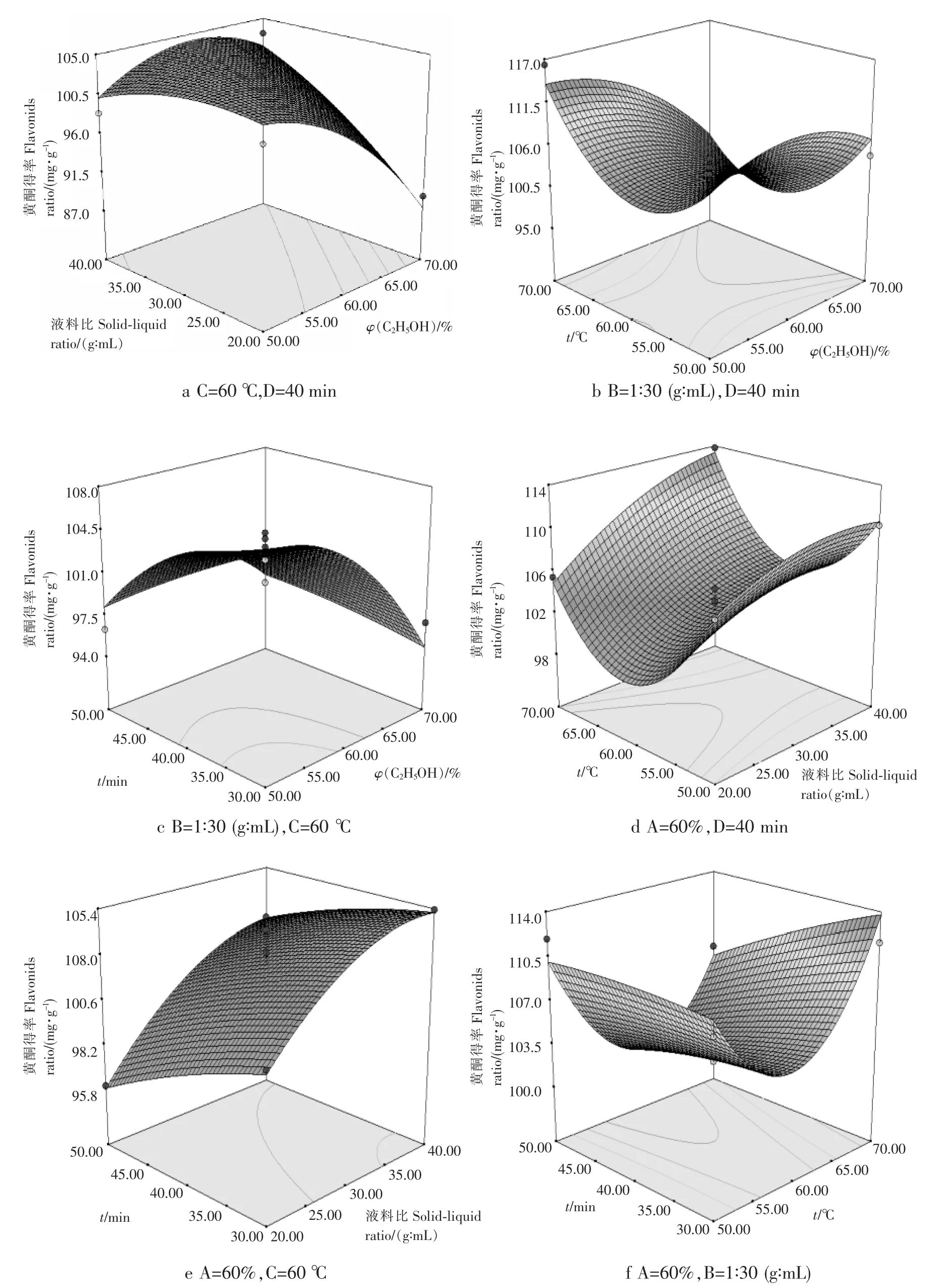
图6 各因素及其交互作用对黄酮得率的影响Fig.6 The effect of various factors and interaction on flavonoids ratio
响应面法优化得到枇杷花黄酮提取的最佳工艺条件为:乙醇体积分数为64%,料液比为1∶44(g∶mL),超声温度59℃,超声时间38 min.在此条件下,枇杷花黄酮提取量为106.422 mg/g,与理论预测值误差仅为1.9%,表明该模型能较好地预测枇杷花实际黄酮得率.响应面法能较好地优化枇杷花黄酮的超声波辅助提取工艺.
[1]全国中草药汇编小组.全国中草药汇编 [M].2版.北京:人民卫生出版社,1996:504.
[2]邓晶晶,卢先明,蒋桂华,等.枇杷花镇咳祛痰和抗炎的药效学研究[J].时珍国医国药,2006,17(12):2469-2470.
[3]孙苏逖,王张,孟宪丽,等.枇杷花提取物镇咳作用有效剂量的筛选研究[J].中药药理与临床,2010,26(5):94-96.
[4]王静波,杨必坤,张宏,等.枇杷花提取物止咳作用研究 [J].中草药,2009,40(7):1106-1109.
[5] HARTONEN K,PARSHINTSEV J,SANDBERG K,et al.Isolation of flavonoids from aspen knotwood by pressurized hot water extraction and comparison with other extraction techniques[J].Talanta,2007,74(1):32-38.
[6] BAHAR ALIAKBARIAN,ALI FATHI,PATRIZIA PEREGO,et al.Extraction of antioxidants from winery wastes using subcritical water[J].The Journal of Supercritical Fluids,2012,65:18-24.
[7]吕帮玉,杨新河,毛清黎.微波-碱水浸提银杏叶黄酮的研究 [J].安徽农业科学,2009,37(9):4124-4127.
[8] ZHANG L,SHAN Y,TANG K J,et al.Ultrasound-assisted extraction flavonoids from Lotus(Nelumbo nuficera Gaertn)leaf and evaluation of its anti-fatigue activity [J].International Journal of Physical Sciences,2009,4(8):418-422.
[9]李昌宝,游向荣,孙健,等.超声强化提取山黄皮果总黄酮及其抗氧化活性的研究[J].食品工业科技,2012,33(5):265-268.
[10]陈文伟,张中伟,赵静,等.杨梅叶总黄酮超声-微波协同萃取研究[J].江苏农业科学,2011,39(4):332-334.
[11] TSUYOSHI INOUE,SHUNTARO TSUBAKI,KAZUNORI OGAWA,et al.Isolation of hesperidin from peels of thinned Citrus unshiu fruits by microwave-assisted extraction [J].Food Chemistry,2010,123(2):542-547.
[12]王文渊,唐守勇,龙红萍.超临界CO2流体萃取苦瓜叶中黄酮的研究 [J].食品与机械,2011,27(6):98-101.
[13] KAWAHITO Y,KONDO M,MACHMUDAH S,et al.Supercritical CO2extraction of biological active compounds from loquat seed [J].Separation and Purification Technology,2008,61(2):130-135.
[14]徐升运,赵文娟,陈卫锋,等.生物酶法提取沙棘果渣总黄酮工艺的优化 [J].湖北农业科学,2012,51(5):983-986.
[15] WANG Y,ZU Y G,LONG J J,et al.Enzymatic water extraction of taxifolin from wood sawdust of Larix gmelini(Rupr.)Rupr.and evaluation of its antioxidant activity [J].Food Chemistry,2011,126(3):1178-1185.
[16] LI S A,ZHU R H,ZHONG M,et al.Effects of ultrasonic-assistant extraction parameters on total flavones yield of Selaginella doederleinii and its antioxidant activity[J].Journal of Medicinal Plants Research,2010,4(17):1743-1750.
[17] ZHU X Y,MANG Y L,XIE J,et al.Response surface optimization of mechanochemical-assisted extraction of flavonoids and terpene trilactones from Ginkgo leaves[J].Industrial Crops and Products,2011,34(1):1041-1052.
[18]张吉祥,欧来良.正交试验法优化超声提取枣核总黄酮 [J].食品科学,2012,33(4):18-21.
[19]周湘池,娄永江,刘必谦,等.一种枇杷花醋及其制备方法:中国,101096629[P].2008-01-02.
[20]林岳.枇杷花蜜酒及其制作方法:中国,101215503[P].2008-07-09.
[21]林永金.一种塘栖枇杷花露的制作方法:中国,100452997[P].2009-01-21.
[22]何顺光.百合清开灵制剂及其制备方法:中国,100724949[P].2008-12-26.
[23]赵大洲,钱渊华,钱渊木.一种枇杷花总皂苷及其制备方法和应用:中国,101259175[P].2008-09-10.
[24]张宏,张晓喻,陶宗娅,等.一种枇杷花提取物、含有该提取物的组合物及用途:中国,1977907[P].2007-06-13.
[25]方开泰.实用回归分析 [M].北京:科学出版社,1988:166-169.
(责任编辑 马建华 英文审校 曹敏杰)
Optimization of Extraction Technology of Flavonoids from Loquat Flower by Response Surface Methodology
XIE Tian-wei,CHEN Fa-he,WU Guang-bin
(College of Biological Engineering,Jimei University,Xiamen 361021,China)
Ultrasonic-assisted extraction method was used to investigate the extraction of flavonoids from loquat flower.The method of response surface analysis with four factors and three levels was adopted to optimize the extraction conditions of flavonoids on the basis of single-factor experiment.The results showed that optimal conditions for extraction of flavonoids could be reached using 64%ethanol as extraction solvent with solid and liquid ratio 1∶44(g∶mL)at 59 ℃ for 38 minutes.Under these conditions,the yield of flavonoids from loquat flower was 106.422 mg/g.
loquat flower;flavonoids;ultrasonic-assisted;response surface methodology
TS 209
A
1007-7405(2012)05-0343-08
2012-05-14
2012-06-11
国家自然科学基金资助项目 (31171777);厦门市科技计划项目 (3502Z20103024)
谢田伟 (1985—),男,硕士生,从事农产品加工技术方向研究.通讯作者:陈发河 (1960—),男,教授,从事农产品贮藏与加工方向研究,E-mail:fhchen@jmu.edu.cn.
