人工感染呼肠孤病毒对拟穴青蟹部分免疫因子的影响
2012-09-07李君华朱小明
邹 清,李君华,朱小明
(1.厦门大学环境与生态学院,福建厦门361005;2.国家海洋局温州海洋环境监测中心站,浙江温州325000;3.山东东方海洋科技股份有限公司,山东烟台264003)
人工感染呼肠孤病毒对拟穴青蟹部分免疫因子的影响
邹 清1,2,李君华1,3,朱小明1
(1.厦门大学环境与生态学院,福建厦门361005;2.国家海洋局温州海洋环境监测中心站,浙江温州325000;3.山东东方海洋科技股份有限公司,山东烟台264003)
采用注射和浸泡的方式人工感染拟穴青蟹呼肠孤病毒,研究了其对拟穴青蟹血细胞密度以及血清中酚氧化酶 (PO)、超氧化物歧化酶 (SOD)和碱性磷酸酶 (AKP)活力的影响.结果表明:注射(第Ⅱ组)和浸泡 (第Ⅳ组)方式均能感染健康青蟹,病发死亡时间为7~9 d,死亡率达100%,血细胞平均密度在试验36~72 h间迅速上升并达最高值,其血细胞密度最高值分别为1.4008×107cells/mL与1.8243×107cells/mL;感染病毒的青蟹PO活性均大致呈现下降的趋势,其中,第Ⅳ组感染12 h青蟹PO活性相对对照组显著升高(P<0.05),其值为(6.90±1.54),达实验所测PO活性最高值;各实验组血清SOD活性呈无规律的变化;AKP活性感染组与对照组表现不同.表明测定血细胞密度以及PO和AKP活性可用来辅助诊断青蟹疾病,而SOD活性变化不能很好地表征青蟹受病毒感染的状况.
拟穴青蟹;呼肠孤病毒;免疫因子
0 引言
拟穴青蟹(Scylla paramamosain)是我国东南沿海重要的养殖蟹类之一.近年来,随着养殖规模的扩大,养殖环境不断恶化,各种疾病频繁暴发,已造成严重损失.蟹类病毒病的研究已经成为关注的焦点[1-3],国内蟹类病毒病的研究主要集中在中华绒鳌蟹上,而针对拟穴青蟹病毒病的研究近几年才有部分报道[4-6].
蟹类不具备获得性免疫,仅有天然免疫,其生理防御体系主要由血细胞和体液中多种免疫因子所构成,机体受到病原生物入侵自然会产生相应的免疫应答,如血细胞的组成和密度,血清中相关酶活性等会发生相应变化.文献[6]报道在漳州龙海和厦门同安青蟹养殖场所取病蟹样品中分离出一株球状病毒.本文拟在此基础上,进行人工感染实验,测定血细胞密度和血清中酚氧化酶 (PO)、超氧化物歧化酶 (SOD)和碱性磷酸酶 (AKP)的活性,用以辅助诊断青蟹疾病,并通过这些相关指标的变化了解实验青蟹在感染病毒时的生理反应情况,判断病毒的致病性以及致病途径、过程和时间,为疾病的防治提供重要理论依据,促进青蟹养殖业健康、稳定、持续的发展.
1 材料与方法
1.1 实验材料及饲养条件
患病濒死的拟穴青蟹取自漳州龙海和厦门同安部分养殖场,带回实验室于-70℃保存待用.健康青蟹购于厦门第八市场,所选青蟹体色鲜艳,无病无伤,平均体重(106.9±12.2)g,饲养于容积100 L水箱中,每箱10~15只,整个饲养过程在弱光条件下进行,微充气,以新鲜菲律宾蛤仔(Ruditapes philippinarum)投喂,日换水约1/3,及时清除残饵、粪便和因运输及环境变化造成的死亡个体,7 d后开始实验,整个实验过程中,水温19~23℃,盐度28~30,pH=6.8.
1.2 实验方法
1.2.1 感染液的制备
感染液Ⅰ:配制0.85%的生理盐水,高压灭菌后,4℃保存备用;感染液Ⅱ:解剖病蟹,取出肝胰腺、性腺、肌肉、鳃等各种组织器官共5 g,加入10 mL磷酸缓冲液,冰水浴中匀浆,3000 r/min、4℃离心20 min,取中层清液,8000 r/min、4℃离心30 min,上清液经0.45 μm微孔滤膜抽滤,所得滤液即病蟹组织粗提液,4℃保存备用;感染液Ⅲ:健康青蟹组织粗提液按病蟹组织粗提液的制备方法制备;感染液Ⅳ:病蟹所剩组织器官加入一定比例的磷酸缓冲液,冰水浴中匀浆,8000 r/min、4℃离心30 min,取中层清液,所得组织液4℃保存备用.
1.2.2 人工感染
实验一:第Ⅰ组,注射无菌生理盐水 (0.2 mL/mg),于第4步足基部向体腔内注射,此组作为对照组;第Ⅱ组,注射病蟹组织粗提液 (感染液Ⅱ),注射方法和剂量与第Ⅰ组相同;第Ⅲ组,注射健康青蟹组织粗提液 (感染液Ⅲ),注射方法和剂量与第Ⅰ组相同;第Ⅳ组,感染液Ⅳ用海水稀释200倍,实验青蟹浸入其中,12 h后移入实验水箱.以上各组青蟹分别用2个水箱饲养,每箱5只,记录死亡情况,如果第Ⅱ组和第Ⅳ组青蟹全部死亡,仍继续观察待实验结束.
实验二:各组青蟹感染方式同实验一,每组30只,分成3个箱饲养.从实验开始,分别于第12、36、72、108、144 h从每箱各取1只蟹,采用断肢法收集血淋巴.
1.2.3 样品制备
取0.1 mL血淋巴加入等量抗凝剂 (0.14 mol/L NaCl,0.1 mol/L葡萄糖,0.03 mol/L柠檬酸钠,0.026 mol/L柠檬酸,0.01 mol/L EDTA,pH=6.4),用血球计数板在显微镜下计数;其余血淋巴4℃放置24 h后低速离心析出上清液作为血清样本,-70℃保存待用.
1.2.4 血清酶活性的测定
1)酚氧化酶PO活性的测定
以L-dopa为底物测定PO活性.将0.l mol/L,pH=6.0的磷酸钾盐缓冲液3.9 mL与0.0l mol/L的L-dopa 1.0 mL以及100 μL血清于室温下混匀,30℃孵育5 min,每间隔2 min读取在490 nm波长下的吸光度值.以试验条件下每1 min OD490增加0.001定义为一个酶活性单位.
2)超氧化物歧化酶SOD活性的测定
采用南京建成生物研究所生产的试剂盒进行测定,具体方法按试剂盒说明进行.SOD酶活性定义为每毫升反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位.
3)碱性磷酸酶AKP活性的测定
采用南京建成生物研究所生产的试剂盒进行测定,具体方法按试剂盒说明进行.AKP酶活性定义为,100 mL血清在37℃与基质作用15 min产生1 mg酚为1个金氏单位.
1.3 数据统计
在SPSS 11.0数据处理软件上统计平均值、标准差,采用one-way ANOVA系统进行分析.
2 结果
2.1 人工感染试验结果
人工感染实验在第十六天结束,实验结果见表1.注射病蟹组织粗提液组 (第Ⅱ组)和浸泡病蟹组织粗提液组 (第Ⅳ组)所有青蟹至第九天全部死亡,最早全部死亡的是第Ⅱ组2号箱,感染第六天死亡;第九天时对照组 (第Ⅰ组)2个水箱中青蟹死亡率均为20%,注射健康青蟹组织粗提液组(第Ⅲ组)死亡率分别为20%和40%,此后7 d中以上两组陆续还有青蟹死亡,最终死亡率,第Ⅰ组分别为40%和80%,第Ⅲ组分别为100%和60%;各实验组初次出现死亡的时间有所不同,其中第Ⅳ组为第三天,其余3组可能因采用注射方式处理,对青蟹伤害较大,大部分水箱在实验第一天均出现死亡.
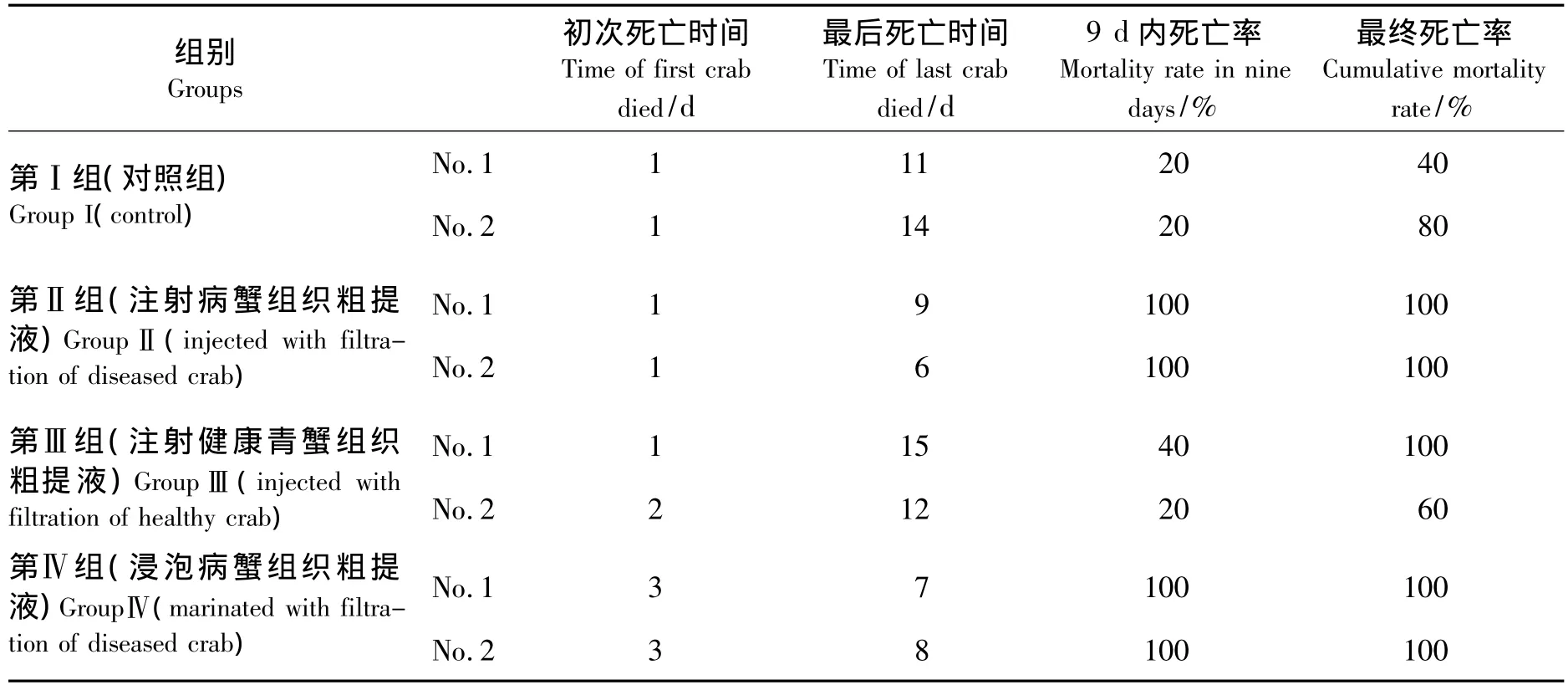
表1 人工感染试验结果Tab.1 Experimental infection of mud crabs with virus extraction
2.2 血细胞密度变化
血细胞密度变化实验结果见图1a.从整体趋势上看,对照组血细胞密度没有明显变化;第Ⅲ组与对照组相比无显著差异,这两组青蟹血细胞密度始终维持在比较平稳的状态;而经过病蟹组织粗提液处理的第Ⅱ组和第Ⅳ组,血细胞密度呈现急剧上升而后迅速下降的变化趋势.第Ⅳ组青蟹血细胞密度在第36 h时从5.626×106cells/mL上升至1.4008×107cells/mL,与其他3组差异极显著(P<0.01),此后又继续升高,到第72 h达到最高峰,为2.8534×107cells/mL,此刻,第Ⅱ组青蟹血细胞密度也上升到1.8243×107cells/mL的最高值,这两组与对照组和第Ⅲ组表现出极显著差异(P<0.01);从108 h直至实验结束,第Ⅱ组和第Ⅳ组血细胞数量又下降至与对照组和第Ⅲ组无显著差异的水平.
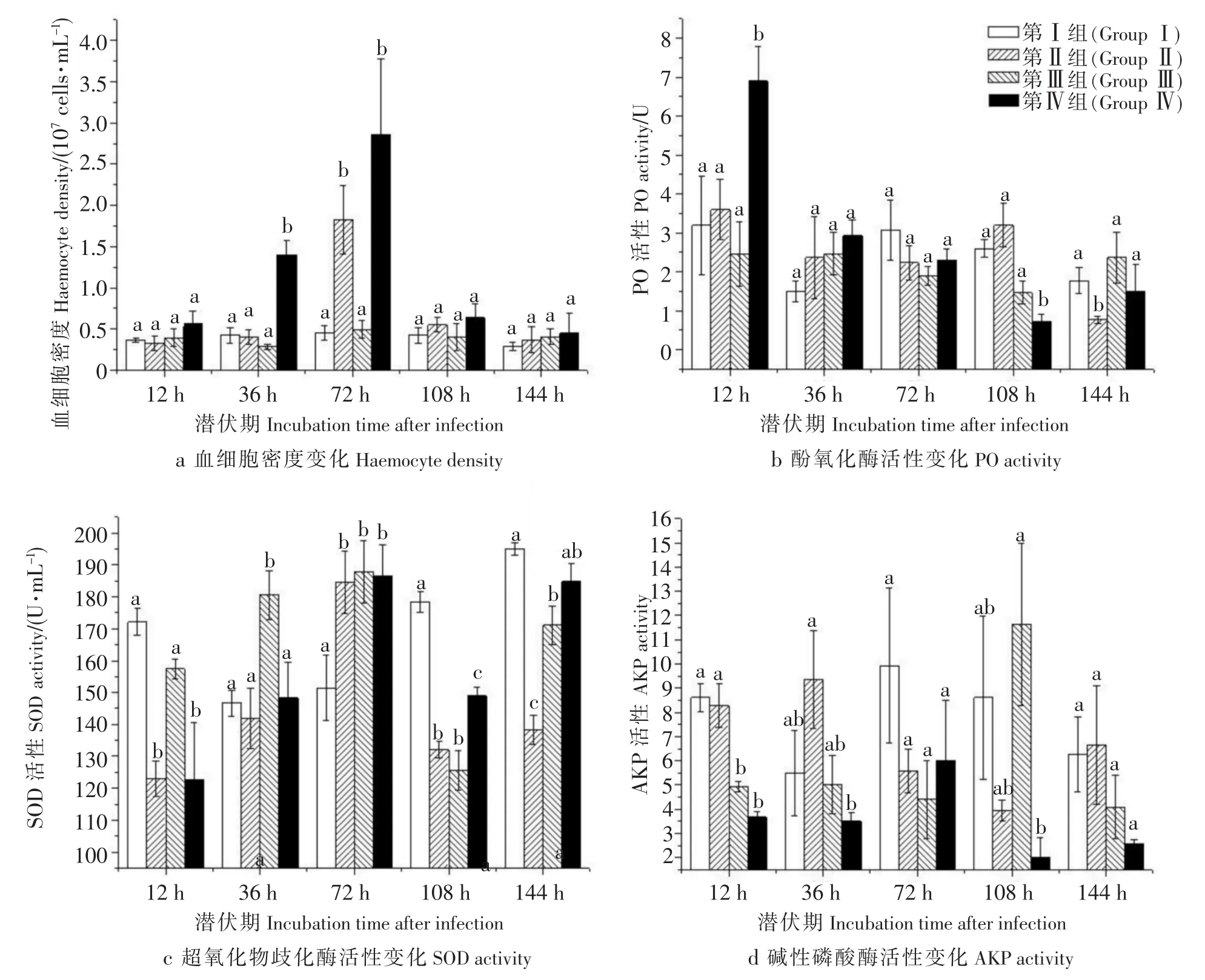
图1 各试验组青蟹生化指标变化Fig.1 Comparison of haemocyte density between the different experimental groups
2.3 PO活性变化
PO活性变化实验结果 (如图1b所示):试验开始12 h,与对照组相比,第Ⅱ组和第Ⅲ组PO活性没有显著差异,第Ⅳ组显著升高(P<0.05),其值为(6.90±1.54),这是整个实验中所测PO活性最高值;至36 h,第Ⅳ组PO活力下降,各组没有显著差异,此规律一直持续到72 h;至108 h,第Ⅲ组和第Ⅳ组PO活性相对对照组显著降低(P<0.05),而第Ⅱ组与对照组没有显著差异;至144 h,第Ⅱ组与对照组相比PO活性显著降低(P<0.05),其余两组与对照组没有显著差异.从整体趋势上看,对照组和第Ⅲ组各时间段没有明显差异;而经病蟹组织粗提液感染过的第Ⅱ组和第Ⅳ组,青蟹血清PO活性大致呈现下降趋势,其中第Ⅱ组从12 h至72 h逐渐下降,至108 h略有回升,但没有明显差异,至144 h,PO活性相比12 h和108 h显著降低(P<0.05);第Ⅳ组,12 h的PO活性相比其他时间段升高极显著(P<0.01),72 h和36 h没有显著差异,而108 h和144 h相比36 h显著降低(P<0.05).
2.4 SOD活性变化
SOD活性变化实验结果见图1c.12 h时,第Ⅱ组和第Ⅳ组青蟹血清SOD活性相对于对照组和第Ⅲ组显著降低(P<0.05);36 h时,第Ⅱ组和第Ⅳ组与对照组差异不明显,但第Ⅲ组SOD值明显高于其他3组(P<0.05);72 h时,第Ⅱ、Ⅲ和第Ⅳ组SOD值相比对照组显著升高(P<0.05);至108 h时,这3组与对照组相比,SOD值又有显著下降(P<0.05);144 h时,第Ⅱ组相对对照组SOD值显著降低(P<0.05),其他两组与对照组没有明显差异.各组SOD活力值整体变化趋势:对照组有所起伏,36 h和72 h相比12 h显著下降(P<0.05),108 h和144 h相比前两次又明显升高(P<0.05),其中108 h与12 h无明显差异,而144 h SOD值明显高于12 h(P<0.05);第Ⅲ组SOD值除第108 h有明显降低之外(P<0.05),其余时间没有显著差异;第Ⅱ组72 h SOD值有明显升高(P<0.05),其余时间段没有明显差异;而第Ⅳ组变化情况与第Ⅱ组类似,不同的是在实验最后有显著升高的过程(P<0.05).
2.5 AKP活性变化
AKP活性变化实验结果见图1d,12 h时,第Ⅲ组和第Ⅳ组青蟹血清AKP活性相比对照组显著降低(P<0.05),第Ⅱ组和对照组没有显著差异;36 h时,第Ⅳ组相比对照组AKP值显著降低(P<0.05),第Ⅱ组和第Ⅲ组与对照组没有显著差异;72 h时各组AKP值没有显著差异,至108 h,第Ⅱ组和第Ⅳ组比对照组AKP显著降低(P<0.05),第Ⅲ组和对照组没有明显差异;144 h时,各组没有显著差异.各组变化趋势:对照组没有显著差异,第Ⅳ组各时间段也没有显著差异;而第Ⅱ组和第Ⅲ组整个过程有所波动,其中第Ⅱ组108 h时AKP值显著低于36 h时(P<0.05),而第Ⅲ组在108 h时AKP值显著高于其他各时间段(P<0.05).
3 讨论
目前至少发现有8种蟹类呼肠孤病毒,均能引起严重的疾病并且容易大面积传播,比如P病毒和RLV病毒感染会引起蟹类反应迟缓、附肢麻痹瘫痪等症状;中华绒螯蟹“颤抖病”也主要由呼肠孤病毒引起[3,5,7-13].青蟹中未发现有类似明显症状,但青蟹受到呼肠孤病毒感染后附肢自切是较普遍现象.实验结果表明,注射和浸泡的方式都能感染青蟹,而且浸泡组的青蟹发病速度几乎不亚于注射组,9 d内这两组蟹全部死亡.可以推断该病毒以水平传播方式为主,而且极容易相互传染,所以本研究认为这种呼肠病毒极可能是引起最近养殖青蟹短期内大规模死亡的首要原因.
3.1 血细胞变化
甲壳动物免疫防御系统由基本防御屏障 (甲壳和表皮)、细胞防御屏障和生理防御屏障3部分组成[14-15].不同类型的血细胞在甲壳动物免疫系统中所起作用不同,其中吞噬作用是最重要的细胞免疫反应,吞噬的过程包括:异物的识别、黏连、聚集、摄入和清除等.各种血细胞在异物吞噬过程中协同发挥作用:透明细胞具有较强的吞噬能力,这种能力可以被酚氧化酶原系统组分激活;小颗粒细胞在脱颗粒后才具有吞噬活性;大颗粒细胞无吞噬能力,但颗粒内含大量酚氧化酶原,经胞吐释放大量活性酚氧化酶,进而促进透明细胞的吞噬作用[16].
研究表明,血细胞的数量和组成总是伴随甲壳动物自身的生理状况及周围水体环境因子如温度、盐度、pH值等的改变而不断发生变化,常被用作甲壳动物健康状况的评定指标[17].于建平用镰刀菌(Fusarium solani)感染日本囊对虾,14 d后发现血细胞密度减少为对照组的54.3%,血细胞比例也发生变化,其中小颗粒细胞比例下降11.9%,而大颗粒细胞比例升高10.6%[18];Hauton等用曼利斯顿菌(Listonella anguillarum)感染三叶真蟹,7 d后发现血细胞密度从46.41×106cells/mL下降至20.76×106cells/mL[19].血细胞吞噬外来异物,或者聚集在某些创伤处用于清除病灶,导致自身死亡,因此数量会减少;而且很多病原生物会破坏宿主造血组织,阻碍新的血细胞生成.但是,血细胞数量不会持续下降,Pascual等研究发现,机体为维持正常的生理功能,必须通过启动一系列生理生化反应,然后将部分组织细胞迁移至循环系统中以补充损失的血细胞,来应对外界的胁迫,因此血细胞数量变化会出现波动的现象.将白滨对虾(Litopenaeus setiferus)环境温度从24℃持续升高到33℃,其血细胞数量逐渐升高,至第3 d开始下降,第6 d降至最低,随后又慢慢回升,表现一种周期性波动,即血细胞每隔48~94 h迁移一次[20].本研究发现,青蟹受到病毒感染后,血细胞数量在36 h开始显著上升,至72 h达到高峰,随后又迅速下降,呈现出剧烈波动的现象,这说明呼肠孤病毒侵染可能发生在第36~72 h,病毒侵入青蟹体内并增殖,刺激机体产生大量血细胞来清除干扰,但是随着病毒大量复制,引起血细胞大量死亡或者造血功能的障碍,血细胞数量又迅速减少.
3.2 酚氧化酶变化
甲壳动物的酚氧化酶原 (proPO)系统是一种类似于脊椎动物补体系统的酶级联,也是体液免疫因子中最重要的部分.一般认为,正常生理条件下酚氧化酶原以非活化状态存在于血细胞颗粒中,可以被β -1,3-葡聚糖(β -1,3-glucan,βG)、脂多糖 (lipopolysaccharide,LPS)、肽聚糖 (peptidoglycan,PG)、胰蛋白、十二烷基硫酸钠 (sodium dodecyl sulfate,SDS)、加热或Ca2+浓度下降等条件所诱导并活化.当与异物反应时,酚氧化酶原被释放到血淋巴中,在丝氨酸蛋白酶的作用下产生活性的酚氧化酶[21],酚氧化酶可以将酚催化成黑色素,酚氧化酶、黑色素及其中间产物通过多种方式参与宿主防御反应,包括提供调理素,促进血细胞吞噬作用,以及介导凝集和凝固,产生杀菌物质,参与细胞间信息传递等,因此,酚氧化酶活性大小在一定程度上可以反映虾蟹对病害入侵的应答情况.
据实验结果来看,对照组和第Ⅲ组各时间段PO活性没有显著差异,受感染的第Ⅱ组和第Ⅳ组PO活性大致呈现下降的趋势,最终显著低于对照组,证实其变化规律与病害侵入有一定关系,但是受到实验条件限制,所测血清样品取自不同的青蟹,然后取平均值进行统计分析,由于青蟹自身个体生理状况差异较大,所以尚不能确定PO活性与时间的对应关系.实验中所测PO活性最高值出现在第Ⅳ组12 h,为6.90 U,与其他组差异极显著(P<0.01),而且此后下降趋势较为明显,在取样时发现该组青蟹血淋巴微红,不易凝固,可能是青蟹浸泡在病蟹组织粗提液中长时间处于强应急状态,血细胞出现自溶现象,导致酚氧化酶原的释放和激活,PO活性明显升高,此后血淋巴颜色逐渐恢复为淡蓝色,但PO活性始终处于最低水平.
Hauton等研究发现三叶真蟹PO活性与潮汐变化、水温、盐度、水体总悬浮颗粒、有机物含量和细菌种群数变化相关,其中细菌数量的高峰值明显对应PO活性的高峰值[19].还有许多研究表明适量病原体抗原的存在能激活实验虾蟹的免疫反应,有利于提高机体的抗菌力和应急力,Sung等将实验时暂养的斑节对虾浸泡与热致死的弧菌悬浮液中,与对照组相比,PO活性增加了13倍,李天道等以不同浓度的弧菌悬液注射感染对虾,发现小剂量的弧菌可以诱导血清中PO活性增高而且能保持一段时间,剂量超过临界值才会造成负面影响[22].在本实验中没有发现这样的现象,仅有浸泡组PO活性在短时间内显著升高,这可能不是由于病毒侵入而引起,而是被水体中悬浮颗粒量的增加而诱导,实际上青蟹受到病毒感染后PO活性呈逐渐下降的趋势.呼肠孤病毒致病机理可能与水体中许多条件致病菌不同,当水体中细菌数量超过某个临界值才会引起宿主患病,但是青蟹一经呼肠孤病毒感染,无论剂量大小,短时间内即会引发不可恢复的病理变化,而不存在某种临界状态,这与雷质文等人研究WSSV对中国明对虾PO活性影响的结果类似[23].
3.3 超氧化物歧化酶SOD变化
抗氧化系统由一些能够被氧化应激诱导的酶组成,包括超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶 (GPX)等,其中SOD可以催化超氧阴离子生成H2O2.研究表明,SOD活性与生物的免疫水平密切相关,可作为机体非特异性免疫指标,甚至定量指标,其活性的变化反映了机体抵制自由基损伤的能力[24].
免疫细胞在吞噬病原微生物后,依赖活性氧的杀伤机制,即所谓的呼吸爆发.甲壳动物的呼吸爆发现象是近十几年来才被发现的,Bell和Smith研究发现三叶真蟹血细胞可产生超氧阴离子[25],Muñoz等也证实了凡纳滨对虾(Penaeus vannamei)体内超氧阴离子的存在[26].大量研究表明,实验动物患病后SOD活性呈显著下降趋势,主要是机体在病原体的诱导下产生过多活性氧的缘故.王江勇等发现杂色鲍(Haliotis diversicolor)血清中SOD活性在注射病毒悬液后8 h开始变化,从初始水平(222.96 U)升至最高 (321.08 U),然后逐渐降低,至48 h降至最低,并低于初始水平[27].而作者发现,各实验组青蟹血清SOD活性呈无规律的变化,即使是对照组也出现不断的波动,受感染的两组其SOD活性大致上低于对照组,但不明显,有时也出现高于对照组的情况,因此SOD活性变化不能很好地表征青蟹受病毒感染的状况.可能有以下几方面原因:1)雌雄差异较大,比如克氏原螯虾(Procambius clarkii)和罗氏沼虾(Macrobrachium rosenbergii)雄性个体SOD活性略高于雌性个体[28],而本文在实验中没有分开测定,造成规律不明显;2)个体差异较大,以致掩盖SOD实际变化规律;3)SOD受环境胁迫影响较大,出现不断波动的现象.
3.4 碱性磷酸酶AKP变化
碱性磷酸酶 (AKP)与细胞膜的物质运输有关,直接参与机体的磷代谢,对甲壳动物钙质的吸收、磷酸钙的沉积、甲壳素的分泌和形成都具有重要作用,从而影响甲壳动物基本免疫防御屏障的形成.在病理状态下,血清中升高的AKP活性与小颗粒细胞的解体及其颗粒的排放有关[29].据实验结果来看,对照组和第Ⅲ组的AKP活性有少许波动,基本平稳,第Ⅱ组和第Ⅳ组的AKP活性明显比对照组低,第Ⅱ组在36 h达到峰值,而后持续下降,第Ⅳ组一直保持在较低水平,这与雷质文等[23]研究的结果一致.
[1] SAHUL HAMEED A S,YOGANANDHAN K,SATHISH S,et al.White spot syndrome virus(WSSV)in two species of freshwater crabs(Paratelphusa hydrodomous and P.pulvinata)[J].Aquaculture,2001,201:179-186.
[2] MARI J,BONAMI J R.A parvo-like virus from the crab Carcinus mediterraneus:pathological aspects,ultrastructure of the agent,and first biochemical characterization [J].J Invertebr Pathol,1988,51:145-156.
[3]贡成良,薛仁宇,曹广力,等.中华绒螯蟹呼肠孤病毒样病毒病研究 [J].中国病毒学,2000,15(4):395-399.
[4]张叔勇,郑大胜,白志强,等.一株锯缘青蟹呼肠孤病毒的分离纯化及鉴定 [J].海洋渔业,2007,29(3):277-280.
[5] WENG S P,GUO Z X,SUN J J,et al.A reovirus disease in cultured mud crab,Scylla serrata,in southern China[J].Journal of Fish Diseases,2007,30:133-139.
[6]邹清,秦骥,朱小明.锯缘青蟹一种球状病毒的分离和组织病理观察[J].厦门大学学报:自然科学版,2007,46(6):884-888.
[7] VAGO C.A virus disease in crustacea(Portunus depurator L.)[J].Nature,1966,209:1290.
[8] JOHNSON P T.A viral disease of the blue crab,Callinectes sapidus:histopathology and differential diagnosis [J].J Invertebr Pathol,1977,29:201-209.
[9] MARI J,BONAMI J R.A reolike virus of the Mediterranean shore crab Carcinus mediterraneus[J].Dis aquat Org,1987,3:107-112.
[10] MARI J,BONAMI J R.W2 virus infection of the Crustacean Carcinus mediterraneus:a reovirus disease [J].J Gen Virol,1988,69:561-571.
[11]张叔勇,张建红,黄灿华,等.中华绒螯蟹二株呼肠孤病毒的初步研究[J].中国病毒学,2002,17(3):263-265.
[12] ZHANG S,SHI Z,ZHANG J.Purification and characterization of a new reovirus from the Chinese mitten crab,Eriocheir sinensis [J].Journal of Fish Diseases,2004,27:687-692.
[13]孙学强,陆承平.河蟹颤抖病病毒的分离纯化及其动物致病性试验 [J].中国病毒学,2002,17(2):185-188.
[14] SMITH V J,CHISHOLM R S.Non-cellular immunity in crustaceans [J].Fish & Shellfish Immunol,1992,2:1-31.
[15] BACHÈRE E.Shrimp immunity and disease control[J].Aquaculture,2000,191:3-11.
[16] MUTA T,IWANAGA S.The role of hemolymph coagulation in innate immunity [J].Curr Opin Immunol,1996,8(1):7-41.
[17] LEMOULLAC G,SOYEZ C,SAULNIER,et al.Effect of hypoxic stress on the immune response and the resistance to vibriosis of the shrimp Penaeus stylirostris[J].Fish & Shellfish Immunol,1998,8:621-629.
[18]于建平.日本对虾血细胞分类、密度及组成 [J].青岛海洋大学学报,1993,23(1):107-114.
[19] HAUTON C,HAWKINS L E,WILLIAMS J A.In situ variability in phenoloxidase activity in the shore crab,Carcinus maenas(L)[J].Comp Biochem Physiol,1997,117b:267-271.
[20] PASCUAL C,SÁNCHEZ A,VARGAS-ALBORES F,et al.Haemolymph metabolic variables immune response in Litopenaeus setiferus adult males:the effect of an extreme temperature [J].Aquaculture,2003,218:637-650.
[21] ASPÁN A,SÖDERHÄLL K.Purification of prophenolocidase from crayfish blood cells and its activation by an endogenous serine proteinase [J].Insect Biochem,1991,21:363-373.
[22]李天道,于佳,俞开康.中国对虾血清中酚氧化酶活力研究 [J].海洋湖沼通报,1998(1):51-56.
[23]雷质文,黄倢,杨冰,等.感染白斑综合症病毒 (WSSV)对虾相关免疫因子的研究[J].中国水产科学,2001,8(4):46-51.
[24]孙虎山,李光友.栉孔扇贝血淋巴中超氧化物歧化酶和过氧化氢酶活性及其性质的研究 [J].海洋与湖沼,2000,31(3):259-265.
[25] BELL K L,SMITH V J.In vitro superoxide production by hyaline cells of the shore crab Carcinus maenas(L) [J].Dev Comp Immunol,1993,17:211-219.
[26] MUÑOZ M,CEDEO R,RODGUEZ J,et al.Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp,Penaeus vannamei[J].Aquaculture,2000,191:89-107.
[27]王江勇,郭志勋,冯娟,等.病毒感染后杂色鲍部分血清免疫因子的变化 [J].中国水产科学,2005,12(3):344-347.
[28]曹广力,朱越雄,许宏庆,等.四种甲壳动物超氧化物歧化酶活性检测初报 [J].水产养殖,1999(1):15-16.
[29]丁美丽,林林,李光友,等.有机污染对中国对虾体内外环境影响的研究 [J].海洋与湖沼,1997,28(1):7-11.
(责任编辑 朱雪莲 英文审校 马 英)
Effects of Artifical Infection Reovirus Trails on Some Immune Factors of Mud Crab,Scylla paramamosain
ZOU Qing1,2,LI Jun-hua1,3,ZHU Xiao-ming1
(1.College of the Environment and Ecology,Xiamen University,Xiamen 361005,China;2.Wenzhou Marine Environmental Monitoring Center of State Ocean Administration,Wenzhou 325000,China;3.Shandong Oriental Ocean Sci-Tech Co.,Ltd.,Yantai 264003,China)
The influence of artifical infection reovirous trails on the hemocyte density and the phenoloxidase(PO),superoxide dismutase(SOD)and alkaline phosphatase activity(AKP)of the serum from Mud Crab,Scylla paramamosain was examined.The results showed that the healthy crab would be infected by virous injection and bath exposure in the virus extraction,There were no obvious difference between two treatments in mortality and latency period of the experimental animals,all crabs died in 7~9 d after infection.Changes of some interrelated immune factors such as activities of PO,SOD and AKP displayed the downtrend day by day,while the hemocyte density rose evidently after 36 h and reached the peak value(2.8534×107cells/mL)at 72 h,It recovered to the same level as the control group after 108 h.In conclusion,the changes of hemocyte density and PO,AKP activity except SOD activity would be used to assist diagnoses of crabdiseases.
Scylla paramamosain;reovirus;immune factors
S 945.6
A
1007-7405(2012)05-0327-08
2012-05-15
2012-09-05
福建省自然科学基金资助项目 (2009J01224)
邹清 (1981—),男,硕士,从事海洋生态及监测研究.通讯作者:朱小明 (1966—),男,教授,从事增养殖生态工程及管理研究.E-mail:zxm@xmu.edu.cn.
