脑外伤小鼠海马TNF-α表达的变化
2012-09-07仇波刘源王勇
仇波,刘源,王勇
(中国医科大学附属第一医院神经外科,沈阳 110001)
近年来,脑外伤发生率明显增加。目前关于颅脑损伤的研究侧重于如何防治继发性脑损害,例如脑水肿、脑缺血缺氧、神经元凋亡等。人类海马区神经元与学习记忆紧密相关,且对脑外伤极为敏感,伤后神经元大量变性坏死,导致患者学习记忆功能障碍[1]。因此,研究脑损伤后海马神经元的凋亡与损伤机制具有重要意义。肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)是一种具有广泛生物学活性的细胞因子,一般情况下适量TNF-α具有抗感染、抗病毒和抗肿瘤等作用[2];也可通过多种机制作用于中枢神经系统,调节神经—内分泌功能、介质释放、抗原递呈等[3]。目前有研究表明TNF-α与脑损伤后的继发性缺血关系密切[4,5],然而脑外伤后小鼠海马的TNF-α表达情况尚不清楚。本研究拟通过自由落体法复制闭合性脑外伤小鼠模型,探讨脑外伤后小鼠海马TNF-α的表达变化。
1 材料与方法
1.1 试剂和仪器
羊抗小鼠 TNF-α(Sigma公司),兔抗羊 IgG(北京中杉金桥生物技术有限公司),S-P免疫组化染色试剂盒与DAB显色试剂盒(福州迈新),高速离心机(上海医用分析仪器厂),OLYMPUS光学显微镜(Olympus公司),Image Pro Plus 6.0图像分析软件(Media Cybernetics公司)。
1.2 动物模型的建立及分组
Balb/c系雄性小鼠60只,体质量20~25 g,由中国医科大学实验动物中心提供。随机分为假手术组(30只)和脑外伤组(30只)。采用改良的自由落体法复制闭合性脑外伤小鼠模型,打击装置由脑立体定向仪、垂直导管、下落砝码、顶端涂有聚乙烯的撞针组成、撞针底端直径3 mm,异氟烷吸入麻醉小鼠后,将头部固定于脑立体定向仪上,消毒,沿中线切开头皮,暴露头盖骨,分离骨膜,将撞针置于前、后囟门中点偏左1 mm,以40 g砝码从25 cm高处沿垂直导管自由下落,撞击撞针造成脑损伤,缝合头皮,给予充足水和食物喂养,假手术对照组仅切开头皮暴露颅骨,不实施打击。
脑外伤后,根据小鼠脑损伤NSS评分系统进行评分:单侧或双侧偏瘫(1分),无法于3 cm平衡木上行走(1分),无法在2 cm平衡木上行走(1分),无法在1 cm平衡木上行走(1分),无法在0.5 cm平衡木上站稳(1分),无法在直径0.5 cm平衡木上站稳(1分),2 d内无法走出直径30 cm圆圈(1分),不能走直线(1分),惊吓反射消失(1分),探寻反射消失(1分),总分10分。重度损伤为7~8分,中度损伤为5~6分,轻度损伤为4分。
本研究筛选7~8分重度脑外伤小鼠作为研究对象。其中脑外伤组按 6 h、1 d、3 d[4]各选取 8 只,随机分配进行免疫组化、Western blot和RT-PCR检测;假手术组也按照6 h、1 d、3 d时间点各随机抽取8只分配后行上述检测。
1.3 方法
1.3.1 免疫组化:取各组小鼠分别于假手术、脑损伤后 6 h、1 d,3 d,以 0.8%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,4%多聚甲醛灌注,固定,断头取脑置于4%多聚甲醛后固定12 h,移入30%蔗糖溶液至沉淀。乙醇脱水,二甲苯透明,石蜡包埋,作连续冠状脑切片,切片厚8 μm,切片常规脱蜡至水,按S-P试剂盒说明书测定TNF-α的表达。
1.3.2 Western blot:各组小鼠以2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,冰上断头取海马,超声粉碎,离心取上清,以考马斯亮蓝G250结合法测定样品蛋白含量,等量蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离。转印,杂交,暗室内ECL反应,X线片显影、定影,凝胶图像分析仪采集分析光密度值(mean optical density,MOD),TNF-α 蛋白的 MOD 与内参照β-actin的MOD比值为相对表达量。
1.3.3 RT-PCR:麻醉处死各组小鼠,冰上断头取海马,按RNAout说明书进行总mRNA提取,然后以逆转录(RT法)先合成cDNA,再进行PCR扩增;TNF-α 上游引物:5′-CGAGTGACAAGCCCGTAGCC-3′;下游引物:5′-GGATGAACACG CCAGTCGCC-3′,扩增产物全长 255 bp;β-actin 的上游引物:5′-GAGACCTTCAACACCCAGCC-3′;下游引物:5′-GCGGGGCA TCGGAACCGCTCA-3′,扩增产物全长374 bp。扩增产物进行1.5%琼脂糖电泳,UVP凝胶显像仪扫描并进行图像分析。用目的基因与β-actin光密度的比值代表目的基因的相对表达含量。
1.4 统计学处理
采用SPSS 18.0统计软件对数据进行统计分析,结果用±s表示,各组比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化结果
结果显示,小鼠海马TNF-α蛋白的表达脑外伤6 h迅速升高,为0.25±0.08;1 d时的表达量最高,为0.59±0.23;3 d 时表达已降低,为 0.47±0.21;脑外伤组各时间点(6 h、1 d、3 d)TNF-α 蛋白表达与假手术组(各时点分别为 0.11±0.02,0.13±0.05,0.14±0.03)比较均显著升高(P<0.05,图1)。

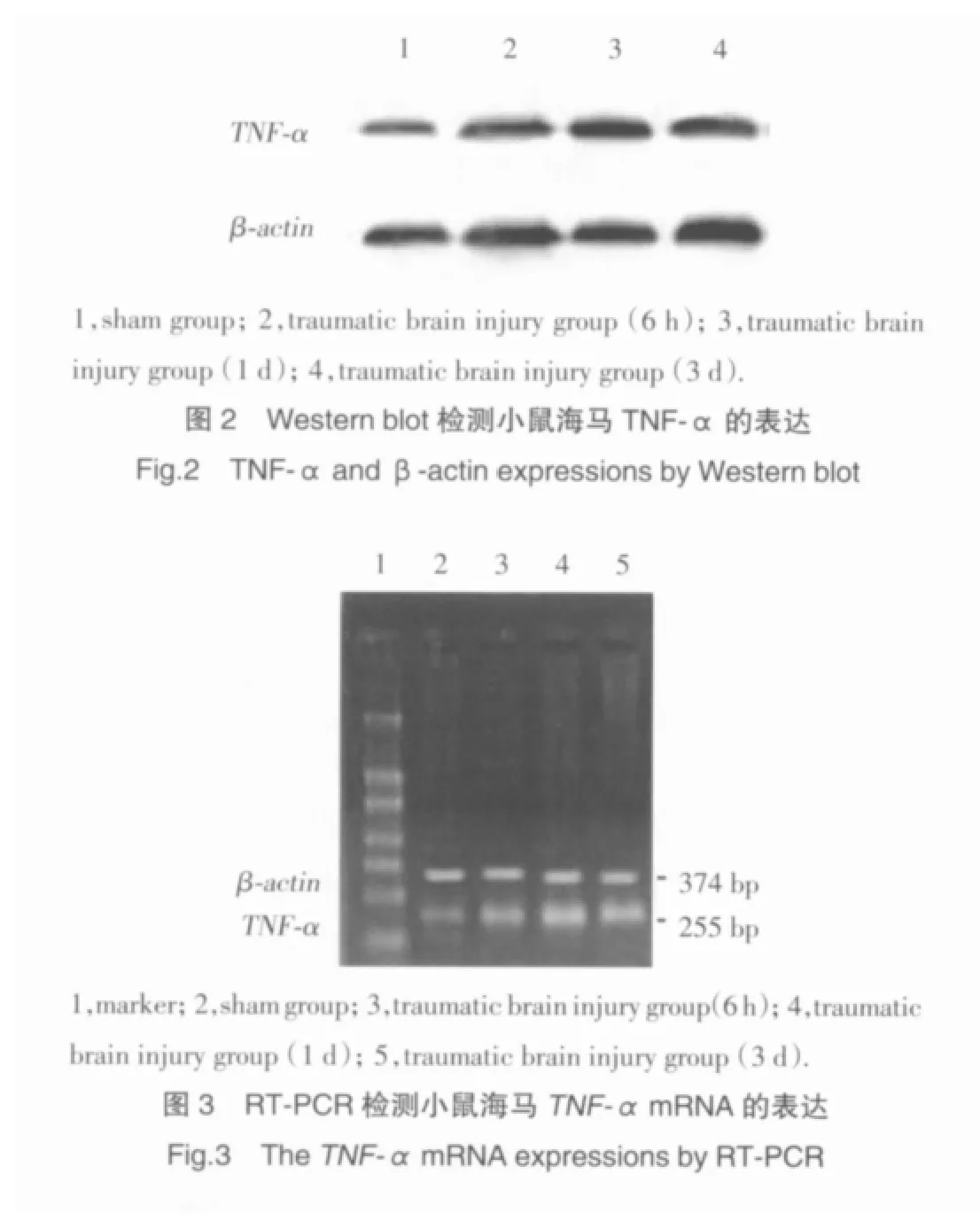
2.2 Western blot结果
根据蛋白免疫印迹结果可以看出,在小鼠脑外伤后6 h,小鼠海马TNF-α蛋白的表达迅速升高,相对表达量为0.33±0.06;到1 d时,TNF-α蛋白的表达量最高(0.69±0.31),到 3 d时,TNF-α 蛋白的表达已降低(0.57±0.28);脑外伤组各时间点(6 h、1 d、3 d)TNF-α蛋白的表达与对应时间假手术组(0.17±0.03,0.20±0.05,0.17±0.04)比较均显著升高(P<0.05,图 2)。
2.3 RT-PCR结果
小鼠脑外伤6 h相对表达量为0.43±0.21,1 d的相对表达量为0.82±0.15,3 d的相对表达量为0.63±0.27,均比假手术组对应时间点的相对表达量(0.30±0.09,0.34±0.12,0.29±0.11)显著升高(P<0.05,图 3)。
3 讨论
颅脑损伤后血脑屏障受损,影响脑的正常代谢,自由基产生增多、胞质钙离子超载、中枢神经递质紊乱,加剧了继发性损害,引起脑缺血缺氧及脑水肿[6,7]。近几年颅脑损伤的研究进展主要集中在脑组织损伤后继发性神经细胞损害,尤其是颅脑损伤后的缺血缺氧性损伤。研究发现,TNF-α是介导脑缺血性损伤的主要递质之一,也是脑创伤后血管源性脑水肿形成的重要原因[8,9]。
本研究利用免疫组织化学方法和Western blot方法检测脑外伤小鼠海马TNF-α蛋白表达时发现,在脑外伤后6 h后,小鼠海马TNF-α蛋白的表达迅速升高,到1 d时,TNF-α蛋白的表达量最高,到3 d时,TNF-α蛋白的表达已开始降低。用RT-PCR方法对脑外伤小鼠海马的TNF-αmRNA检测发现,6 h组小鼠TNF-αmRNA表达量已显著升高,1 d时表达量最高,到3 d时略有降低。以上结果提示,TNF-α作为机体炎性反应和免疫应答的重要因子,在闭合性颅脑损伤后小鼠海马的表达显著升高,可能参与了海马继发性缺血缺氧等病理生理过程,从而加重神经元损伤,甚至迟发性神经元死亡等[10]。TNF-α可能由神经元、星形胶质细胞、小胶质细胞甚至肥大细胞等产生和释放,改变血脑屏障的通透性,加重炎性反应和组织水肿,导致神经功能障碍[9]。由于脑组织内大量存在肿瘤坏死因子受体,TNF-α表达升高后,可以广泛作用于脑组织,并参与多种继发性病理生理反应,导致局部和广泛性的脑组织二次损害。
脑外伤是成年人致死和致残的重要原因,因此对脑损伤进行深入研究对临床医学和基础医学都具有现实意义。90%创伤性脑损伤死亡患者都有缺血性改变,是继发性损伤的主要机制。海马是脑内的重要结构,同时也是对原发脑损伤和继发脑缺血非常敏感的区域。本研究结果显示脑损伤后小鼠海马TNF-α表达明显升高,提示其可能与海马的继发性缺血损伤有密切关系。
[1]Sun D,Mcginn MJ,Zhou Z,et al.Anatomical integration of newly generated dentate granule neurons following traumatic brain injury in adult rats and its association to cognitive recovery[J].Exp Neurol,2007,204(1):264-272.
[2]Sun D,Colello RJ,Daugherty WP,et al.Cell proliferation and neuronal differentiation in the dentate gyrus in juvenile and adult rats following traumatic brain injury[J].J Neurotrauma,2005,22(1):95-105.
[3]Urrea C,Castellanos DA,Sagen J,et al.Widespread cellular proliferation and focal neurogenesis after traumatic brain injury in the rat[J].Restor Neurol Neurosci,2007,25(1):65-76.
[4]Chen Y,Constantini S,Trembovler V,et al.An experimental model of closed head injury in mice:pathophysiology,histopathology,and cognitive deficits[J].J Neurotrauma,1996,13(10):557-568.
[5]沈丽华,叶民,丁新生,等.大鼠脑缺血再灌注后肿瘤坏死因子-α与脑水肿的相关性研究[J].国际脑血管病杂志,2009,17(11):840-843.
[6]Juul SE,Mcpherson RJ,Bammler TK,et al.Recombinant erythropoietin is neuroprotective in a novel mouse oxidative injury model[J].Dev Neurosci,2008,30(4):231-242.
[7]孙树清,吴中学,张友平,等.脑损伤后脑组织自由基变化的实验研究[J].首都医科大学学报,2002,23(3):236-239.
[8]张新宇,孙晓川.肿瘤坏死因子α诱发脑水肿的机制[J].重庆医科大学学报,2008,33(4):432-436.
[9]沈宁,甘小亮,庞红宇,等.色甘酸钠对沙土鼠全脑缺血再灌注后脑保护作用及脑组织TNF-α和IL-1水平的影响[J].南方医科大学学报,2009,29(3):528-530.
[10]Barth AM,Mody I.Changes in hippocampal neuronal activity during and after unilateral selective hippocampal ischemia in vivo [J].J Neurosci,2011,31(3):851-860.
