嗜酸乳杆菌对人舌癌细胞增殖的影响
2012-09-06史晓艳陈骏车团结白德成何祥一
史晓艳 陈骏 车团结 白德成 何祥一
(1.兰州大学口腔医院 修复科;2.兰州大学生命科学院 细胞与分子生物学实验室;3.兰州大学基础医学院 甘肃省新药临床前研究重点实验室,兰州 730000)
口腔黏膜癌是常见的口腔恶性肿瘤,占男性全身癌的8%,女性全身癌的4%,其中舌癌是最常见的口腔癌[1]。传统的手术治疗、放射及化学疗法尚存在许多不足之处,而应用微生物法预防和治疗肿瘤是口腔医学的研究热点之一。嗜酸乳杆菌(Lactobacillus acidophilus,L.acidophilus)属于乳酸杆菌属[2],是口腔中的正常菌群之一,在唾液中可以分离到。引起舌癌的致病因素非常多。研究[3]证实:舌癌患者口腔微生态平衡失调,可能导致舌癌的发生。研究[4-5]表明:L.acidophilus在抗变异原性、防癌抗癌和增强机体免疫力方面均发挥了重要作用。
本研究通过体外培养人舌癌细胞株Tca8113,研究L.acidophilus对Tca8113增殖的影响,并从诱导癌细胞凋亡及细胞内自由基、Ca2+含量角度,初步探讨其抗癌机制,为应用L.acidophilus辅助治疗口腔癌提供实验依据。
1 材料和方法
1.1 材料
L.acidophilus ATCC 4356由四川大学华西口腔医学院惠赠;人舌癌细胞株Tca8113购自中国科学院上海药物研究所;磺酰罗丹明B(sulforhodamine B,SRB)(Sigma公司,美国);Fluo-3/AM、2’,7’-二氯二氢荧光素二乙酯(2’,7’-dichlorofluorescin diacetate,D-399)、碘化丙啶(propidium iodide,PI)(Molecular probes公司,美国);分析纯二甲基亚砜(dimethyl sulfoxide,DMSO)购自北京金亚奥国际贸易有限公司;新生小牛血清(杭州四季青生物工程材料有限公司);RPMI 1640细胞培养液、胰蛋白酶(Gibco公司,美国);其余试剂均为市售分析纯产品。TCS SP2型激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)(Leica公司,德国);酶联免疫反应检测仪(酶标仪)、JY92-Ⅱ型超声细胞粉碎机(上海分析仪器厂)。
1.2 方法
1.2.1L.acidophilus上清液、灭活菌液、无细胞提取物的制备 L.acidophilus在37℃条件下厌氧培养48 h,3 600 r·min-1离心15 min,用0.22 μm滤膜过滤2次以除菌,得上清液。收集菌体,于65℃水浴热灭活30min,光镜和电镜下观察,要求细菌的形态和结构正常;再经Rogasa选择性培养基37℃厌氧培养至1周无细菌生长,PBS洗涤3次后调整菌密度至1×109CFU·mL-1,即为L.acidophilus灭活菌液[6]。未经热灭活处理的L.acidophilus菌液调整密度至1×109CFU·mL-1,经超声冰浴破碎,10 000 r·min-1离心10 min后所得上清液即为无细胞提取物[7]。
1.2.2 实验分组 原液组:L.acidophilus上清液组、灭活菌液组和无细胞提取物组;倍比稀释组:RPMI 1640细胞培养液4倍、16倍倍比稀释原液组。本文的原液组与倍比稀释组分别用1×、4×、16×表示,并设3个平行组。加入等量的完全培养液(含10%新生小牛血清的RPMI 1640细胞培养液)为对照组。
1.2.3 Tca8113细胞培养 用含10%小牛血清的RPMI 1640细胞培养液在37℃、5%CO2孵箱中培养Tca8113细胞。
1.2.4 细胞形态学观察及细胞计数 用完全培养液调整细胞密度至每毫升5×104个,接种于6孔板,每孔2 mL。24 h细胞完全贴壁进入对数生长期后,加入L.acidophilus上清液组、灭活菌液组、无细胞提取物组,每个实验组再按不同的倍比稀释度设3个亚组(1×、4×、16×),每个亚组设3个复孔,每孔200 μL。置于培养箱中分别培养24、48、72 h后取出,胰酶消化后进行细胞计数。
1.2.5 SRB法测定Tca8113细胞抑制率 将处于对数生长期的Tca8113细胞以每毫升5×104个的密度接种于96孔培养板中,每孔200 μL。实验分两组:1)将不同稀释度的L.acidophilus上清液组、灭活菌液组、无细胞提取物组(倍比稀释度:1×、4×、16×)加入细胞中,每个稀释度设4个复孔,每孔20 μL,并设对照组,37℃培养48 h;2)将未稀释的L.acidophilus上清液、灭活菌液和无细胞提取物组加入细胞中,每组设4个复孔,每孔20 μL,并设对照组,37℃分别培养24、48、72 h。培养完成后用三氯醋酸固定细胞1 h,去离子水洗5遍,晾干,每孔加入100 μL SRB液,室温放置10 min,再用1%醋酸液洗5遍,晾干,每孔加入150 μL非缓冲Tris碱液(pH=10.5),于酶标仪上检测515 nm波长处的光密度(optical density,OD)值。细胞抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%。
1.2.6 上清液、灭活菌液、无细胞提取物对Tca8113细胞周期的影响 将Tca8113细胞置于10 mL完全培养液中培养24 h,细胞贴壁进入对数生长期后,加入1 mL未经稀释的上清液、灭活菌液和无细胞提取物,另设对照组,每组设3个平行组,48 h后用胰酶消化收集的细胞,采用流式细胞仪检测细胞周期变化,分析G0及G1(G0/G1)期、S期、G2及M(G2/M)期细胞百分数。细胞增殖指数(cell proliferation index,CPI)=(S+G2/M)/(G0/G1+S+G2/M)×100%。
1.2.7 Tca8113细胞内自由基的检测 将处于对数生长期的Tca8113细胞以每毫升5×104个接种于CLSM专用培养板,每孔400 μL,待细胞贴壁后加入1.6 mL完全培养液,将未经稀释的上清液、灭活菌液和无细胞提取物加入细胞中,每组设3个复孔,每孔200 μL,并设对照组,37℃培养48 h后,弃培养液加入新鲜的完全培养液50 μL于培养板中,加入10 μg·mL-1氧自由基特异性荧光探针D-399 50 μL,37℃避光负载45 min,PBS液洗3次,CLSM检测细胞内的自由基,激发光波长488nm,发射光波长520 nm,以荧光强度表示自由基的量。
1.2.8 Tca8113细胞内游离Ca2+检测 细胞培养和实验分组同1.2.7,37℃培养48 h后,弃培养液加入新鲜完全培养液50 μL于培养板中,加入10 μmol·mL-1的Ca2+特异性荧光探针Fluo-3/AM 50 μL,37℃避光负载45 min,PBS液洗3次。CLSM检测细胞内游离Ca2+,激发光波长480 nm,发射光波长530 nm,以荧光强度表示细胞内Ca2+含量。
1.3 统计学分析
采用SPSS 11.0统计软件进行统计学处理,计量数据用±s描述,多组间均数比较采用单因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 细胞形态变化
倒置显微镜下观察Tca8113细胞形态的变化见图1。经不同稀释度的L.acidophilus上清液、灭活菌液、无细胞提取物作用后,原液组对Tca8113细胞的影响最大,48h后,Tca8113细胞的形态改变最为明显,到72 h,上清液组大部分细胞处于死亡状态,细胞漂浮。因此,笔者选择48 h原液组进行细胞形态学的观察记录。观察发现:48h后,细胞由菱形、多角形、铺路石状变为细长形。与灭活菌液组(图1c)、无细胞提取物组(图1d)相比,上清液组(图1b)的细胞数目最少。

2.2 细胞计数及L.acidophilus对Tca8113细胞增殖的影响
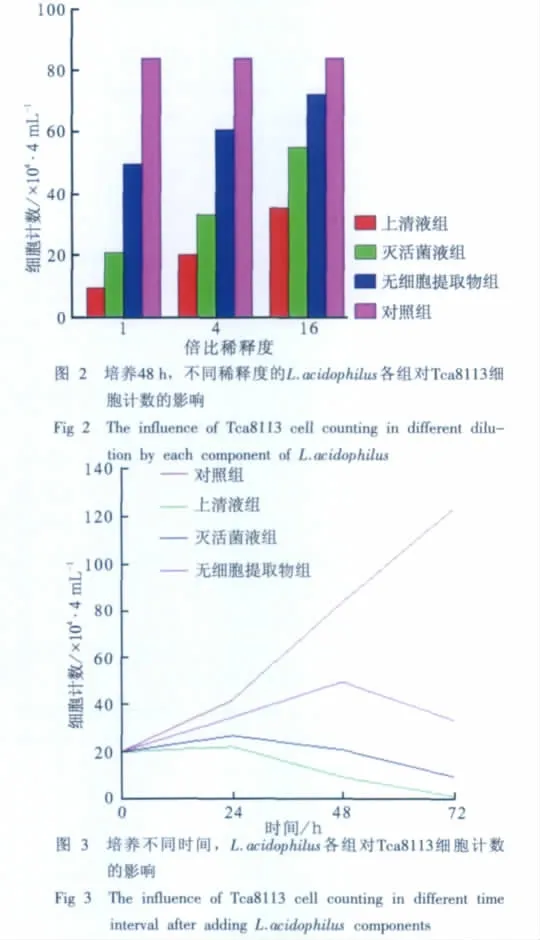
当作用时间同为48 h时,经细胞计数发现:倍比稀释(1×、4×、16×)的上清液、灭活菌液、无细胞提取物均可抑制Tca8113细胞的增殖;未经稀释(1×)的上清液、灭活菌液、无细胞提取物的抑制力最强,随着稀释度的增加,抑制力减弱(图2)。培养不同时间后,经细胞计数发现:L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞24、48、72 h后,均可抑制细胞增殖,其中上清液的抑制力最强,时间越长抑制力越明显(图3)。
L.acidophilus各组作用时间同为48 h时,SRB法检测Tca8113细胞增殖率的结果见表1:与细胞计数一致,未经稀释(1×)的上清液、灭活菌液、无细胞提取物对Tca8113细胞的抑制力最强,随着稀释度的增加,抑制力减弱,与对照组比较,差异均有统计学意义(P<0.01)。L.acidophilus上清液、灭活菌液和无细胞提取物分别作用24、48、72 h后,SRB法检测Tca8113细胞增殖率的结果见表2:与细胞计数一致,上清液组在72 h时抑制力最强,与对照组比较,差异有统计学意义(P<0.01)。
表 1 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后对细胞增殖的影响Tab 1 The effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell proliferation of Tca8113 after 48 h ±s

表 1 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后对细胞增殖的影响Tab 1 The effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell proliferation of Tca8113 after 48 h ±s
注:与对照组相比,*P<0.01。
OD值抑制率/%1× 4× 16× 1× 4× 16×对照组 1.71±0.05 1.71±0.05 1.71±0.05 0 0 0上清液组 0.18±0.06* 0.47±0.06* 0.89±0.11* 89.54±3.68 72.80±3.40 48.15±0.64灭活菌液组 0.43±0.01* 0.70±0.03* 1.11±0.01* 74.69±0.76 59.41±1.51 35.54±0.37无细胞提取物组 0.86±0.06* 1.11±0.01* 1.48±0.13* 49.67±3.30 35.05±1.52 13.72±0.78组别
表 2 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞24、48、72 h后对细胞增殖率的影响Tab 2 The effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell proliferation of Tca8113 after 24,48,72 h ±s

表 2 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞24、48、72 h后对细胞增殖率的影响Tab 2 The effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell proliferation of Tca8113 after 24,48,72 h ±s
注:与对照组相比,*P<0.01。
OD值抑制率/%组别 24 h 48 h 72 h 24 h 48 h 72 h对照组 0.88±0.04 1.71±0.05 2.07±0.07 0 0 0上清液组 0.48±0.02* 0.18±0.06* 0.05±0.01* 45.50±4.50 89.54±3.68 97.45±0.42灭活菌液组 0.52±0.05* 0.43±0.01* 0.19±0.01* 41.25±3.47 74.69±0.76 90.88±0.35无细胞提取物组 0.64±0.07* 0.86±0.06* 0.62±0.04* 26.98±0.92 49.67±3.30 69.88±1.52
2.3 L.acidophilus上清液、灭活菌液、无细胞提取物对Tca8113细胞周期的影响
L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后,与对照组相比,各实验组G0/G1期细胞所占比例均升高,S期、G2/M期所占比例均明显降低,反映细胞增殖活力的指数CPI均降低(表3);其中上清液组抑制力最明显,与对照组相比其差异均有统计学意义(P<0.01)。
表 3 L.acidophilus上清液、灭活菌液、无细胞提取物对Tca8113细胞周期的影响Tab 3 Effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell cycle distribution of Tca8113 %,±s
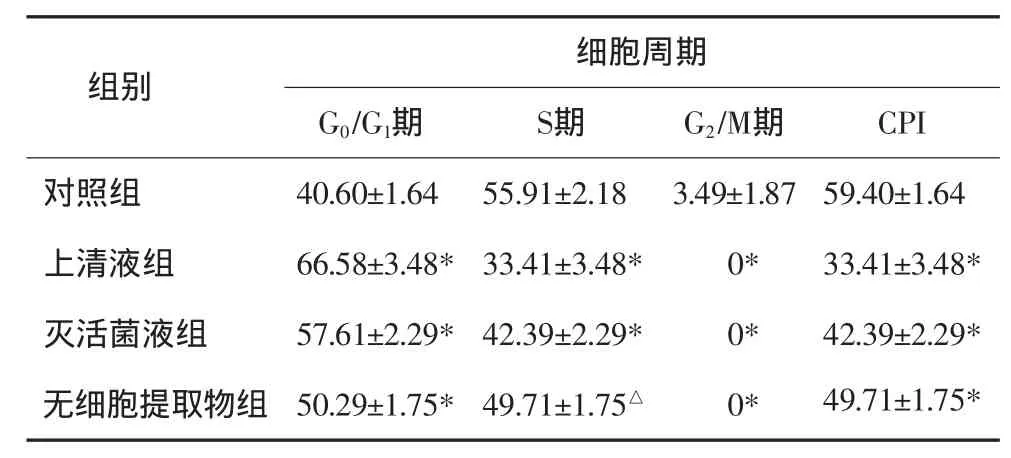
表 3 L.acidophilus上清液、灭活菌液、无细胞提取物对Tca8113细胞周期的影响Tab 3 Effect of L.acidophilus supernatant,inactivated bacilli and cell free extracts on cell cycle distribution of Tca8113 %,±s
注:与对照组相比,△P<0.05,*P<0.01。
细胞周期G0/G1期 S期 G2/M期 CPI对照组 40.60±1.64 55.91±2.18 3.49±1.87 59.40±1.64上清液组 66.58±3.48* 33.41±3.48* 0* 33.41±3.48*灭活菌液组 57.61±2.29* 42.39±2.29* 0* 42.39±2.29*无细胞提取物组 50.29±1.75* 49.71±1.75△ 0* 49.71±1.75*组别
2.4 L.acidophilus上清液、灭活菌液、无细胞提取物对Tca8113细胞内自由基和Ca2+含量的影响
L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后,与对照组相比,各实验组自由基和Ca2+含量均升高(图4、5和表4),其中上清液组Tca8113细胞内自由基和Ca2+含量升高最明显,与对照组相比其差异有统计学意义(P<0.01)。
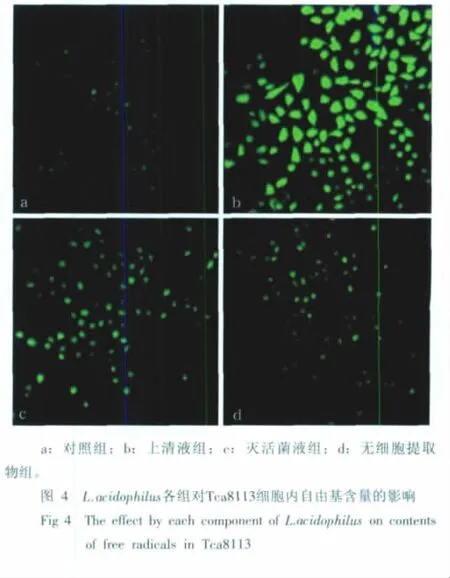

表 4 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后细胞内的自由基和Ca2+含量Tab 4 The effect by supernatant,inactivated bacilli and cell free extracts of L.acidophilus on content of free radicals and Ca2+in Tca8113 after 48 h ±s

表 4 L.acidophilus上清液、灭活菌液、无细胞提取物作用Tca8113细胞48 h后细胞内的自由基和Ca2+含量Tab 4 The effect by supernatant,inactivated bacilli and cell free extracts of L.acidophilus on content of free radicals and Ca2+in Tca8113 after 48 h ±s
注:与对照组相比,*P<0.01。
组别 自由基含量 Ca2+含量对照组 94.42±3.38 20.85±2.89上清液组 245.67±3.02* 79.52±4.58*灭活菌液组 197.26±4.36* 52.62±2.24*无细胞提取物组 155.82±2.28* 38.79±3.58*
3 讨论
研究[8]证实:乳酸杆菌产生的多糖类物质(细胞壁肽聚糖)、有机酸(乳酸、乙酸、丙酮酸等)、细菌素、过氧化氢等多种代谢产物均有很好的抗肿瘤作用。乳酸杆菌产生的过氧化氢可产生羟自由基,引起DNA单链断裂,破坏肿瘤细胞DNA的合成和表达,引起细胞凋亡或坏死。刘军等[9]研究发现:乳酸杆菌代谢产物能够明显抑制与癌症密切相关的白色假丝酵母菌对上皮细胞的黏附。彭继承等[10]研究发现:乳酸杆菌粗制代谢产物对小鼠溃疡性结肠炎有防治作用,但其作用机制尚不十分明确。本研究结果显示:L.acidophilus上清液组对人舌癌细胞增殖能力的抑制作用最强,其抑制作用具有密度依赖性和时间依赖性,上清液细菌密度越高、作用时间越长,Tca8113细胞的增殖能力越弱;同时,细胞内自由基及Ca2+含量均明显升高。这可能与L.acidophilus产生的过氧化氢导致自由基生成过多,而自由基含量升高可以导致细胞Ca2+内流,细胞内Ca2+超载,引起细胞凋亡或死亡有关。
在体外研究[11-13]中发现:经加热灭活处理的乳酸杆菌对肠黏膜细胞具有较强的黏附性,并可发挥黏附拮抗作用,L.acidophilus等多种乳酸杆菌可阻止幽门螺杆菌在哺乳类动物上皮细胞的黏附。有研究[14]发现:灭活乳酸杆菌在短时间的黏附一般不会导致细胞活力下降,细胞活力短时间的维持有利于乳酸杆菌与细胞的黏附,随着黏附的乳酸杆菌增多,乳酸杆菌表面的糖类、磷脂类等物质以及在溶菌酶[15]作用下乳酸杆菌细胞壁破裂内容物逸出后暴露的部分细菌DNA中的CpG基序、AT核苷酸,可能更好地激发免疫系统以发挥抗肿瘤作用,导致人舌癌细胞的凋亡与死亡。
研究[13]证实:乳酸杆菌表面的肽聚糖、脂磷壁酸以及源于细菌DNA中的CpG基序可直接诱导肿瘤细胞的分化和凋亡,其中CpG基序起着更为重要的作用。细菌核酸中含有CpG基序的部分可通过与人体细胞表面特异性受体——Toll样受体家族中的Toll样受体9(Toll like receptor 9,TLR9)相结合,激活机体的免疫反应[16]。乳酸杆菌基因组AT核苷酸也可以通过与TLR9结合来增强Th1型免疫反应,上调抗肿瘤免疫反应水平[17]。本实验将L.acidophilus热灭活菌液与Tca8113细胞共培养,发现灭活菌液也有抑制人舌癌细胞增殖的能力,可导致细胞内自由基及Ca2+含量升高,这可能与乳酸杆菌表面的糖类、磷脂类物质以及细菌DNA中的CpG基序、AT核苷酸激发免疫抗肿瘤作用从而导致舌癌细胞的凋亡与死亡有关。
本实验发现:无细胞提取物组对Tca8113细胞的抑制作用高于对照组,但与灭活菌液组相比其抑制力较弱,可能是由于灭活菌液组可发挥较强的黏附作用,黏附于舌癌细胞表面,通过L.acidophilus表面的肽聚糖、脂磷壁酸以及源于细菌DNA中的CpG基序直接诱导肿瘤细胞的分化和凋亡,而无细胞提取物组不能发挥黏附作用,抑制能力相对较弱。
关于乳酸杆菌的生物安全性问题,有研究[18-19]发现:乳酸杆菌HO-69引发龋病与促进龋病发展的概率很低,具有广谱抑菌活性,可抑制与口腔癌密切相关的白色假丝酵母菌的黏附,是潜在的口腔益生菌。但有关乳酸杆菌致龋作用的研究颇有争议。有学者[20]认为乳酸杆菌数量增多是龋病进展的结果而不是致龋的原因;也有学者[21-22]认为乳酸杆菌可以抑制某些龋病病原菌的生长,从而可能有防治龋病的作用。复方L.acidophilus片作为肠道菌群调整药已应用于临床,但L.acidophilus对人口腔癌治疗的相关研究甚少,其安全性有待于进一步探索。
研究发现L.acidophilus对人舌癌细胞的增殖有抑制作用。但是体外培养模型与临床实际情况还有一定差距,今后尚需对抑癌基因或主要信号传导通路及信号分子作深入研究,从分子水平揭示乳酸杆菌抑制肿瘤细胞增殖的作用机制,并建立与临床密切相关的模型,为口腔癌治疗提供新途径。
[1] 于世凤.口腔组织病理学[M].北京:人民卫生出版社,2003:338-339.Yu Shifeng.Oral histological pathology[M].Beijing:People’s Medical Publishing House,2003:338-339.
[2] Baele M,Vaneechoutte M,Verhelst R,et al.Identification ofLactobacillusspecies using tDNA-PCR[J].J MicrobiolMethods,2002,50(3):263-271.
[3] Dalle F,Wächtler B,L’Ollivier C,et al.Cellular interactions of Candida albicanswith human oral epithelial cells and enterocytes[J].Cell Microbiol,2010,12(2):248-271.
[4] Fukui M,Fujino T,Tsutsui K,et al.The tumor-preventing effect of a mixture of several lactic acid bacteria on 1,2-dimethylhydrazine-induced colon carcinogenesis in mice[J].Oncol Rep,2001,8(5):1073-1078.
[5] Ohashi Y,Nakai S,Tsukamoto T,et al.Habitual intake of lactic acid bacteria and risk reduction of bladder cancer[J].Urol Int,2002,68(4):273-280.
[6] 王红艳,吴晓燕,张旭艳,等.热灭活嗜酸乳杆菌黏附于HeLa细胞后肿瘤细胞免疫学性状的变化[J].中国病理生理杂志,2008,24(8):1510-1513.Wang Hongyan,Wu Xiaoyan,Zhang Xuyan,et al.Antitumor effect of heat-killedLactobacilliadhered to cervical carcinoma cells[J].Chin J Pathophysiology,2008,24(8):1510-1513.
[7] Lin MY,Chang FJ.Antioxidative effect of intestinal bacteriaBifidobacterium longumATCC 15708 andLactobacillus acidophilus ATCC 4356[J].Dig Dis Sci,2000,45(8):1617-1622.
[8] 逯彩虹,程建新,周艾琳,等.乳酸菌抗肿瘤作用的概况与应用进展[J]. 实用肿瘤杂志,2009,24(1):90-92.Lu Caihong,Cheng Jianxin,Zhou Yilin,et al.Lactic acid bacteria antitumor function of the general situation and the application progress[J].J Practical Oncology,2009,24(1):90-92.
[9] 刘军,宁安红,张蓓蓓,等.乳酸杆菌代谢产物对一些常见菌黏附阴道上皮细胞的抑制作用的初步探讨[J].中国微生态学杂志,2009,21(8):705-706.Liu Jun,Ning Anhong,Zhang Beibei,et al.Preliminary study on the inhibition ofLactobacillusmetabolites to some common bacteria adhesion of vaginal epithelial cells[J].Chin J Microecology,2009,21(8):705-706.
[10]彭继承,吴小平,卢放根.乳酸杆菌和双歧杆菌粗制代谢产物对小鼠溃疡性结肠炎的影响[J].医学临床研究,2008,25(5):786-788.Peng Jicheng,Wu Xiaoping,Lu Fanggen.Effect of the crude metabolite ofLactobacillusandBifidobacteriaon ulcerative colitis in mice[J].J Clin Res,2008,25(5):786-788.
[11] Hamilton-Miller JM.The role of probiotics in the treatment and prevention ofHelicobacter pyloriinfection[J].Int J Antimicrob A-gents,2003,22(4):360-366.
[12] Rokka S,Myllykangas S,Joutsjoki V.Effect of specific colostral antibodies and selectedLactobacillion the adhesion ofHelicobacter pylorion AGS cells and theHelicobacter-induced IL-8 production[J].Scand J Immunol,2008,68(3):280-286.
[13]Kitazawa H,Watanabe H,Shimosato T,et al.Immunostimulatory oligonucleotide,CpG-like motif exists inLactobacillus delbrueckii ssp.bulgaricus NIAI B6[J].Int J Food Microbiol,2003,85(1/2):11-21.
[14]逯彩虹,程建新,周爱玲,等.乳酸杆菌对宫颈肿瘤细胞的黏附抑制作用[J].军医进修学院学报,2009,30(6):893-895.Lu Caihong,Cheng Jianxin,Zhou Ailing,et al.Lactobacillus’sticky and depressant effect on uterine cervix cancer cells[J].J Chin PLA Postgraduate Medical School,2009,30(6):893-895.
[15] Ruhl S,Berlenbach P,Langenfelder S,et al.Integrity of proteins in human saliva after sterilization by gamma irradiation[J].Appl Environ Microbiol,2011,77(3):749-755.
[16] Eastcott JW,Holmberg CJ,Dewhirst FE,et al.Oligonucleotide containing CpG motifs enhances immune response to mucosally or systemically administered tetanus toxoid[J].Vaccine,2001,19(13/14):1636-1642.
[17] Shimosato T,Kitazawa H,Katoh S,et al.Augmentation of T(H)-1 type response by immunoactive AT oligonucleotide from lactic acid bacteria via Toll-like receptor 9 signaling[J].Biochem Biophys Res Commun,2005,326(4):782-787.
[18] 杨颖,陈卫,张灏,等.植物乳杆菌HO-69的口腔益生性质研究[J]. 华西口腔医学杂志,2008,26(5):482-489.Yang Ying,Chen Wei,Zhang Hao,et al.Probiotic characteristics ofLactobacillus plantarumHO-69 applied in oral cavity[J].West China J Stomatol,2008,26(5):482-489.
[19]刘坤,高宁,王翼川,等.口腔癌术后放疗患者口腔菌群的变化[J]. 华西口腔医学杂志,2005,23(2):128-135.Liu Kun,Gao Ning,Wang Yichuan,et al.The changes of bacteria group on oral mucosa after radiotherapy of postoperative patients of oral carcinoma[J].West China J Stomatol,2005,23(2):128-135.
[20]Fitzgerald RJ,Adams BO,Davis ME.A microbiological study of recurrent dentinal caries[J].Caries Res,1994,28(6):409-415.
[21]Näse L,Hatakka K,Savilahti E,et al.Effect of long-term consumption of a probiotic bacterium,Lactobacillus rhamnosusGG,in milk on dental caries and caries risk in children[J].Caries Res,2001,35(6):412-420.
[22] Sookkhee S,Chulasiri M,Prachyabrued W.Lactic acid bacteria from healthy oral cavity of Thai volunteers:Inhibition of oral pathogens[J].J Appl Microbiol,2001,90(2):172-179.
