粪肠球菌脂磷壁酸对人牙周膜成纤维细胞表达Toll样受体2及白细胞介素-1β的影响
2012-09-06靳路远罗小良姜艳谢晓莉
靳路远 罗小良 姜艳 谢晓莉
(中南大学湘雅医院 口腔科,长沙 410008)
根尖周炎是口腔科的常见病、多发病,治疗的最终目的是使已经破坏的根尖周组织包括根尖周的牙周膜和牙槽骨再生并形成新附着,患牙能行使正常功能。根尖周组织再生的基础是牙周膜成纤维细胞,它在细胞外基质的产生与代谢方面具有重要作用,在一定条件下还能分化成骨组织[1]。研究[2]表明:牙周膜成纤维细胞具有一定的免疫潜能,受到微生物致病成分刺激后能分泌多种细胞因子,在牙周和根尖周组织的免疫反应中起重要的调节作用。
根尖周炎的发生与根尖生物膜的存在密切相关,该生物膜是以革兰阴性厌氧菌及革兰阳性菌为主的混合体,是根尖周炎发生的主要病原学基础。粪肠球菌(Enterococcus faecalis,E.faecalis)是顽固性或继发性根管感染中检出频率最高的革兰阳性细菌之一,也是难治性根尖周炎的主要致病菌[3-4]。其细胞壁有效成分脂磷壁酸(lipoteichoic acid,LTA)是其主要免疫原,能有效激活免疫系统,诱发宿主炎症反应。目前认为:跨膜蛋白Toll样受体2(Toll like receptor 2,TLR2)可将LTA信号直接传导到细胞内,引起一系列细胞免疫反应,导致白细胞介素(interleukin,IL)-1β、IL-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等重要炎症介质的分泌[5]。本文通过研究体外培养的人牙周膜成纤维细胞(human periodontal ligament cells,HPDLCs)在E.faecalis LTA刺激下TLR2以及IL-1β的表达变化,以阐明E.faecalis LTA在根尖周炎中的作用。
1 材料和方法
1.1 主要试剂与设备
DMEM细胞培养液(Gibco公司,美国)、胎牛血清(杭州四季青生物工程材料有限公司)、pH值为7.2~7.4的PBS缓冲液(自配);E.faecalis LTA、大肠杆菌脂多糖(lipopolysaccharide,LPS)(Sigma公司,美国),藻红蛋白(phycoerythrin,PE)荧光标记的TLR2抗体、PE荧光标记的IgG同型对照抗体、TLR2中和抗体、IgG同型质控抗体(eBioscience公司,美国),IL-1β酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)96孔试剂盒(深圳晶美公司)。
1.2 HPDLCs体外培养及鉴定
收集12~18岁正畸患者因正畸需要而拔除的前磨牙,刮取牙根中1/3处的牙周膜,剪成0.5 mm2小块,均匀置于培养瓶底,各组织间隔3 mm,置于37℃、5%CO2、100%湿度的恒温孵育箱培养,隔天换液。待细胞爬满瓶底75%~80%时,加入2%胰酶2 mL消化,按1∶3的比例传代。取第2代细胞进行免疫组织化学鉴定,第5代用于后续实验。
1.3 流式细胞术检测TLR2的表达
取第5代细胞按每毫升1×106细胞密度接种于六孔板,培养24 h贴壁后,弃原培养液,无菌PBS清洗3次后加入不同的刺激物,依所加抗体的不同分为几个实验组。A组:无关对照组(流式细胞术要求的对照,指正常细胞内加入无关对照抗体,以消除非特异性的背景染色),正常培养液培养24 h后加入PE荧光标记的IgG同型对照抗体;B组:正常对照组,正常培养液培养24 h后加入PE荧光标记的TLR2抗体;C组:LPS作用组,其中C1、C2、C3组分别为含0.1、1、10 μg·mL-1的LPS培养液,作用24 h后加入PE荧光标记的TLR2抗体;D组:LTA作用组,其中D1、D2、D3组分别为含0.1、1、10 μg·mL-1的LTA培养液,作用24 h后加入PE荧光标记的TLR2抗体。每组取3个样本上机进行流式细胞术检测,测定各组TLR2阳性细胞率,比较LTA刺激后及正常细胞TLR2表达的差异。
1.4 ELISA检测IL-1β的表达
取第5代细胞按每毫升1×105细胞密度接种于96孔板,培养48 h贴壁后,弃原培养液,无菌PBS清洗3次后加刺激物。实验分组如下:A组为正常对照组,仅加入含2%胎牛血清的DMEM培养液;B组为阳性对照组,加入含1 μg·mL-1LPS和2%胎牛血清的DMEM培养液;C组为实验组,C1、C2、C3组分别加入含0.1、1、10 μg·mL-1LTA和2%胎牛血清的DMEM培养液,分别于12、24、48 h吸取细胞培养上清液分装于EP管中。同样取上述第5代细胞,加入抗体滴度为1∶100 TLR2中和抗体10 μL,37℃孵育1 h后,再加入含有1 μg·mL-1LTA和2%胎牛血清的DMEM培养液培养24 h,吸取上清液分装于EP管中,-20℃保存备用。分别收集上述上清液,按照ELISA操作规程,各组取100 μL细胞培养液,采用双抗体夹心法检测各组IL-1β分泌量。每组设3个复孔。
1.5 数据分析
所得结果用均数±标准差表示,TLR2阳性表达率组间比较采用非参数多样本间Kruskal-Wallis H检验,IL-1β分泌量采用单因素方差分析Dunnet t检验及SNK检验。TLR2中和抗体封闭实验采用两样本t检验,检验水准为双侧α=0.05。
2 结果
2.1 细胞培养情况
组织块培养5~10 d后,在倒置显微镜下观察可见组织块周围有细胞呈放射状或伪足状游出,以组织块为中心,形成生长晕。细胞呈长梭形,有明显的细胞分叉,细胞核椭圆形且居中,细胞质丰富,细胞贴壁生长。从细胞形态看所培养的细胞为成纤维细胞。第10代之前的HPDLCs形态上与原代细胞基本相同,呈束状漩涡生长,部分细胞可呈复层生长(图1)。所培养细胞抗波形丝蛋白阳性,抗角蛋白阴性,证明为来自中胚层的间充质细胞。

图 1 第3代HPDLCs 倒置显微镜 ×10Fig 1 The third passage of HPDLCs inverted microscope ×10
2.2 TLR2表达情况
TLR2表达情况见表1。正常HPDLCs TLR2阳性表达极低,LTA刺激24 h后,TLR2阳性细胞率明显上升,与正常对照组及各质量浓度LPS组相比差异具有统计学意义(P<0.05);且随着LTA质量浓度的升高,TLR2阳性细胞率上升,组间差异具有统计学意义(P<0.05)。不同质量浓度LPS刺激24 h后,TLR2阳性细胞率与正常对照组相比,其差异无统计学意义(P>0.05)。
表 1 粪肠球菌LTA诱导HPDLCs TLR2的表达Tab 1 Expression of TLR2 induced by E.faecalis LTA on HPDLCs %,n=3,±s
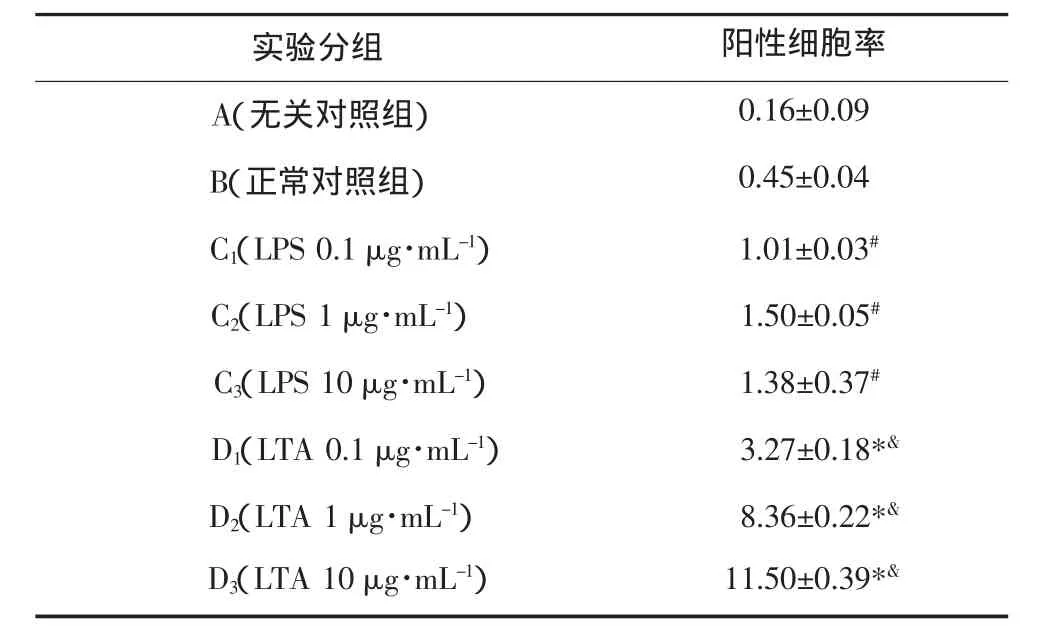
表 1 粪肠球菌LTA诱导HPDLCs TLR2的表达Tab 1 Expression of TLR2 induced by E.faecalis LTA on HPDLCs %,n=3,±s
注:#C1、C2、C3组间比较,P>0.05;*D1、D2、D3组与B组比较,P<0.05;&D1、D2、D3组间比较,P<0.05。
实验分组 阳性细胞率A(无关对照组) 0.16±0.09 B(正常对照组) 0.45±0.04 C1(LPS 0.1 μg·mL-1)1.01±0.03#C2(LPS 1 μg·mL-1)1.50±0.05#C3(LPS 10 μg·mL-1)1.38±0.37#D1(LTA 0.1 μg·mL-1)3.27±0.18*&D2(LTA 1 μg·mL-1)8.36±0.22*&D3(LTA 10 μg·mL-1)11.50±0.39*&
2.3 IL-1β表达情况
IL-1β表达情况见表2。由表2可见:LTA刺激12h后,细胞培养上清液中可检测到IL-1β分泌,48h内持续上升,不同质量浓度组规律相似;C2、C3组在培养24、48 h时,组内比较差异有统计学意义(P<0.05);培养时间相同时,C3组IL-1β表达量与C2组相似(P>0.05)。随着LTA质量浓度的升高,IL-1β表达量升高,C1组在各时间点IL-1β表达量与相同时间点正常对照组相比,其差异无统计学意义(P>0.05);C2、C3组在各时间点与正常对照组相比,IL-1β表达量的差异均有统计学意义(P<0.05)。
表 2 粪肠球菌LTA诱导HPDLCs IL-1β的表达量Tab 2 Expression of IL-1β induced by E.faecalis LTA on HPDLCs ng·mL-1,n=3,±s

表 2 粪肠球菌LTA诱导HPDLCs IL-1β的表达量Tab 2 Expression of IL-1β induced by E.faecalis LTA on HPDLCs ng·mL-1,n=3,±s
注:#A、B、C1组内各时间点间差异无统计学意义,P>0.05;*C2、C3组内24及48 h差异有统计学意义,P<0.05;&C1组各时间点与A组相比差异无统计学意义,P>0.05;$各时间点IL-1β分泌量与A组相比差异有统计学意义,P<0.05。
培养时间/h 12 24 48 A(正常对照组)# 0.35±0.04 0.41±0.05 0.41±0.06 B(阳性对照组)# 0.57±0.08 0.59±0.06 0.75±0.10 C1(LTA 0.1 μg·mL-1)#&0.42±0.040.48±0.080.52±0.06 C2(LTA 1 μg·mL-1)*$0.49±0.050.54±0.020.62±0.04 C3(LTA 10 μg·mL-1)*$0.59±0.020.68±0.060.79±0.05实验分组
采用1∶100滴度的TLR2中和抗体预处理HPDLCs,1μg·mL-1LTA刺激HPDLCs 24 h后,IL-1β表达量为(0.42±0.02)ng·mL-1,而未经预处理组的表达量为(0.54±0.02)ng·mL-1,两组的差异无统计学意义(P=0.79),提示TLR2中和抗体对LTA引起的IL-1β分泌增多无明显抑制作用。
3 讨论
粪肠球菌是一种革兰阳性兼性厌氧菌,常见于顽固性或继发性根尖周感染中。因其可耐受根管内恶劣的生存环境,对机械预备及药物冲洗具有抵抗力,且对抗生素有耐药性,近年来逐渐受到关注[3-4]。粪肠球菌含有多种毒力因子,如LTA、肽聚糖、透明质酸酶等。LTA是其主要免疫原之一。它是一种位于细胞壁的两性大分子,可通过宿主细胞表面的Toll样受体激活多种免疫细胞分泌炎症因子,引发炎症反应。TLR2是Toll样受体超家族成员中最早被发现的受体之一,可识别多种病原相关分子模式(pathogen associated molecular patterns,PAMPs),如革兰阳性菌LTA、肽聚糖等,同时,也介导某些革兰阴性菌的LPS免疫应答。IL-1β是炎症起始阶段的重要致炎因子,主要由单核-巨噬细胞及中性粒细胞等分泌,几乎所有的有核细胞,如成纤维细胞、内皮细胞以及平滑肌细胞等均可产生。IL-1β可通过局部免疫调节作用引起多种活性反应。它能够加速细胞外基质的降解,直接或协同其他细胞因子间接促进骨吸收、抑制骨形成;能吸引中性粒细胞,引起炎症介质释放等[6]。在牙周炎及根尖周炎组织中发现有高水平的IL-1β,是诱导牙周结缔组织破坏和牙槽骨吸收的重要炎症因子之一[7]。
本研究发现:粪肠球菌LTA与大肠杆菌LPS类似,均可导致机体产生一系列炎症反应。此结果与其他学者[8-10]的发现一致。Draing等[8]比较了金黄色葡萄球菌LTA与大肠杆菌LPS的致炎能力,发现在聚乙烯培养板上孵育过夜的LTA具有更强的免疫活性,其导致全血细胞分泌IL-8及TNF-α的量是相同浓度LPS的数十倍之多。LTA是革兰阳性细菌的重要表面抗原,与革兰阴性菌LPS类似,可引起宿主细胞炎症反应,还具有介导菌体与宿主细胞的黏附、稳定和加强细胞壁等多重作用。本研究还表明:正常HPDLCs的TLR2表达极低,经粪肠球菌LTA作用24 h后,TLR2阳性细胞率明显上升(P<0.05),并与LTA质量浓度呈正相关,与Baik等[11]研究结果近似。Baik等[11]从粪肠球菌细胞壁中提取高纯度LTA,可激活鼠巨噬细胞表面TLR2及核转录因子-κB(nuclear factor-κB,NF-κB)的表达,引起TNF-α和一氧化氮等前炎性细胞因子的分泌,并具有LTA浓度及时间依赖性。Ocaña等[12]发现:LTA可使人中性粒细胞分泌IL-6、TNF-α、IL-1β等炎症因子增加,分泌量与LTA水平呈正相关。这与本研究结果相似,即粪肠球菌LTA的刺激可导致HPDLCs IL-1β分泌增加。笔者推测:TLR2中和抗体可能抵消这种作用。但是,本实验采用TLR2中和抗体预处理细胞,IL-1β分泌量与未处理组并无明显差异。笔者分析:TLR2途径可能在LTA引起的炎症反应中起作用,通过髓样分化因子88(myeloid differentiation 88,MyD88)依赖和非依赖的信号转导途径,激活IL-1受体相关激酶(IL-1 receptor associated kinase,IRAK)和TNF受体相关因子(TNF receptor associated factor,TRAF)等信号分子,最终激活NF-κB,引起各种细胞因子的表达,启动炎症反应[13];TLR2介导的炎症信号转导通路除存在于免疫细胞,可能也存在于HPDLCs,从而在根尖周病的局部炎症和免疫反应中发挥重要作用。但TLR2中和抗体对IL-1β分泌的封闭作用未出现有统计学意义的结果,还需要进一步验证。后续实验将增加TLR2中和抗体的滴度梯度,同时增加LTA及LPS受试组,从多层次对此结果加以验证。也可能,TLR2中和抗体对LTA引起的HPDLCs IL-1β分泌增加并不存在封闭作用。Keller等[14]发现:在成牙本质细胞及牙髓成纤维细胞中,LTA并不会引起TLR2及IL-1β的表达增强,相反,在幼稚的树突细胞中则可检测到TLR2表达及IL-1β分泌随LTA浓度增加而增加的情况。Draper等[15]研究表明:B组链球菌(一种常见的革兰阳性细菌)可以引起巨噬细胞TLR2激活,并引起IL-1β分泌增加;而在TLR2基因缺陷的小鼠中,B组链球菌不能引起IL-1β显著表达。纵观各国学者的研究可以发现:TLR2信号途径是否参与了LTA引起的IL-1β分泌增加,不同的研究结论并不一致,这可能与LTA细菌来源及研究细胞来源不同有关。本研究发现:粪肠球菌LTA刺激HPDLCs 12 h后即可在细胞培养上清液中检测到IL-1β,并在48 h内稳定增加。但孙颖等[16]采用牙龈卟啉单胞菌内毒素刺激HPDLCs,IL-1β在24 h分泌达高峰,48 h有所下降;这可能与牙龈卟啉单胞菌内毒素的致炎性及毒性较强,作用48 h后HPDLCs死亡或活力减低有关,而LTA毒性相对较弱,48 h期间HPDLCs依然保持分泌IL-1β的活力。
综上所述,本研究证实粪肠球菌LTA可以导致HPDLCs表面TLR2表达上调,并诱导HPDLCs IL-1β分泌增加。由此推测:粪肠球菌LTA可能参与了根尖周病的免疫应答。
[1] Lekie P,McCulloh CA.Periodontal ligament cell populations:The central role of fibroblasts in creating a unique tissue[J].Anat Rec,1996,245(2):327-341.
[2] Wang PL,Azuma Y,Shinohara M,et al.Toll-like receptor 4-mediated signal pathway induced byPorphyromonas gingivalislipopolysaccharide in human gingival fibroblasts[J].Biochem Biophys Res Commun,2000,273(3):1161-1167.
[3] Rôças IN,Siqueira JF Jr,Santos KR.Association ofEnterococcus faecaliswith different forms of periradicular diseases[J].J Endod,2004,30(5):315-320.
[4] Distel JW,Hatton JF,Gillespie MJ.Biofilm formation in medicated root canals[J].J Endod,2002,28(10):689-693.
[5] Kopp EB,Medzhitov R.The Toll-receptor family and control of innate immunity[J].Curr Opin Immunol,1999,11(1):13-18.
[6] Bascones A,Gamonal J,Gomez M,et al.New knowledge of the pathogenesis of periodontal disease[J].Quintessence Int,2004,35(9):706-716.
[7] Baqui AA,Meiller TF,Chon JJ,et al.Granulocyte-macrophage colony-stimulating factor amplification of interleukin-1beta and tumor necrosis factor alpha production in THP-1 human monocytic cells stimulated with lipopolysaccharide of oral microorganisms[J].Clin Diagn Lab Immunol,1998,5(3):341-347.
[8] Draing C,Sigel S,Deininger S,et al.Cytokine induction by Grampositive bacteria[J].Immunobiology,2008,213(3/4):285-296.
[9] Su SC,Hua KF,Lee H,et al.LTA and LPS mediated activation of protein kinases in the regulation of inflammatory cytokines expression in macrophages[J].Clin Chim Acta,2006,374(1/2):106-115.
[10] Deininger S,Traub S,Aichele D,et al.Presentation of lipoteichoic acid potentiates its inflammatory activity[J].Immunobiology,2008,213(6):519-529.
[11] Baik JE,Kum KY,Yun CH,et al.Calcium hydroxide inactivates lipoteichoic acid fromEnterococcus faecalis[J].J Endod,2008,34(11):1355-1359.
[12]Ocaña MG,Asensi V,Montes AH,et al.Autoregulation mechanism of human neutrophil apoptosis during bacterial infection[J].Mol Immunol,2008,45(7):2087-2096.
[13] Miyake K.Roles for accessory molecules in microbial recognition by Toll-like receptors[J].J Endotoxin Res,2006,12(4):195-204.
[14] Keller JF,Carrouel F,Colomb E,et al.Toll-like receptor 2 activation by lipoteichoic acid induces differential production of proinflammatory cytokines in human odontoblasts,dental pulp fibroblasts and immature dendritic cells[J].Immunobiology,2010,215(1):53-59.
[15] Draper DW,Bethea HN,He YW.Toll-like receptor 2-dependent and-independent activation of macrophages by group B streptococci[J].Immunol Lett,2006,102(2):202-214.
[16] 孙颖,束蓉,张秀丽,等.TLR4对人牙周膜细胞分泌IL-1β、IL-6和TNF-α的影响[J].上海交通大学学报:医学版,2007,27(6):646-648.Sun Ying,Shu Rong,Zhang Xiuli,et al.Effect of TLR4 on production of IL-1β,IL-6 and TNF-α in human periodontal ligament cells[J].J Shanghai JiaoTong University:Medical Science,2007,27(6):646-648.
