一种具有抑制细胞增殖的薤白多糖的分离及性质
2012-09-05张占军王富花曾晓雄
张占军,王富花,曾晓雄
(1.扬州环境资源职业技术学院,江苏扬州 225127;2.南京农业大学食品科技学院,江苏南京 210095;3.扬州工业职业技术学院,江苏扬州 225127)
多糖广泛存在于植物、微生物(真菌和细菌)、藻类和动物体。目前多糖已成为天然药物及保健品研发中的重要组成部分,国外多数制药公司都有从事糖类药物的研发。研究发现多糖具有抗氧化,抗肿瘤,抗凝血及免疫调节等多种功能。我国也十分重视多糖和糖复合物的研究工作,如国家基金委2011项目指南将扶持和鼓励多糖和糖复合物的研究列入生命科学重点资助方向。薤白(Allium macrostemonBunge)为卫生部2002年公布的87种药食两用植物之一,薤白别名野葱、野白头、小根蒜等,为百合科葱属多年生草本植物,广泛分布于中国、日本和韩国等国的平原地区,多食用,其干燥鳞茎也可入药,药用薤白为植物小根蒜A.macrostemonBge.或薤Allium chinensisG.Don的干燥鳞茎[1]。薤白味辛、苦,性温,无毒,具有理气、宽胸、通阳、散结之功效,中医长期用于治疗胸闷刺痛、泻痢后重、肺气喘急等疾病[2]。目前有关薤白多糖的研究主要集中在国内,夏新奎等[3-6]对薤白多糖进行了分离纯化及体外抗氧化活性研究,结果发现其中碱洗级分具有较高的清除OH·作用。另外杜敏华等[7-8]对新鲜小根蒜多糖进行了提取纯化及对单糖组分进行了鉴定,确定了其单糖组分主要为果糖和葡萄糖。除此以外有关薤白多糖的研究未见任何文献报道。本工作拟利用分步醇沉法,通过提取分离纯化得到低分子量的薤白多糖,应用苯酚-硫酸法、考马斯亮蓝法、硫酸-间羟联苯法、氯化钡-明胶法、高效液相凝胶渗透色谱法、红外及紫外光谱法对其理化性质进行研究,并对其抑制肿瘤细胞BGC-823的增殖活性进行研究,有望为薤白的临床使用及保健性食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
薤白:安徽慧隆中药饮片有限公司提供,产地江苏,经南京农业大学园艺学院郭巧生教授鉴定为百合科葱属植物薤白Allium macrostemonBge.的干燥鳞茎;DEAE-纤维素-52凝胶与Sephadex G-100、噻唑蓝(MTT):Sigma公司。
1.2 仪器与设备
HP 1100高效液相色谱系统、6890N气相色谱仪:美国Agilent公司;IR 200傅里叶红外光谱仪:美国Nicolet公司;Alpha 1-2型冷冻干燥机:英国LABCONCO公司。
1.3 方法
1.3.1 薤白多糖的分步醇沉
取薤白鳞茎189.0 g,经烘箱80℃烘干,粉碎后过筛(孔筛0.5 mm),置圆底烧瓶中,同时加入3倍量石油醚电热套加热回流脱脂3 h,55℃烘干后用80%(体积百分比浓度,下同)乙醇回流3 h,以除去部分色素及低聚糖,挥干乙醇后粉碎,得经预处理的薤白粉末149.6 g;按照已得出的优化条件,在经预处理的薤白粉末中加入12倍体积蒸馏水,87℃浸提100 min,重复提取3次,合并提取液并浓缩,浓缩液加乙醇至终浓度为40%,5 000 r/min离心10 min,冻干得粗多糖AMP40及上清液;将以上上清液浓缩至无醇后,加乙醇至终浓度为60%,离心冻干得粗多糖AMP60及上清液;将该上清液浓缩至无醇后,加乙醇至乙醇终浓度为80%,离心弃去上清液,冻干得粗多糖AMP80。
1.3.2 薤白粗多糖AMP80的分离纯化
1.3.2.1 薤白多糖的DEAE-52纤维素柱色谱
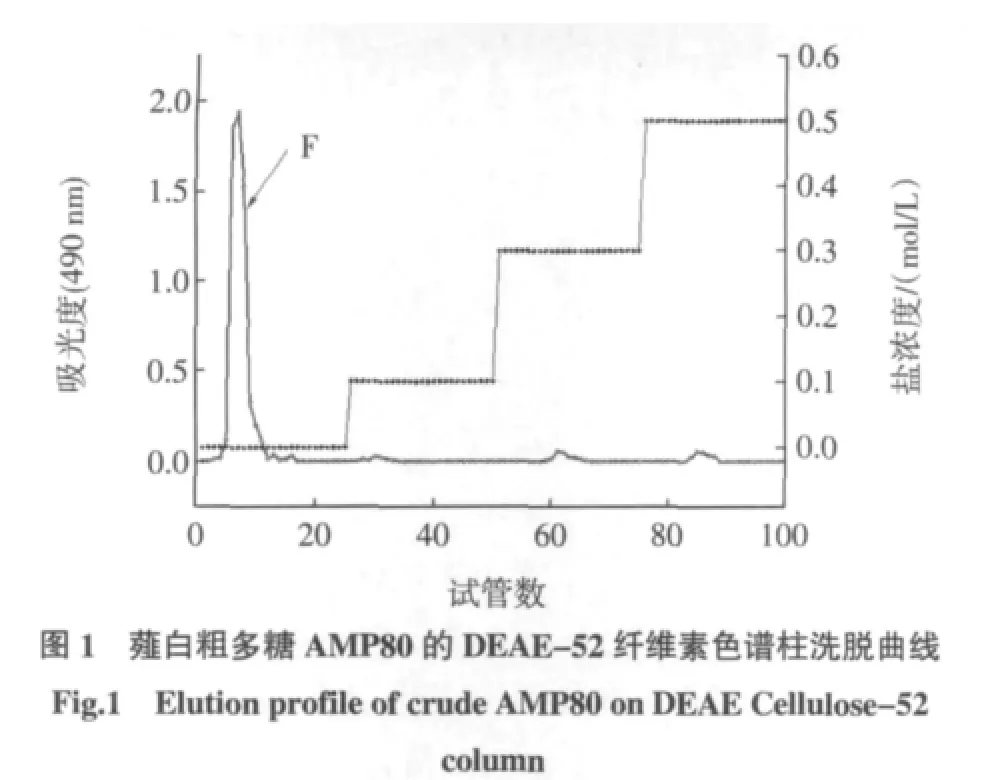
按照Qiao等[9]报道的方法稍作修改,即采用DEAE-52-纤维素交换柱色谱法对薤白粗多糖进行初步分离纯化,即将经预处理的DEAE-纤维素湿法装柱(2.6×30 cm),柱子装好后依次用3倍柱体积的蒸馏水、2倍柱体积0.5 mol/L的NaCl和2倍柱体积的蒸馏水进行平衡,备用。将薤白多糖AMP80样品装入透析袋,蒸馏水透析48 h后冻干得AMP80T。取AMP80T约200 mg用蒸馏水溶解后上样,分别用蒸馏水,0.1、0.3、0.5 mol/L的NaCl进行洗脱,流速1.0 mL/min,分步收集流分,根据苯酚-硫酸法显色反应结果合并相同馏分。各级分浓缩,装入透析袋,蒸馏水透析48 h,冷冻干燥即可得多糖DEAE-52纯化产物。同时以收集的管数为横坐标、吸光值为纵坐标绘制DEAE-52-纤维素色谱柱洗脱曲线。
1.3.2.2 薤白多糖的葡聚糖凝胶色谱法纯化
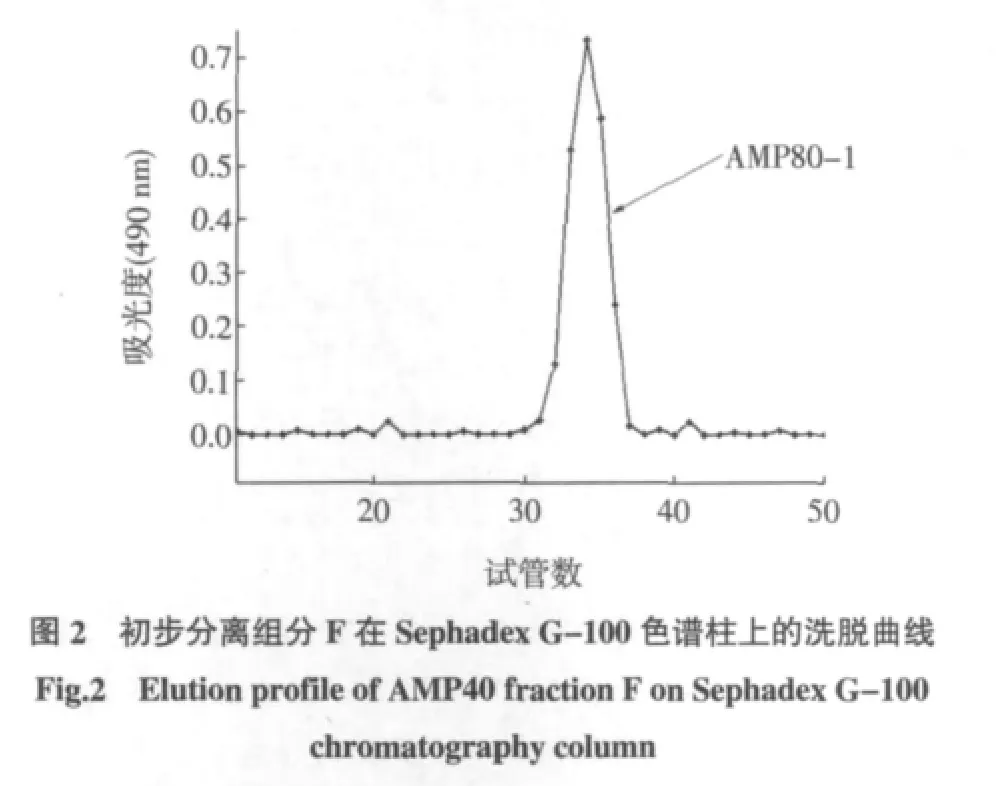
经DEAE-52纤维素初步纯化的多糖样品用葡聚糖凝胶Sephadex色谱柱法进行进一步纯化,分别称取经DEAE-52纤维素初步纯化的各多糖组分约20 mg,溶于2 mL去离子水中(如不溶,可适当加热),湿法上样于Sephadex G-100层析柱(2.6×60 cm)。用去离子水洗脱,流速0.50 mL/min,分步收集器收集(10 min/管)。硫酸-苯酚法检测各收集管中多糖含量(490 nm处吸收值),同时以收集的管数为横坐标、吸光值为纵坐标绘制葡聚糖Sephadex G-100色谱柱洗脱曲线。
1.3.3 薤白多糖的基本理化性质分析
1.3.3.1 总糖含量测定
采用苯酚-硫酸法[10]测定总糖含量。
1.3.3.2 蛋白质含量测定
多糖样品中蛋白质含量的测定,采用Bradford[11]报道的考马斯亮蓝法并略作修改。即配制适当浓度的样品溶液,准确吸取1.0 mL,加考马斯亮蓝G-250液5.0 mL,混匀,2 min后测595 nm波长的吸光值。该法灵敏度高、操作简便,是一种常用的微量蛋白质快速测定方法。
1.3.3.3 糖醛酸含量测定
多糖样品中糖醛酸含量的测定,采用Blumenkrantz等[12]报道的硫酸-间羟联苯法略作修改。即取多糖溶液0.25 mL,冰浴中冷却后各管加上述四硼酸钠-浓硫酸溶液1.5 mL,旋涡混合器混匀,沸水浴中加热5 min,冰浴冷却至室温。各管再加0.15%间羟联苯溶液0.025 mL,混匀,于分光光度计520 nm处测吸光值。根据葡萄糖醛酸标准曲线和多糖样品的吸光值计算出多糖样品中糖醛酸含量。
1.3.3.4 硫酸基含量测定
多糖样品中硫酸基含量的测定,参照Dodgson等[13]报道的氯化钡-明胶比色法并略作修改。即称取多糖样品约10 mg,加1 mL盐酸溶液(1 mol/L),密封试管,于恒温干燥箱中100℃水解6 h。冷却后,旋转蒸发器40℃旋转蒸干,残渣用1 mL蒸馏水溶解。取水解液0.2mL,加蒸馏水0.8mL,再加8%三氯乙酸溶液0.7 mL、0.5%氯化钡明胶溶液0.5 mL,混匀,冷却,15 min后测360 nm波长的吸光值(A1)。另取一份水解液0.2 mL,加蒸馏水0.8 mL,再加8%三氯乙酸溶液0.7 mL、0.5%明胶溶液0.5 mL,混匀,冷却,15 min后测360 nm波长的吸光值(A2)。用以消除水解液中所含紫外物质的干扰。根据硫酸钾标准曲线和两次反应体系的吸光值之差(A1-A2)计算多糖样品中硫酸基的含量。
1.3.3.5 纯度鉴定及相对分子质量测定
多糖样品的纯度鉴定和相对分子质量测定,参照Alsop等[14]以及Roy等[15]报道的高效液相凝胶渗透色谱法(HPGPC)稍作修改。
1)色谱条件
Agilent 1100 series高效液相色谱及示差检测器;TSK-Gel G3000 SWxl色谱柱 (7.5×300 mm,Tosoh Corp.,Tokyo,Japan);流动相:含 0.1 mol/L Na2SO4的0.01 mol/L 磷酸盐缓冲液(pH6.8);流速:0.70 mL/min;进样量:20 μL;柱温:25 °C。
2)分子量-保留时间标准曲线的绘制
精确称取不同分子量普鲁兰多糖P-82系列的标准样品(0.59~78.8×104u),用流动相配制成浓度约为1.5 mg/mL的分子量标准样品溶液,经0.45 μm滤膜过滤后,按以上色谱条件依次进样,记录相应的保留时间(retention time,tR),然后以分子量对数(logMw)为纵坐标,保留时间为横坐标绘制标准曲线,回归得出相应线性方程。
3)多糖分子量测定
将待测多糖同法配制成浓度为1.5 mg/mL的溶液,经0.45 μm滤膜过滤,在相同条件下进行高效液相色谱分析,获得各多糖HPGPC图谱,并记录样品色谱图的保留时间tR值。根据多糖分子量标准曲线和多糖样品在色谱图上的保留时间可计算出多糖样品的重均相对分子量;同时分析多糖样品色谱图上的色谱峰数目和形状进一步鉴定多糖的纯度。
1.3.3.6 红外光谱分析
多糖样品的红外光谱分析参照Wang等[16]报道的KBr压片法,在傅立叶红外光谱仪Nicolet IR 200(Madison,WI,USA)上进行。称取2 mg左右经P2O5干燥的多糖样品,与已干燥的适量KBr粉末在玛瑙研钵中充分研磨均匀,用压片机压成薄片,进行红外光谱测定,扫描范围为 4 000 cm-1~ 500 cm-1。测定样品前用不加多糖样品的KBr薄片进行背景基线扫描。
1.3.3.7 紫外光谱扫描
称取多糖样品,用去离子水配成2 mg/mL的溶液,用UNICO UV-2802型紫外可见分光光度计进行扫描,扫描波长190 nm~800 nm。
1.3.4 薤白多糖样品对BGC-823细胞增殖的抑制作用
以薤白多糖纯化组分AMP80-1为实验样品,对接种BGC-823的细胞培养板预培养24 h后进行加样处理,用排枪每孔吸去50 μL培养液。实验设正常对照组和不同浓度(25、50、100、200、400 μg/mL)的样品组。正常对照组每孔加50 μL DMEM培养液;样品组分别加入终浓度为 25、50、100、200、400 μg/ml的 AMP80-1溶液(用新鲜DMEM完全培养基溶解)各50 μL/孔。人胃癌细胞 BGC-823分别培养 24、48、72 h后,加入5 mg/mL MTT溶液10 μL,继续培养4 h后,小心移去培养液,每孔加入100 μL DMSO溶液溶解蓝紫色结晶。水平晃动摇匀后,用酶标仪测定550 nm波长下各孔的光吸收值(Abs),检测不同多糖样品对肿瘤细胞的抑制情况,按下式计算多糖对肿瘤细胞的抑制率:
抑制率/%=(1-Abs样品/Abs对照)×100。
2结果与分析
2.1 薤白多糖的分步醇沉
薤白鳞茎经干燥、粉碎、热水提取、乙醇分步沉淀、离心,冻干,分别得到不同级分的薤白粗多糖提取物。其中80%醇沉部分(AMP80)18.5 g,得多糖粗提物AMP80的提取率为9.8%。
2.2 薤白多糖的DEAE-纤维素-52色谱法初步分离
将AMP80溶于适量蒸馏水中,加样进行DEAE-52纤维素柱层析,流速1 mL/min,自动收集器分部收集,每隔10 min收集1管,苯酚-硫酸法跟踪检测各管糖含量,绘制洗脱曲线,如图1所示。
2.3 初步纯化组分经Sephadex G-100的进一步纯化
对经DEAE-52纤维素色谱柱初步纯化的组分F,通过葡聚糖凝胶Sephadex G-100柱层析对其分别进行进一步纯化得纯化多糖AMP80-1,具体洗脱曲线如图2所示。
2.4 薤白多糖的基本理化性质
薤白粗多糖AMP80及其纯化组分AMP80-1的总糖、蛋白质、糖醛酸及硫酸基含量见表1。
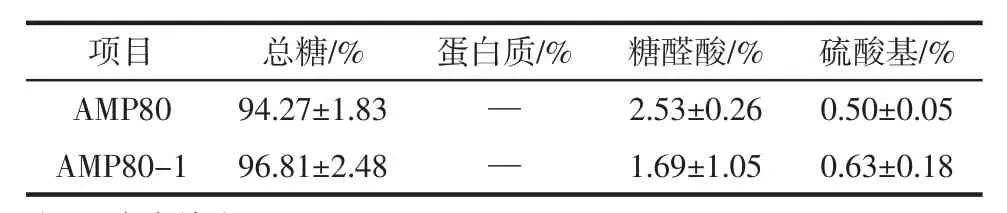
表1 薤白多糖AMP80及AMP80-1的基本理化性质Table 1 Preliminary characterization of AMP80 and AMP80-1
从表1可以看出,薤白多糖AMP80经纯化后,总糖含量,硫酸基含量均有上升,而糖醛酸含量有所降低,AMP80及AMP80-1均不含蛋白质。
2.5 纯度及相对分子质量
采用高效液相凝胶渗透色谱法对薤白多糖纯化组分AMP80-1的分子量进行了测定,同时进一步对纯化多糖的均一性进行了验证结果见图3。
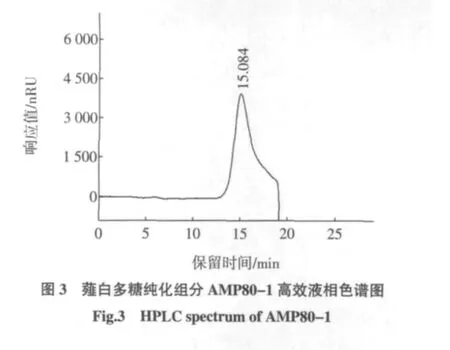
从图3可以看出,多糖组分AMP80-1在色谱柱上显示峰形为对称的单峰(由于色谱柱流速原因,存在一定的拖尾现象)。其保留时间分别为15.084 min。利用在一定范围内,多糖保留时间与其相对分子质量的对数呈线性关系,以已知分子量的普鲁兰多糖为标准品,通过高效液相凝胶渗透色谱法绘制相对分子量的标准曲线,得回归方程为:LogMw=-4.275 3x+31.807,R2=0.998 9,运用线性回归方程计算,得到AMP80-1的重均相对分子质量是8.1 ku。
2.6 薤白多糖的红外光谱分析
采用KBr压片法,借助于Nicolet IR 200红外光谱仪对薤白粗多糖AMP80及其纯化组分AMP80-1进行红外光谱分析,其结果如图4所示。
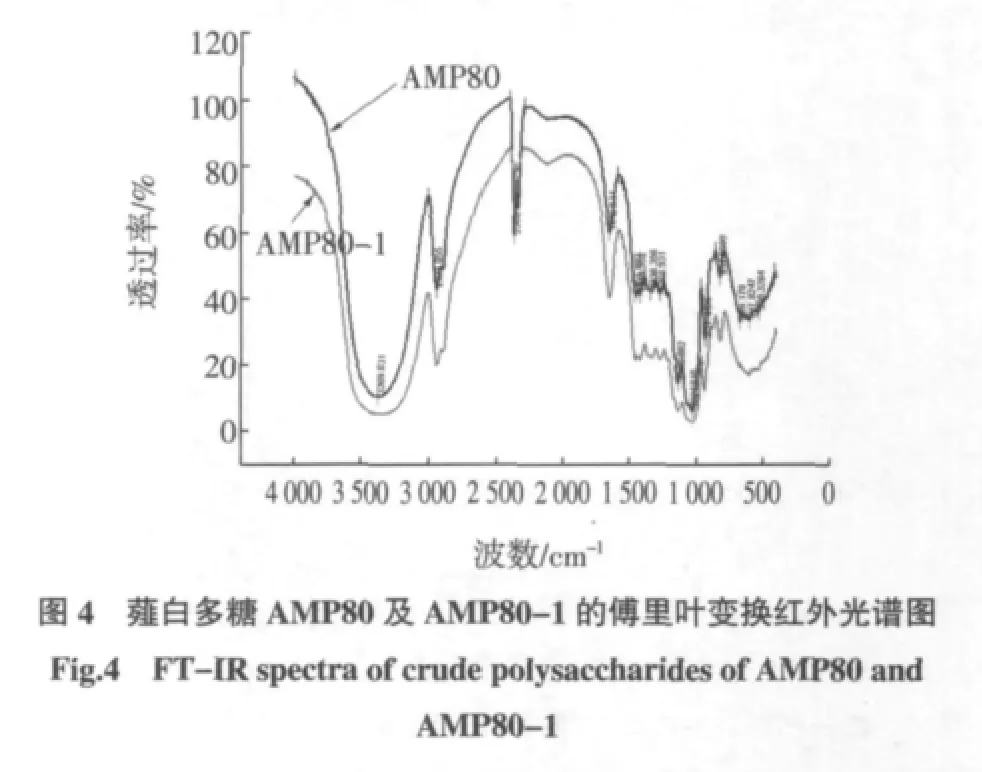
从图 4 可以看出,在 3 500 cm-1~3 300 cm-1范围内出现了宽而强的多糖羟基O-H伸缩振动峰,其值小于 3 400 cm-1,说明为分子间氢键,3 000 cm-1~2 800 cm-1范围内出现多糖的C-H强伸缩振动峰,这两个吸收峰均为多糖类物质的特征峰[17]。其中AMP80-1在931cm-1处和1 024 cm-1处出现吸收峰,这是由吡喃环的环非对称环伸缩振动和吡喃糖环的C-O伸缩振动造成的[18]。由此可以推断,薤白多糖AMP80-1主要为吡喃环糖苷连接。
2.7 薤白多糖的紫外光谱分析
采用紫外可见分光光度法对薤白纯化多糖AMP80-1进行了紫外光谱扫描,结果如图5所示。
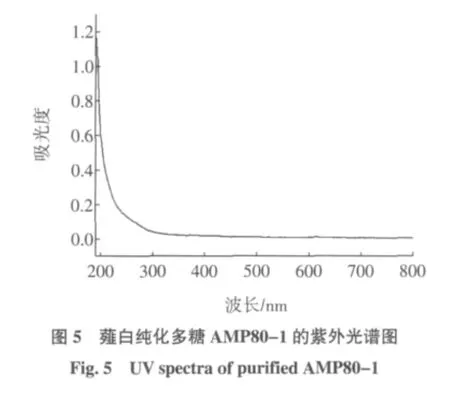
可以看出:薤白纯化多糖AMP80-1在260 nm和280 nm处均没有吸收峰,表明其不含有核酸和蛋白质,此结果与薤白多糖样品中未检出蛋白质的测定结果一致。这也进一步说明AMP80-1为单纯的多糖组分。
2.8 薤白多糖AMP80-1对人肺癌细胞BGC-823生长的抑制作用
薤白多糖纯化组分AMP80-1对人胃癌细胞BGC-823作用24、48、72 h后增殖的影响如图6所示。
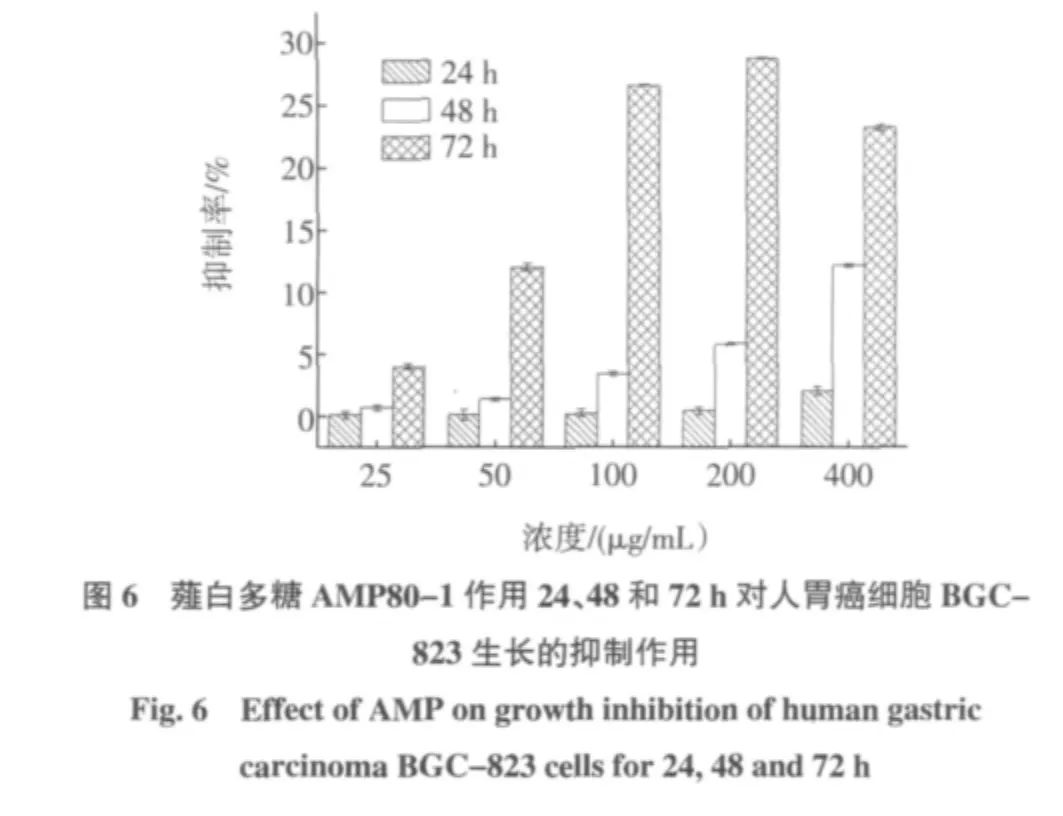
从图6可以看出,在同一浓度下,随着作用时间的延长,薤白多糖AMP80-1对人胃癌细胞BGC-823生长的抑制作用逐渐增强。作用24 h时,抑制作用较弱,浓度差别不明显;作用48 h时,呈较明显的浓度梯度效应,即随着浓度的增加抑制作用也逐渐增强;作用72 h时,刚开始也呈现呈较明显的浓度梯度效应,但当多糖浓度达到400 μg/mL时,抑制作用有所下降。
3 结论
本文对薤白鳞茎经干燥、粉碎、热水提取、40%,60%和80%乙醇分步沉淀、离心,冻干,得到不同80%醇沉级分AMP80,其提取率为9.8%。经DEAE-52纤维素柱层析及葡聚糖凝胶Sephadex G-100柱层析纯化后得到薤白纯化多糖AMP80-1,分别采用苯酚-硫酸法、考马斯亮蓝法、硫酸-间羟联苯法、氯化钡-明胶法对薤白粗多糖AMP80及纯化组分AMP80-1中总糖、蛋白质、糖醛酸、硫酸基含量进行了分析。结果表明,各多糖组分不含蛋白质,硫酸基含量普遍较低。采用高效液相凝胶渗透色谱法对AMP80-1的均一性进行了鉴定,同时测定了其相对分子质量为8.1 ku。红外光谱分析结果表明:AMP80-1主要为吡喃糖苷连接,紫外光谱分析结果表明,AMP80-1在260 nm和280 nm处均未出现明显的吸收峰,说明其不含核酸和蛋白质,这一结果与理化分析中蛋白质含量的测定结果一致。细胞实验结果显示,薤白多糖AMP80-1对人胃癌细胞BGC-823生长存在一定的抑制作用,但抑制作用相对较弱,其对人胃癌细胞的抑制作用强弱是否与其较低的糖醛酸、硫酸基含量及低分子量有关,还需做进一步的研究。
:
[1]国家药典委员会.中华人民共和国药典2010年版一部 [M].北京:中国医药科技出版社,2010:353
[2]《中药辞海》编审组.中药辞海(第四卷)[M].北京:中国医药科技出版社,1998:1546
[3]夏新奎.薤白多糖的分离纯化及抗氧化活性研究 [D]:咸阳:西北农林科技大学,2007:37
[4]夏新奎,杨海霞,李纯,等.薤白粗多糖提取工艺研究[J].安徽农业科学,2006(17):4403-4405
[5]夏新奎,杨海霞,李纯,等.薤白多糖的分离纯化及组成分析[J].食品工业科技,2010(1):244-247
[6]夏新奎,张建新.薤白多糖抗氧化活性研究[J].信阳农业高等专科学校学报,2007(4):138-139
[7]杜敏华,田龙.小根蒜多糖的提取纯化及其单糖组分的鉴定[J].食品工业科技,2007(4):77-80
[8]杜敏华,田龙,惠丰立,等.小根蒜多糖的分离及其组分的初步表征[J].食品工业,2007(3):25-28
[9]Qiao Deliang,Hu Bing,Gan Dan,et al.Extraction optimized by using response surface methodology,purification and preliminary characterization of polysaccharides from Hyriopsis cumingii[J].Carbohydrate polymers,2009,76(3):422-429
[10]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical bio-chemistry,1956,28:350-356
[11]Bradford MM.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytic biochemistry,1976,72:248-254
[12]Blumenkrantz N,Asboe-Hansen G.New Method for quantitative determinationofuronicacids[J].Analyticalbiochemistry,1973,54:484-489
[13]Dodgson K S,Price R G.A note on the determination of the ester sulfate content of sulfate polysaccharides[J].Biochemistry Journal,1962,84:106-110
[14]Alsop R M,Vlachogiannis G J.Determination of the molecularweight of clinical dextran by gel-permeation chromatography on TSK-Pw-type columns[J].Journal of chromatography,1982,246(2):227-240
[15]Roy S K,Maiti D,Mondal S,et al.Structural analysis of a polysaccharide isolated from the aqueous extract of an edible mushroom,Pleurotus sajor-caju,cultivar Black Japan[J].Carbohydrate research,2008,343(6):1108-1113
[16]Wang Zhaomei,Peng Xiao,Lee Daniel K-L,et al.Structural characterisation and immunomodulatory property of an acidic polysaccharide from mycelial culture of Cordyceps sinensis fungus Cs-HK1[J].Food chemistry,2011,125(2):637-643
[17]Kodali V P,Das S,Sen R.An exopolysaccharide from a probiotic:Biosynthesis dynamics,composition and emulsifying activity[J].Food Research International,2009,42(5/6):695-699
[18]赵力超,杜征,刘欣,等.慈姑抗性淀粉的理化特性研究[J].食品科学,2010,31(17):55-59
