Tricine-SDS-PAGE测定小麦蛋白酶解物分子量分布
2012-09-05张锐昌王绮张应龙徐志宏
张锐昌,王绮,张应龙,徐志宏
(1.山东商业职业技术学院,山东济南 250103;2.广东省农业科学院,广东广州 510640)
小麦蛋白(俗称谷朊粉)是小麦淀粉生产的副产物,其蛋白质含量高达72%~85%,主要由溶于70%(体积比)乙醇溶液的麦醇溶蛋白和溶于稀酸或稀碱溶液的麦谷蛋白组成。而且氨基酸组成比较齐全,是营养丰富,物美价廉的纯天然植物性蛋白源。但是,由于小麦蛋白自身独特的氨基酸组成,含有较多的疏水性氨基酸和不带电荷的氨基酸,分子内疏水作用区域较大,溶解度较低,往往不能满足食品加工的需要,应用具有很多局限性[1-2]。因此,考虑采用一定的改性手段,改善小麦蛋白的功能性,提高副产物综合利用价值。而酶法改性已成为近年来小麦蛋白深加工研究领域中的一个热点[3]。小麦蛋白经特定的蛋白酶降解所形成的小分子肽类,不仅容易吸收,而且具有多种生理活性[4]。最近Matsui T[5]酶解小麦蛋白粉分离纯化出抑制血管紧张素转化酶(ACE)活性最强的组分。张亚飞等[6]采用碱性蛋白酶水解小麦蛋白,得到的小麦肽经小鼠体外脾淋巴细胞增殖反应鉴定其具有免疫活性。程云辉等[7-9]利用小麦蛋白粉酶解制备的多肽具有抗氧化性。小麦蛋白酶解物可作为功能性食品、肽类药物进行开发,拓宽其应用领域。但是目前对小麦蛋白酶解物功能性质的研究较少,为了进一步促进小麦蛋白工业化开发转化的需要,本文对小麦蛋白酶解物的功能性质进行了探讨,以其为成果转化中提供科学的佐证资料。
1 材料与方法
1.1 材料
1.1.1 主要原料
小麦蛋白:产地江苏徐州,蛋白质≥75.0%;小麦蛋白酶解物:参考酶解工艺中华人民共和国农业部功能食品重点实验室自制[10-11];鲁花压榨一级花生油:产地山东省莱阳市龙门东路39号。
1.1.2 试剂
丙烯酰胺、甲叉双丙烯酰胺、尿素:Sigma;四甲基乙二胺:(tetramethylethylenediamine,TEMED);三羟甲基氨基甘氨酸:(Tricine,Sigma);三羟甲基氨基甲烷:(Tris碱,Genview);十二烷基硫酸钠:(SDS,Sigma);低分子量蛋白标准品(Marker):(Marker含有 Phosphprylase 97 kU、Albumin 66 kU、Glutamic dehydrogenase 53 kU、Glyceraldehyde-3-phosphatedehydrogenase 35 kU、Tryjpsinogen 24 kU)等5种成分可以直接使用,上样量5 μL~10 μL):北京鼎国生物技术发展中心有限责任公司;过硫酸铵(AP):汕头市光华化学厂;巯基乙醇、考马斯亮蓝R-250、冰醋酸、甲醇、甘油。
1.1.3 仪器
Min-protein垂直电泳槽、蛋白质微量电泳仪:北京六一仪器厂;数码照相。
1.2 方法
1.2.1 Tricine-SDS-PAGE 蛋白质电泳缓冲液的配制[12-15]
正极缓冲液(10×):将 121.14 gTris溶于400 mL重蒸水,用浓HCl调至pH为8.9,定容至500 mL;负极缓冲液(10×):将 60.55 gTris、89.58 gTricine及 5.0 gSDS溶于400 mL重蒸水中,加水至终体积为500 mL;凝胶缓冲液(3×):将 181.5 gTris、1.5 gSDS溶于 400 mL 重蒸水中,用浓HCl滴定至pH8.45,再加水稀释至500 mL。样品缓冲液由 4%SDS、12%甘油、50 mmol/L Tris、5%巯基乙醇(体积比),及少许溴酚蓝(可以适当调整溴酚蓝的用量保证电泳时的最佳指示)组成,pH为6.8。
1.2.2 丙烯酰胺储存液配制
3C丙烯酰胺储存液:将48 g丙烯酰胺和1.5 g甲叉双丙烯酰胺溶于重蒸水中至100 mL;
5C丙烯酰胺储存液:用重蒸水溶解47 g丙烯酰胺和2.5 g甲叉双丙烯酰胺成100 mL溶液。
1.2.3 电泳样品与样品缓冲液
将样品与等体积的样品缓冲液混合,蛋白质样品浓度为 2 mg/mL~5 mg/mL,上样前沸水浴 5 min~10 min,每次点样量 20 μL~30 μL[16]。
1.2.4 固定液、染色液和脱色液配制
固定液:50mL甲醇+10mL冰醋酸,稀释至100mL;染色液:考马斯亮蓝R250 1.25 g溶于230 mL甲醇中,再加40 mL冰醋酸,稀释至500 mL;脱色液:50 mL甲醇+75 mL冰醋酸,稀释至1 000 mL。
1.2.5 电泳的操作方法
1.2.5.1 不同组成的丙烯酰胺溶液的配制
Tricine-SDS-PAGE的凝胶由不同分子组成的丙烯酰胺和甲叉双丙烯酰胺混合液聚合而成。其中浓缩胶由3C丙烯酰胺储存液配成4%的丙烯酰胺溶液聚合而成,夹层胶由3C丙烯酰胺储存液配成10%的丙烯酰胺溶液聚合而成,致密胶由5C丙烯酰胺储存液配成16.5%的丙烯酰胺溶液(添加36.5%尿素)聚合而成,凝胶配方见表1。

表1 丙烯酰胺溶液的组成Table 1 Composition of acrylamide solution
1.2.5.2 灌胶
凝胶制作采用三层不连续胶的结构,由致密胶+夹层胶+浓缩胶构成。灌胶前,各种丙烯酰胺溶液分别加入10 μL新鲜配制的10%的过硫酸氨和1 μL的100%的TEMED,随即灌胶。注意慢速搅动,尽量避免空气带入胶中。灌胶顺序为:先灌下层的致密胶,再覆盖以中间的夹层胶,然后铺浓缩胶。灌胶后立即加入几滴饱和正丁醇溶液压平界面,然后用滤纸吸取顶层的饱和正丁醇,再灌注下一层胶[17]。注入浓缩胶后嵌入梳子,静置以聚合形成三明治式的不连续梯度凝胶。
1.2.5.3 点样
用微量进样器汲取样品,将探针深入凝胶孔距底部1/3处,小心注入样品,轻轻抽出探针,防止样品翻出凝胶孔,从而干扰试验结果。按标号依次点样,并及时记录加样顺序和序号。
1.2.5.4 电泳
内槽加入负极电泳缓冲液,外槽加入正极电泳缓冲液,形成Trcine-SDS-PAGE电泳系统。先用30 mA恒流电泳,当样品进入分离胶后可以适当的提高到35 mA~40 mA。当溴酚蓝指示剂离胶片底部约有1 cm时停止电泳。注意剥胶时的技巧,先撬开其中一个的底角,然后用探针划开底板两侧的胶壁,要努力保持胶片的完整。
1.2.5.5 胶片的处理
先将胶片放入中固定液中至少固定30 min。再放入染色液中染色1.5 h~2.0 h,再转至脱色液中扩散脱色,直到背景清晰。用甘油溶液孵育后用手动数码照相机牌照。
2 结果与分析
2.1 胃蛋白酶酶解物多肽分子量大小的分布
由电泳中蛋白Marker标准回归曲线图1,得到方程 Y=-2.226 3X+5.341 9(R2=0.990 7)。
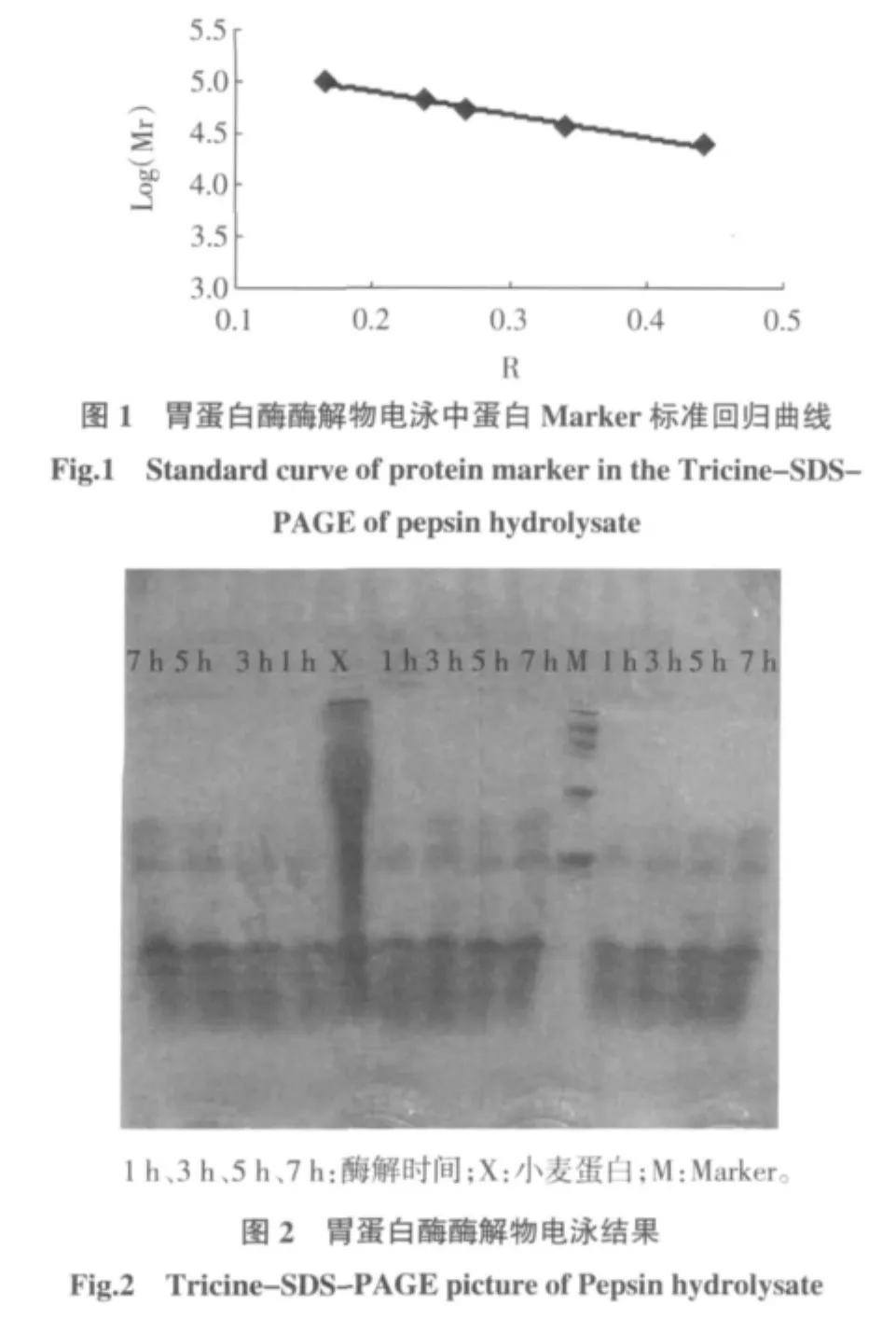
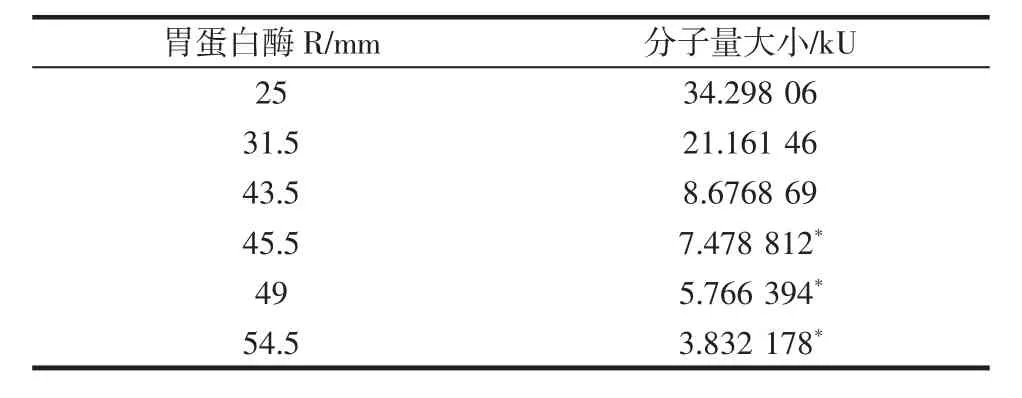
图2 小麦蛋白胃蛋白酶酶解物多肽分子量的分布Table 2 Result of electrophoresis of pepsin hydrolysis
由图2和表2可知,小麦蛋白胃蛋白酶酶解物的分子量主要集中在3.83 kU~7.47 kU,条带分布清晰连续;随着时间的延长,在8.68 kU附近有淡色的条带出现;其次是在21.16、34.3 kU附近,随着酶解程度的提高,出现了比较清晰的条带,应该属于蛋白质酶解物中分子量比较大的部分;不同酶解时间可以看出:随着时间的延长,大分子量部分的条带逐渐清晰,表明酶解反应的程度不断加强。同时,与小麦蛋白底物作了一个对照,小麦蛋白的电泳分布是从小分子量到大分子量的一条连续的条带,而且主要集中到24 kU~96 kU大分子量中。
2.2 碱性蛋白酶酶解物多肽分子量大小的分布
由电泳中蛋白Marker标准回归曲线图3,得到方程 Y= -1.982 7X+5.234 4(R2=0.990 2)。
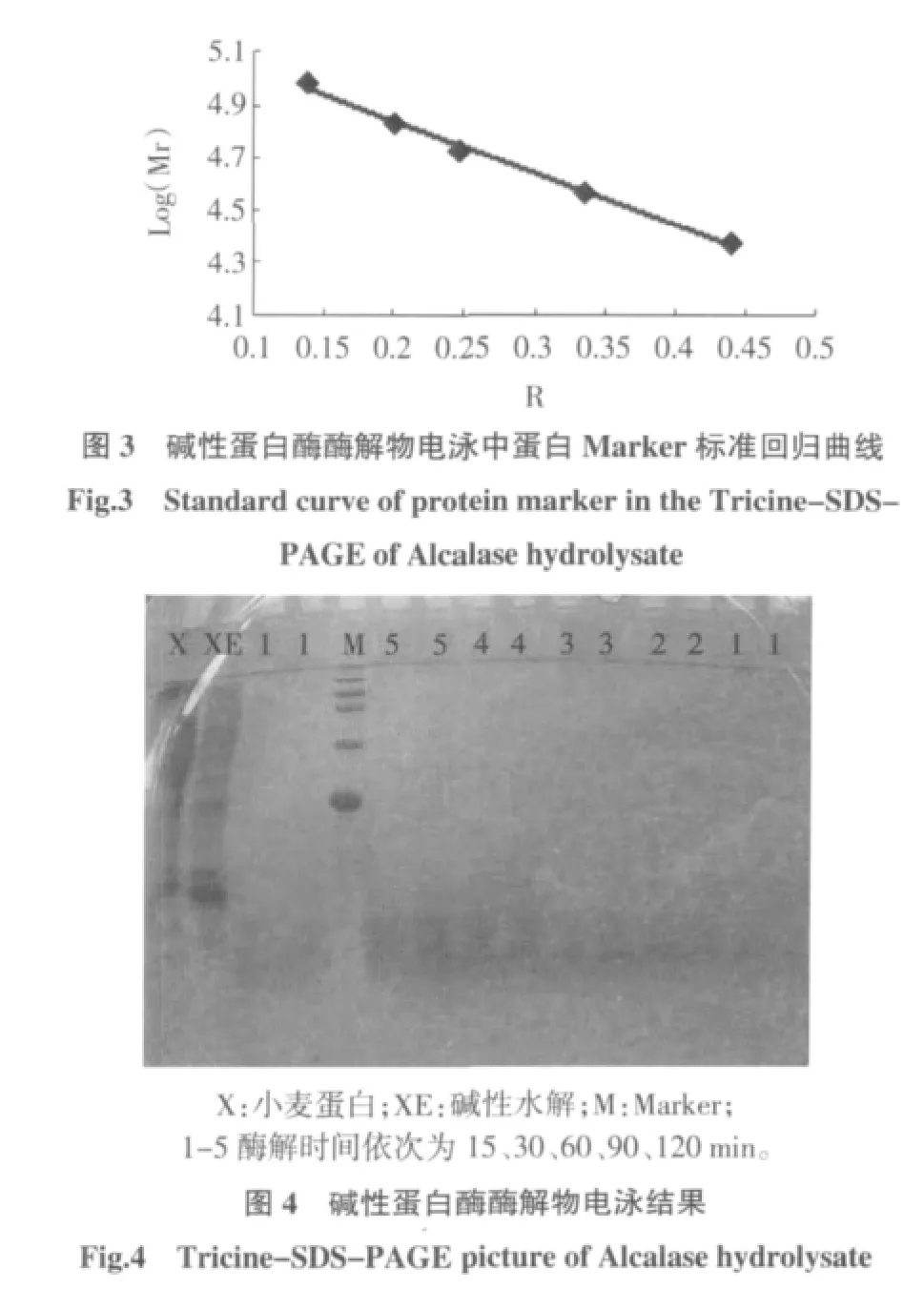
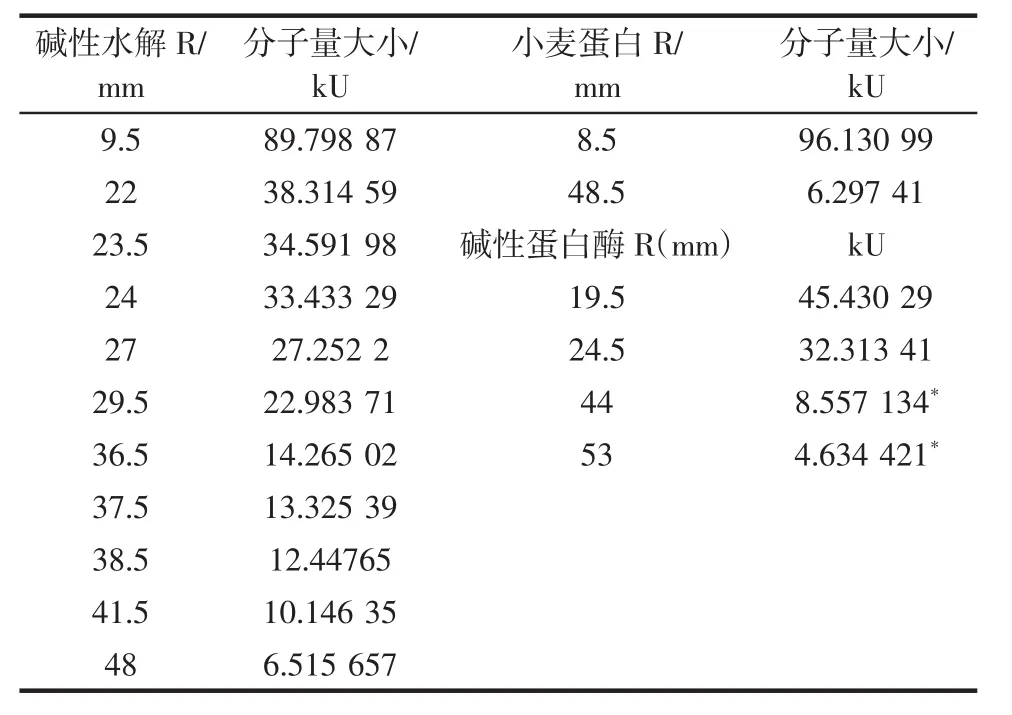
表3 小麦蛋白碱性蛋白酶酶解物多肽分子量的分布Table 3 Result of electrophoresis of Alcalase hydrolysis
由表3和图4可知,在单纯的碱性条件没有加入蛋白酶的情况下电泳发现,碱性变性促使一部分蛋白质发生降解,产生一些小分子量的物质,在6.52 kU~10.14 kU,条带清淡但分别连续;碱性水解产物在12.44 kU~14.26 kU有一部分,条带比较清晰显现;其水解成分主要集中在22.98 kU~27.25 kU附近,属于中分子量的物质;在33.43 kU~38.31 kU附近,有高分子量的多肽类物质产生;最条带的最顶端,有89.8 kU的大分子量的蛋白质的条带。与其相对照,小麦蛋白的分布比较连续,小分子量的条带不明显,主要集中分别在24 kU~96 kU之间。
小麦蛋白碱性蛋白酶酶解物电泳后的条带主要集中在4.63 kU~8.56 kU,随着酶解时间的延长,条带逐渐的加宽同时变的更加清晰;其他高分子量酶解物分布条带颜色较淡,比较模糊,可以肯定是呈连续分布的;在顶端可以看到32.3、45.4 kU两条较淡的条带,应该属于大分子量的物质。
3 讨论与结果
3.1 Tricine-SDS-PAGE 电泳方法的改良
利用SDS-PAGP电泳测定低分子蛋白多肽物质的分子量,必须要控制凝胶孔径的大小,Schagger等[18]使用浓缩胶,增加缓冲液的摩尔浓度,并且用Tricine代替甘氨酸作为终止离子,这样便可在1 kU~100 kU得到线性关系,Swank等增加甲叉双丙烯酞胺的浓度以及在SDS的凝胶中加8 mol/L尿素,能使测定的分子量值接近于预期值;石继红等[16]在凝胶中加入6mol/L尿素,分子量在2.512 kU~16.949 kU之间的小肽,其分子量对数和迁移率旱良好的线性关系。
本试验在用Tricine代替甘氨酸作为尾随离子,增加浓缩胶中小肽的浓缩效果,并在分离胶中加36.5%尿素,降低聚丙烯酰胺凝胶孔径的大小,取得了较好的效果,在3张胶片中,标准蛋自质分子量的对数和其迁移距离都呈良好的线性关系(r>0.99),并计算出3张胶片中原料蛋自质和酶解产物中相同的小肽的分子量,大小的误差都在允许范围之内。Tricine-SDSPAGE系统是分离小分子肽的简便有效的方法,其中,分离胶中丙烯酰胺和双丙烯酰胺的比例和浓度是影响分离效果的重要因素。而尿素能明显改善对小分子肽的分离效果。另外,尿素胶的聚合速度也是一个重要因素,在制胶时,宜采用低浓度新鲜配置的AP和TEMED,使凝胶慢速聚合,才能获得好的分离效果。此外,快速的固定、染色和脱色对于小分子多肽电泳是必要的。这主要是因为小分子多肽对染料的结合力较弱,长时间的染色和脱色容易扩散冲洗掉而着色较差。随着生物活性多肽物质的发现和多肽类药物的研制,小分子多肽电泳变得越来越重要,己成为生物活性物质纯化分析过程中不可缺少、经常使用的快速鉴定方法。
3.2 Tricine-SDS-PAGE 电泳研究结果
1)小麦蛋白胃蛋白酶酶解物的分子量主要集中在3.83 kU~7.47 kU;条带分布清晰连续;随着时间的延长,在8.68 kU附近有淡色的条带出现;其次是在21.16 kU、34.3 kU附近,随着酶解程度的提高,出现了比较清晰的条带,应该属于蛋白质酶解物中分子量比较大的部分。
2)小麦蛋白碱性蛋白酶酶解物电泳后的条带主要集中在4.63 kU~8.56 kU,随着酶解时间的延长,条带逐渐的加宽;碱性水解产物在12.44 kU~14.26 kU有一部分,条带比较清晰显现;其水解成分主要集中在22.98 kU~27.25 kU附近,属于中分子量的物质;在33.43 kU~38.31 kU附近,有高分子量的多肽类物质产生;最条带的最顶端,有89.8 kU的大分子量的蛋白质的条带。
:
[1]何慧如,詹朝,马美蓉,等.碱处理面筋蛋白功能性之探讨[J].食品科学(台),1992,19(2):241-252
[2]王亚平,王金水,张伟红,等.乳糖改性提高谷朊粉乳化性研究[J].食品工业科技,2005,26(4):77-80
[3]钟昔阳,姜绍通.琥珀酰化度大小对改性小麦面粉性质影响的研究[J].食品科学,2005,26(9):123-127
[4]Felix H,Tuula H,Markku M,et al.Design,Synthesis,and Evaluation of Gluten Peptide Analogs as Selective Inhibitors of Human Tissue Transglutaminase[J].Chemistry&Biology,2003(10):225-231
[5]Matsui T,Li Chun-Hui,Osajima Y.Preparation and characterization of novel bioactive peptides responsible for angiotensin I-convertingenzymeinhibition from wheat germ[J].Journal of peptide science,1999,5(7):289-297
[6]张亚飞,乐国伟,施用晖,等.小麦蛋白Alcalase水解物免疫活性肽的研究[J].食品与机械,2006,22(3):44-47
[7]Zhu K X,Zhou H M,Qian H F.Antioxidant and free rad-ical scavenging activities of wheat germ protein hydroly-sates(WGPH)prepared with alcalase[J].Process Bio-chem,2006,41:1296-1302
[8]Jin-shui Wang,Mou-ming Zhao,Qiang-zhong Zhao,et al.Antioxidant properties of papain hydrolysates of wheatgluten in different oxidation systems[J].Food chemistry,2007,101(4):1658-1663
[9]程云辉,王璋,许时缨.酶解麦胚蛋白制备抗氧化肽的研究[J].食品科学,2006,27(6):147-151
[10]张锐昌,徐志宏,刘邻渭.酶解谷朊粉制备小麦肽的研究[J].食品研究与开发,2006,27(6):4-6
[11]张锐昌,徐志宏,刘邻渭.胃蛋白酶水解小麦蛋白工艺的研究[J].食品与机械,2006,22(1):59-61
[12]曹佐武.小分子肽的Tricine-SDS-PAGE分离方法[J].生物学通报,2003,38(3):55-56
[13]曹佐武.有效分离1kDa小肽Tricine-SDS-PAGE方法[J].中国生物工程杂志,2004,24(1):74-76
[14]汪建雄,隋秀芝,陈育晖,等.用SDS-PAGE电泳法测定小分子多肽分子量的研究[J].丝绸,2001(12):44-46
[15]詹玉春,刘文斌.用SDS-PAGE电泳测定豆粕酶解物中的低分子量多肽分子量[J].畜牧与兽医,2004,36(11):4-6
[16]石继红,赵水同,王俊楼,等.SDS-聚内烯酰胺凝胶电泳分析低分子多肽[J].第四军医人学学报,2000,21(6):761-763
[17]Popineau Y,Masson P,Thebaudin J Y.Enzymatic processing of wheat proteins[M].NewYork:Bioconversion of Cereal Products.VCH Publishers,1993:129-131
[18]Schagger H,von Jagow G.Tricine-sodium dodecyl sulfatepolyacrylamid gel electroporesis for the separation of proteins in the range from 1 to 100kDa[J].Analytical biochemistry,1987,166(2):368-379
