一株产α-葡萄糖苷酶菌株的鉴定和选育
2012-09-05吴孔阳齐宗献黄桂华曹喜秀李秋蓉陈桂光梁智群
吴孔阳,齐宗献,黄桂华,曹喜秀,李秋蓉,陈桂光,梁智群,*
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.广西大学生命科学与技术学院,广西南宁 530005)
α-葡萄糖苷酶(α-glucosidase,EC.3.2.l.20),又名α-D-葡萄糖苷水解酶或α-葡萄糖基转移酶,是自然界中普遍存在的一类酶,许多植物、动物、微生物等均能够产生。大多数α-葡萄糖苷酶可以水解麦芽糖并发生转苷作用。例如,黑曲霉α-葡萄糖苷酶能从麦芽糖等分子的非还原末端切开α-1,4糖苷键,释放出葡萄糖,并能将游离出的葡萄糖残基转移到另一个葡萄糖分子或麦芽糖等分子的α-1,6位,形成非发酵性的低聚异麦芽糖(主要成分包括异麦芽糖、潘糖、异麦芽三糖等)[1-2]。低聚异麦芽糖能使人体内的双歧杆菌得到显著增殖[3-4],促进食物的消化吸收,调整肠道内的菌群,增加有益菌的比例,维持肠道正常功能等。工业生产低聚异麦芽糖的关键酶制剂是α-葡萄糖苷酶[5-6]。国内生产低聚异麦芽糖用α-葡萄糖苷酶主要依赖于进口,研究主要集中在α-葡萄糖苷酶菌株选育、酶学性质及分子克隆表达等方面工作。本课题组在筛选海洋微生物的研究中,分离出一株具有较强产α-葡萄糖苷酶活性的菌株,对其进行了形态鉴定和26 S rDNA系统发育分析,并探讨了该菌株的生长特性,此外,本研究以该菌株为出发菌进行UV-LiCl复合诱变,筛选得到了1株α-葡萄糖苷酶产量显著提高的正突变株ZG36。
1 材料与方法
1.1 材料
1.1.1 海泥样品
从广西北海海边获取海泥。
1.1.2 培养基
平板初筛培养基(g/L):蛋白胨10,酵母膏2,甲基-α-D-吡喃葡萄糖苷 50,MgSO4·7H2O 0.5,KH2PO40.5,琼脂15,pH为自然条件下值。
麦芽汁斜面培养基(g/L):10Be'麦芽汁,琼脂20。
复筛培养基(g/L):麦芽糖100,蛋白胨10,酵母膏2,MgSO4·7H2O 0.5,KH2PO40.5,琼脂 15,pH 为自然条件下值。
发酵培养基:同复筛培养基。
YPD 培养基(g/L):麦芽糖 10,胰蛋白胨 5,酵母粉5。
形态特征和生理生化特征所用培养基参考生物学实验手册和酵母菌的特征与鉴定手册等相关资料[7-10]。
初始状态下公共负荷为100 Ω,线路电阻分别为8 Ω,5 Ω,2 Ω,0.8 Ω。I1,I2,I3,I4分别表示1#~4#变流器输出的直流电流;P1,P2,P3,P4分别表示1#~4#变流器输出的有功功率。由图6可看出,系统运行约0.3 s时,电流和有功功率分配误差逐渐减少达到均衡,0.8 s时公共负荷突然减少至50 Ω,1.6 s时又突然增加至70 Ω。根据本文提出的控制策略,系统在扰动后能迅速切换到新的工作运行点,实现了分布式电源间输出电流和输出功率的均匀分配,满足负荷可靠供电,系统稳定运行,验证了本控制方法的有效性。
1.1.3 菌株和主要试剂
酿酒酵母GXJ-1:由广西大学生命科学与技术学院食品与发酵工程研究所选育;DNA Marker:购自北京天根生化科技有限公司;rTaq酶:购自杭州博日科技有限公司;dNTP:购自TaKaRa公司;蛋白胨、酵母膏等:购自上海生工;甲基-α-D-吡喃葡萄糖苷、麦芽糖、异麦芽糖、潘糖等:均由Sigma公司生产;其他试剂均为国产分析纯。
1.1.4 仪器与设备
YP1200型电子天平:上海精科实业有限公司;J2-21高速冷冻离心机:美国beckman公司;Eppendorf 5418小型高速离心机:Eppendorf公司;HH-4数显恒温水浴锅:国桦电器有限公司;SPX-250型生化培养箱:上海跃进医疗仪器厂;回转式恒温调速摇床柜:上海欣蕊自动化设备有限公司;320 pH Meter:Meter Toledo公司;OLYMPUS数码显微镜:日本OLYMPUS;化学发光荧光凝胶成像系统:基因有限公司;Mini-PROTEIN 3 Cell电泳仪:Bio-Rad公司;岛津LC-10AT型高效液相色谱仪:日本岛津公司。
1.2 方法
1.2.1 菌株初筛与复筛
称取海泥5 g,放入盛有玻璃珠的95 mL无菌水的三角瓶中,轻轻混匀,打散样品后静置。用移液枪从三角瓶中吸取0.5 mL悬浊液注入盛有4.5 mL无菌水的试管中,以此类推,制成 10-2、10-3、10-4、10-5、10-6g/mL各种稀释度的菌液。用移液枪分别从10-4、10-5和10-6稀释度的试管中吸取0.1 mL涂到初筛培养基上,每个梯度3个平行。涂布平板后把平板倒置于培养箱中30℃培养84 h~96 h后,用已灭菌的牙签将平板上的单个菌落一一转接到含有初筛培养基的平板上,继续培养96 h,初步得到能够在初筛培养基中生长的菌株。挑取典型菌落进行纯培养,纯化后的菌株接种于麦芽汁斜面上保存。将初筛的菌株接种于含有50 mL复筛培养基的250 mL三角瓶中,在30℃、160 r/min的摇床中培养40 h。发酵结束后,离心去除菌体得到发酵上清液,并各取0.2 mL上清液,将其直接接入1.8 mL、已经培养13 h的酿酒酵母培养液中,继续于30℃、160 r/min的摇床中培养,以对照管中麦芽糖(浓度为10%)耗尽时为发酵终止点,此时,将各管取1 mL,离心得上清液,取上清液0.1 mL,加入0.4 mL去离子水,再加入0.5 mL DNS溶液,沸水浴中2 min后,补水至6 mL,于波长540 nm下测定吸光值,记录数据,同时选取吸光值较大的样品,将其对应的上清液稀释5倍后用0.45 μm水系微孔滤膜过滤,并进行高效液相色谱分析,检测低聚异麦芽糖的生成情况。
1.2.2 菌株的形态学观察和生理生化特征
参考生物学实验手册和酵母菌的特征与鉴定手册,进行形态学观察、糖发酵测试、碳源同化测试-液体培养法、淀粉化合物形成等试验。
1.2.5 分子生物学鉴定及系统发育树构建
采用SDS裂解法提取基因组DNA以及引物设计参考文献[11]。通过引物P1(5'-GCA TAT CAA TAA GCG GAGGAA AAG-3')和 P2(5'-GGT CCG TGT TTC AAG ACG G-3)进行PCR扩增供试菌株YX41 26S rDNA近5'端的D1/D2区域,引物由上海鼎安生物科技有限公司合成。PCR反应条件:94℃1 min;95℃30 s,53℃ 1 min,72℃ 1.5 min,30个循环。
PCR产物经纯化后送至上海鼎安生物科技有限公司测序。测得结果通过GenBank进行序列相似性搜索,然后采用Clustal X进行序列联配分析,系统发育分析通过软件MEGA4.0完成。
1.2.6 酶活测定及转苷产物分析
1.2.6.1 α-葡萄糖苷酶活力单位定义[12]
在40℃、pH5.0的条件下,每小时催化麦芽糖生成1 μmol非发酵性糖(异麦芽糖或潘糖)所对应的酶量定义为1个酶活力单位(U/mL)。
1.2.6.2 酶活测定方法及产物分析
取发酵液1 mL于2 mL EP管中,12 000 r/min条件下离心2 min,弃上清,用2倍体积的无菌水冲洗菌体,重复离心一次收集菌体。加入2 mL以pH5.0的磷酸二氢钠-柠檬酸缓冲液配制的10%(w/v)麦芽糖溶液,混均,40℃水浴1 h,取200 μL加入到1.8 mL已培养12 h酿酒酵母菌液中,于30℃,160 r/min,培养12 h,用DNS法测定其非发酵性糖。用岛津高效液相色谱仪及Kromasil NH2色谱柱测定转苷产物潘糖的生成量,色谱条件参照GB/T20881-2007,《低聚异麦芽糖》强制性国家标准中的检测方法。
1.2.7 YX41的诱变育种
取已培养10 h至对数生长期的伯顿毕赤酵母,梯度释稀至10-4,调整其浓度为106个/mL,同时将紫外灯预热20 min,取3 mL菌悬液置于直径90cm培养皿中,保持坏境无可见光,于紫外灯下(15 W,30 cm)分别照射 0、30、60、100、120、140、160、180、200 s。在红光的保护下,将照射后的菌液取0.1 mL涂布于含LiCl的平板,30℃避光培养3 d,观察、记录菌落生长状况。用平板菌落计数法进行活菌计数,计算致死率[13-14]。复合诱变时选择UV光源垂直距离为30 cm,功率15 W,照射60 s,取0.1 mL涂布于LiCl选择培养基平板上,黑暗中30℃恒温培养。30℃恒温培养3 d,再挑选较大菌落进行转化能力测定,进一步淘汰转化水平低的菌株。
2 结果与分析
2.1 菌株筛选
在菌株初筛的过程中,选用甲基-α-D-吡喃葡萄糖苷作为唯一碳源,能够快速筛选出产生α-葡萄糖苷酶的菌株,由于α-葡萄糖苷酶对底物的水解和转苷机制相对比较复杂[15],初筛得到的菌株,有水解能力,不一定具备转苷能力,即发酵产物可能得不到非发酵性糖,所以在菌株复筛的过程中,直接通过酿酒酵母利用残糖实验和高效液相色谱法检测非发酵性糖生成情况,初筛平板上分离得到236菌株,挑取典型菌落接入复筛培养基中进行复筛,最终得到一株α-葡萄糖苷酶活力稳定的野生菌株YX41。
2.2 形态特征
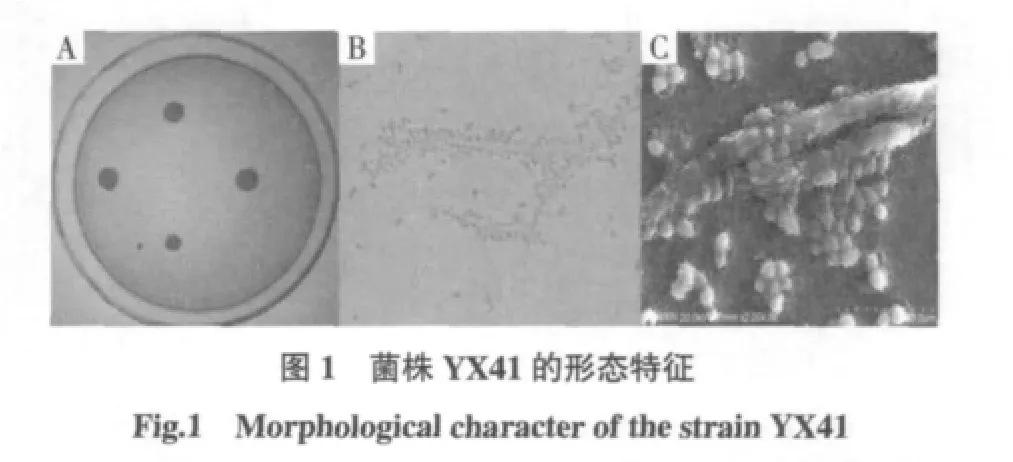
YX41菌株在YM平板、28℃培养72 h后,平板上的菌落呈乳白色,表面较干燥,且凹凸不平,周围有放射状毛刺,并向外扩张,如图1A所示。菌株在YM液体培养基里,肉眼能看到培养基中毛绒状菌丝体,显微镜观察到细胞呈椭圆形,卵形,柱形,有些具有菌环和醭膜,较多假丝中横交错。在显微镜下观察可看到细胞呈椭圆形,其颜色呈无色和黑色,有些表面可看到网眼。假菌丝呈藕节状,可看到隔膜如图1B所示。将载玻片上菌体固定并喷金后,在扫描电镜下观察其生长形态,可以很清楚看到菌体的微观结构,如图1C所示。
2.3 生理生化特性
糖发酵测试结果和碳源同化测试结果分别见表1和表2。

表1 糖发酵测试结果Table 1 The results of sugar fermentation

表2 碳源同化测试结果Table 2 The results of carbon assimilation
由表1可知,该菌不发酵乳糖。由表2可知,该菌能够同化山梨醇、麦芽糖、可溶性淀粉、L-阿拉伯糖、鼠李糖、D-木糖、葡萄糖、蔗糖、乙醇;不能同化乳糖、L-山梨糖、硝酸钾和肌醇。类淀粉物质测试结果表明,培养基由淡黄色透明状逐渐变成乳白色,外观与可溶性淀粉溶液非常相似。
2.4 菌株的分子生物学鉴定
Blastn分析结果显示菌株YX41的26 S rDNA序列与毕赤伯顿酵母具有较高的同源性,两者在以N-J法构建的系统发育树上聚为同一簇群(如图2)。根据及相关资料,结合形态学分析结果,将菌株YX41鉴定为毕赤伯顿酵母,命名为Pichia burtonii YX41。
2.5 菌株的转苷产物分析
将酶促转化反应液灭活后离心,上清用0.45 μm水系微孔滤膜过滤,然后进行高效液相色谱分析(见图3)。从高效液相色谱图可以发现,该酶的主要转苷产物是异麦芽糖和潘糖,潘糖含量较大。

2.6 菌株YX41诱变结果
YX41经过UV-LiCl复合诱变后获得的1株转化能力明显优于出发菌株的突变株,将其命名为ZG36,比出发菌株酶活力提高了32%。将菌株ZG36在斜面培养基上传代转接数次,摇瓶实验结果表明该菌株的产酶水平比较稳定,见表3。

表3 ZG36的遗传稳定性试验结果Table 3 The results of hereditary stability experiment
3 讨论
尽管微生物来源α-葡萄糖苷酶已有很多报道[16-17],但是有关海洋微生物产α-葡萄糖苷酶的研究报道较少。海洋蕴藏着丰富的微生物资源,通过本课题组建立的筛选模型[18],从海泥中分离一株α-葡萄糖苷酶活力较高的Pichia burtoniiYX41菌株,然后对该菌株进行UV-LiCl复合诱变,选育一株高产α-葡萄糖苷酶菌株 ZG36。从 Takeuchi、Naumoff及 Prodanovi'c等[19-21]诸多对酵母产淀粉酶系的研究来看,尚未见毕赤伯顿酵母产α-葡萄糖苷酶的报道,从摇瓶复筛结果发现,Pichia burtoniiYX41能够快速、高效地利用麦芽糖,较短的发酵周期积累低聚异麦芽糖,这也为制备低聚异麦芽糖提供了新的参考。
虽然本研究在选育方面取得了一定的效果,但是与实际应用还有一定的距离,本课题组长期从事α-葡萄糖苷酶菌株菌株选育工作,已经选育多种α-葡萄糖苷酶产生菌,基于此,后继研究将考虑双亲跨界融合技术,尝试与实验室保藏的另外一株α-葡萄糖苷酶产生菌株进行原生质体融合,以期获得产酶能力更强,更稳定的高产菌株;同时将对该菌株所产α-葡萄糖苷酶进行分离纯化,为该酶的分子生物学研究提供相应的参考。
:
[1]Duan K J,Sheu D C,Lin C T.Transglucosylation of a fungal α-glucosidase:The enzyme properties and correlation of isomaltooligosaccharide production[J].Ann N Y Acad Sci,1995,750:325-328
[2]McCleary B V,Gibson T S.Purification,properties,and industrial significance of transglucosidase fromAspergillus niger[J].Carbohydr Res,1989,185:147-162
[3]Kohmoto T.Dose-response test of isomaltooligosaccharides for increasing fecal bifidobacteria[J].Agric Biol Chem,1991,55(8):2157-2159
[4]Mäkeläinen H,Hasselwander O,Rautonen N,et al.Panose,a new prebiotic candidate[J].Lett Appl Microbiol,2009,49:666-672
[5]Kuriki T,Yanase M,Hiroki Takata,et al.A new way of producing isomaltooligosaccharide syrup by using the transglucosylation reaction of neopullulanase[J].Applied and environment microbiology,1994(4):953-959
[6]Jong W Y,Min G L,Seung K S.Continuous production of isomaltooligosaccharides from maltose syrup by immobilized cells of permeabilizedAureobasidium Puiiuians[J].Biotechnology letters,1994(11):1145-1150
[7]周德庆.微生物学实验手册 [M].上海:上海科学技术出版杜,1986:197-231
[8]BarneR J A,Payne R W,Yarrow D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版杜,1991:61
[9]李海峰.海洋酵母普鲁兰类酵母一种新型生淀粉酶生产和特殊研究[D].青岛:中国海洋大学博士学位论文,2007:48-60
[10]姜维,徐莹,刘文磊,等.生物吸附剂耐盐性鲁氏酵母培养基的优化[J].中国酿造,2010(7):32-36
[11]白逢彦,贾建华,梁慧燕.假丝酵母属疑难菌株大亚基rDNA D1/D2区域序列分析及其分类学意义[J].菌物系统,2002,21(1):27-32
[12]Sheu D C,Duan K J,Lin C T.Purification and characterization of αglucosidase fromAspergillus carbonarious[J].Biotechnology techniques,1994,8(7):515-520
[13]王啸,邱树毅,何腊平.UV-LiCl复合诱变深黄被孢霉选育多不饱和脂肪酸高产菌株[J].食品科学,2004,25(4):50-52
[14]魏娜,李柏林,杰欧,等.UV-LiCl复合诱变深黄被孢霉选育γ-亚麻酸突变株[J].食品科学,2006,27(12):201-203
[15]Duan K J,Sheu D C,Lin M T,et al.Reaction mechanism of isomaltooligosacchakides synthesis by α-glucosidase fromAspergillus carbonarious[J].Biotechnology letters,1994(11):1151-1156
[16]Ezeji T C,Wolf A,Bahl H.Isolation,characterization,and identification ofGeobacillus thermodenitrificansHRO10,an α-amylase and α-glucosidase producing thermophile[J].Canadian journal of microbiology,2005,51(8):685-693
[17]Coleri A,Cokmus C,Ozcan B,et al.Isolations of α-glucosidase-producing thermophilic bacilli from hot springs of Turkey[J].Microbiology,2009,78(1):56-66
[18]Chen G G,Li W,Zhang Y K,et al.A high-throughput method for screening ofAspergillus nigermutants with high transglycosylation activity by detecting non-fermentable reducing sugar[J].World journal of microbiology and biotechnology,2011,27(6):1519-1523
[19]Takeuchi A,Shimizu-Ibuka A,Nishiyama Y,et al.Purification and characterization of an α -Amylase ofPichia burtoniiIsolated from the Traditional Starter“Murcha”in Nepal[J].Bioscience,biotechnology and biochemistry,2006,70(12):3019-3024
[20]Naumoff D G,Naumov G I.Discovery of a novel family of α-glucosidase IMA genes in yeast Saccharomyces cerevisiae[J].Doklady biochemistry and biophysics,2010,432(1):114-116
[21]Prodanovi'c R,Milosavi'c N,Sladi'c D,et al.Transglucosylation of hydroquinone catalysed by α-glucosidase from baker's yeast[J].Journal of molecular catalysis B:enzymatic,2005,35:142-146
