多西他赛联合表柔比星新辅助治疗晚期乳腺癌的疗效分析
2012-09-05宋红梅桂金川方向东吴福道
宋红梅,桂金川,方向东,吴福道
(达州市中心医院肿瘤科,四川 达州 635000)
近年来在临床实践中,由于新辅助化疗能降低晚期乳腺癌临床分期,并能对晚期乳腺癌对化疗药物的敏感性做出客观评价,因而已被接受为晚期乳腺癌尤其是局部晚期乳腺癌的常规治疗措施[1]。目前比较认可的是多西他赛(DOC)或紫杉醇(PTX)联合表柔比星(EPI)3周方案[2],但是具体两种方案的临床受益情况暂时没有充分的临床研究探讨,因而本研究重点探讨两者分别与EPI联合3周方案在晚期乳腺癌新辅助治疗中的价值,现报道如下:
1 资料与方法
1.1 病例选择 选择2006年1月至2010年12月于我科住院的84例Ⅲ期乳腺癌患者为研究对象,平均(54.9±8.2)岁,中位年龄56岁,均为女性患者,未绝经患者38例,绝经后46例。所有患者经病理组织学或细胞学检查确诊为乳腺癌,其中浸润性导管癌73例,浸润性小叶癌5例,浸润性导管癌伴浸润性小叶癌4例,其他类型2例;ER(+)44例,ER(-)40例。排除标准:①合并严重心脑血管疾病、肝肾功能不全和造血系统疾病等;②接受过化放疗及内分泌治疗;③肿瘤患者生存质量评分(Karnofsky评分)小于70分;④预计生存期不足半年。
1.2 分组 按化疗方案不同分为:研究组41例,应用DOC联合EPI新辅助化疗方案(ED);对照组43例,应用PTX联合EPI化疗方案(EP)。两组的年龄、临床表现、病理类型等因素比较差异无统计学意义(P>0.05)。
1.3 化疗方案 研究组为ED方案:第1天,EPI(浙江海正药业股份有限公司)60 mg/m2,最大累积量不超过70 mg/m2;第1天,DOC(江苏恒瑞医药股份有限公司)75 mg/m2。对照组为EP方案:第1天,EPI 60 mg/m2;第1天,PTX(海南中化联合制药工业有限公司)135 mg/m2。两组病例均以21 d为一个疗程,治疗3~4个疗程后均行改良根治术或保乳手术,术后对新辅助化疗疗效进行分级评估。每次应用DOC和PTX前12 h常规予地塞米松预处理,DOC化疗同时服用地塞米松8 mg bid,连服3 d;PTX化疗前使用地塞米松、异丙嗪、西米替丁,化疗时均予托烷司琼止吐及免疫、护肝治疗,每周期化疗结束后常规予重组人粒细胞集落刺激因子(rhGM-CSF)100μg/d,连用3~5 d。
1.4 疗效评定标准 化疗后原发病灶的疗效根据UICC实体瘤疗效评定标准进行评估,其中肿瘤病灶的体积通过临床查体以及B超双径进行测量。①完全缓解(CR):化疗后肿瘤病灶完全消失;②部分缓解(PR):肿块体积缩小50%以上;③疾病稳定(SD):肿瘤体积化疗后减少≤50%或增加不足15%;④疾病进展(PD):肿瘤大小增加25%以上或出现新病灶。总有效率(OR)为CR+PR,病理完全缓解(pCR)为手术标本中无肿瘤病灶残留或仅有原位癌残留。
1.5 毒性反应的评估 两组患者分别应用ED方案、EP方案化疗后,观察记录毒性反应,如:胃肠道反应、白细胞下降、外周静脉炎、过敏性皮疹及脱发等,计算各自的发生率。
1.6 预后指标的评估 随访1年后,评价两组患者的预后指标,即复发率及生存率。
1.7 统计学方法 应用SPSS 15.0统计软件,计量资料以组间t检验,计数资料以χ2检验进行检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床疗效分析 研究组的部分缓解率(PR)、总有效率(OR)较对照组明显升高,分别为 51.22%vs 41.86%(P=0.0265)、90.24%vs 79.06%(P=0.0301);而临床完全缓解率(cCR)、病理完全缓解率(pCR)与对照组比较差异无统计学意义,分别为39.02%vs 37.20%(P=0.1661)、12.20%vs 13.95%(P=0.0718)(见表 1)。
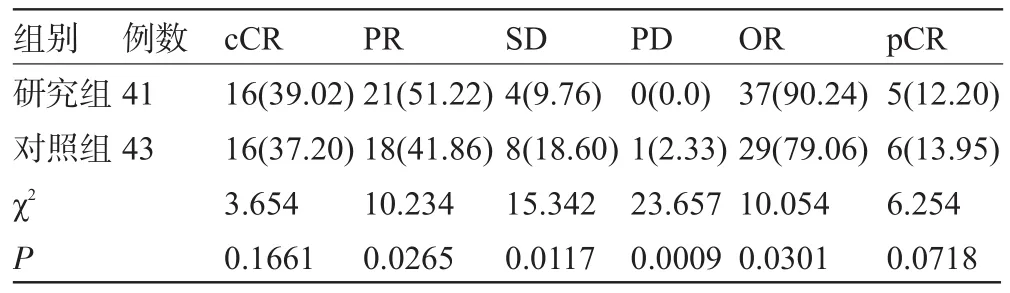
表1 两组化疗疗效比较[例(%)]
2.2 两组毒性反应的评估 研究组的胃肠反应、白细胞下降、外周静脉炎的发生率较对照组减少,分别为19.51%vs 25.58%(P=0.0396)、17.07%vs 23.26%(P=0.0324)、12.19%vs 18.60%(P=0.0337);而过敏性皮疹及脱发的发生率与对照组差异无统计学意义,分 别 为 14.63%vs 13.95%(P=0.2541)、19.51%vs 20.93%(P=0.3017)(见表2)。
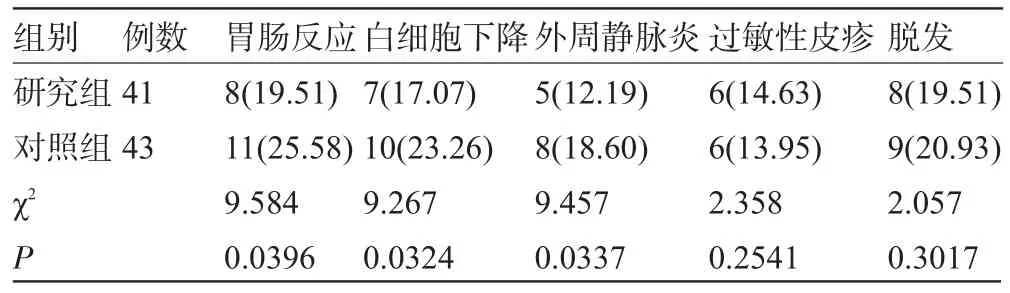
表2 两组毒性反应的评估[例(%)]
2.3 两组预后指标的评估 随访一年后,研究组的复发率明显低于对照组,为12.19%(5/41)vs 18.60%(8/43)(P=0.0287),而生存率明显高于对照组,为17.07%(7/41)vs9.30%(4/43)(P=0.0037)。
3 讨论
临床证实,晚期乳腺癌转移是导致患者死亡的主要原因,因而近年来临床实践中有学者提出应尽早在肿瘤确诊后应用辅助化疗,即新辅助化疗,认为其能够降低乳腺癌临床期、分级,控制全身的亚临床转移灶,增加可乳腺癌手术治疗的保乳率,而且能够了解肿瘤细胞对化疗药物的敏感性,为术后进一步化疗提供临床依据,并且能够改善患者的预后,因而新辅助化疗目前已成为晚期乳腺癌的标准治疗方法[3]。紫杉醇类联合蒽环类药物的化疗方案已广泛应用于晚期乳腺癌的新辅助治疗中,并显示出较高的临床疗效和预后效益[4]。
多西他赛属紫杉烷类药物,是紫杉醇类药物的衍生物,能通过干扰细胞骨架的合成分解,从而抑制肿瘤细胞的分化,其抑制微管解聚解的作用也比紫杉醇大两倍,并且水溶性也较紫杉醇强[5]。表柔比星是近年来临床使用广泛的细胞周期非特异性蒽环类抗癌药物,主要机制是直接嵌入细胞的DNA碱基对之间,干扰mRNA形成,抑制DNA和RNA的合成,且与多柔比星(阿霉素)相比,其心脏毒性明显降低,是治疗晚期乳腺癌较为理想的药物[6]。因而多西他赛与表柔比星联合是目前应用最为广泛的晚期乳腺癌新辅助化疗方案[7],但目前对于此类方案临床疗效、毒性反应以及预后分析的临床研究尚不充分,特别是与紫杉醇联合表柔比星治疗方案的临床疗效相比较国内研究较为少见。故本研究以此为研究出发点,对比这两种化疗方案的临床疗效、毒性反应以及预后,以对晚期乳腺癌新辅助化疗方案选择提供临床证据。
从结果可知,与紫杉醇联合表柔比星治疗方案比较,多西他赛与表柔比星联合新辅助化疗方案能提高晚期乳腺癌患者部分缓解率与总有效率,但是临床完全缓解与病理完全缓解无明显差异,表明多西他赛与表柔比星联合的临床疗效优于紫杉醇与表柔比星联合,但对晚期乳腺癌的缓解程度无优势。多西他赛与表柔比星联合的胃肠反应、白细胞下降、外周静脉炎等毒性反应的发生率较紫杉醇与表柔比星联合小,而过敏性皮疹及脱发的发生率无差别,表明多西他赛与表柔比星联合的毒性反应发生率低,较紫杉醇与表柔比星联合有优势。两组患者随访一年后多西他赛与表柔比星联合的复发率低而生存率高,显示有较好的预后获益。但本研究是单中心小样本的临床研究,研究结果尚需要多中心大样本的研究支持与证实。
[1]林本耀.乳腺癌[M].北京:中国医药科技出版社,2006:263-264.
[2]张 斌.乳腺癌的新辅助化疗[J].中华肿瘤杂志,2003,25(3):209-211.
[3]Kaufmann M,Hortobagyi GN,Goldhirseh A,et a1.Recommendations from an international expert panel on the use of neoadjuvant(primary)systemic treatment of operable breast cancer:an update[J].JClin Oneol,2006,24(12):1940-1949.
[4]郭小毛,梅 欣,章 倩.局部晚期乳腺癌的治疗进展[J].中国癌症杂志,2006,16(6):409-416.
[5]Sarid D,Ron IG,Sperber F,et a1.Neoadjuvant treatment with paclitaxel and epirubicin in invasive breast cancer:a phaseⅡstudy[J].Clin Drug Investig,2006,26(12):691-701.
[6]Liedtke C,Mazouni C,Hess KR,et a1.Response to neoadjuvant therapy and long-term survival in patients witlI triple-negative breast cancer[J].JOlin Oncol,2008,26(8):1275-1281.
[7]Carey LA,Dces EC,Sawyer L,et a1.The triple negative paradox:primary tumor chemosensitivity of breast cancer subtypes[J].Clin Cancer Res,2007,13(14):2329-2334.
