奶牛αs-酪蛋白多克隆抗体的制备、纯化及鉴定
2012-09-04庞学燕王洪荣魏宗友王梦芝
庞学燕 季 昀 王洪荣 魏宗友 王梦芝
(扬州大学动物科学与技术学院,扬州 2 25009)
近年来,人们对乳品质的要求越来越高,乳蛋白作为衡量乳品质的重要指标,其合成的营养调控已成为奶牛营养学研究的热点。乳蛋白大部分是由奶牛乳腺上皮细胞从头合成和分泌的,80%的乳蛋白由酪蛋白组成,而牛乳中的酪蛋白主要由 αs- 酪蛋白(αs-casein)组成(45% ~ 55%)[1],因此研究调控αs-酪蛋白的合成具有重要意义。目前,检测牛乳或乳腺细胞合成分泌的酪蛋白最常用的方法主要包括酶联免疫(ELISA)法和免疫印迹(Western-blot)法,而这2种方法均需用到酪蛋白抗体,目前没有商品化的奶牛αs-酪蛋白抗体,因此本试验通过免疫新西兰兔来制备兔抗牛αs-酪蛋白多克隆抗体,旨在为研究奶牛αs-酪蛋白合成的调控提供有效的试验材料。为得到纯度较高、特异性较强的抗体,本试验通过饱和硫酸铵法和蛋白A树脂对抗血清进行2次纯化,纯化后得到的抗体用Western-blot法鉴定其与 αs-酪蛋白纯品及乳腺组织中αs-酪蛋白的有无特异性反应。
1 材料与方法
1.1 试验材料
试验材料包括αs-酪蛋白标准品(美国Sigma公司,纯度≥70%)、弗氏完全佐剂(美国Sigma公司)、弗氏不完全佐剂(美国Sigma公司)、蛋白A树脂(美国Genscript公司)、羊抗兔辣根过氧化物酶标记的免疫球蛋白G(IgG-HRP)(武汉博士德公司)、猪源明胶(美国Amresco公司)、二氨基联苯胺(DAB)显色剂(上海生工生物工程公司)、放射免疫沉淀测定(RIPA)裂解液(上海碧云天公司)、2,2-联喹啉 -4,4-二甲酸二钠(BCA)蛋白质浓度测定试剂盒(上海碧云天公司)。
1.2 试验动物及饲养
试验动物选用4只健康纯种新西兰大白兔(购自南京金陵种兔厂),饲养前对兔舍进行彻底清扫和消毒,采用单笼饲养,每日饲喂颗粒饲料(饲料中不含酪蛋白)3次,自由饮水。待兔适应饲养环境约1周后,耳缘静脉采血约1 mL,采用ELISA法测试其血清是否与αs-酪蛋白有反应性,无反应性的合格兔子按免疫程序进行免疫。
1.3 免疫程序
免疫程序见表1,每次免疫前将弗氏佐剂与αs-酪蛋白溶液按1∶1彻底混合乳化后,采用皮下多点注射法,每只兔注射1 mL乳化液(含800 μg αs-酪蛋白)。免疫结束后的第5~7天耳缘静脉采血,参考杨苗等[2]的ELISA法检测抗血清效价,效价达到1∶10 000时立即准备放血。

表1 αs-酪蛋白免疫程序Table 1 Immunizing schedule of αs-casein
1.4 抗血清的制备
放血采用颈动脉放血法,用1%戊巴比妥钠经兔耳缘静脉缓慢注射麻醉,使兔仰卧并固定,分离两侧颈总动脉,插管放血,待血凝结后,于3 000 r/min离心10 min,取上清分装后置-80℃冰箱中保存备用。
1.5 饱和硫酸铵纯化
饱和硫酸铵纯化参考张和平等[3]的方法,略有改动。取500 μL血清加入等体积的磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4),冰浴下逐滴加入250 μL饱和硫酸铵溶液,旋涡混匀,4℃静置30 min,4 ℃、4 000 r/min 离心 15 min,取上清液。在上清液中逐滴加入1 000 μL饱和硫酸铵溶液,旋涡混匀,4℃静置30 min,离心弃上清。沉淀用500 μL PBS溶解,在溶液中逐滴加入250 μL 饱和硫酸铵溶液,边加边搅拌,4℃静置30 min,4℃离心,保留沉淀。沉淀继续用PBS溶解,滴加饱和硫酸铵溶液,静置,离心,保留沉淀。将沉淀溶于PBS中,装入透析袋中4℃透析过夜。
1.6 蛋白A树脂纯化
向纯化柱中加入1 mL结合/洗涤缓冲液,将1 mL混匀的蛋白A树脂加入柱中,再向柱中加入5 mL结合/洗涤缓冲液以平衡柱子,流速约1 mL/min。将结合/洗涤缓冲液稀释后血清样本加入柱中,保持流出速度约为1 mL/min。用30 mL结合/洗涤缓冲液冲洗柱子并使缓冲液流出速度约2 mL/min,用15 mL洗脱缓冲液洗脱抗体,保持洗脱液流速约1 mL/min。将含有抗体的洗脱液收集到含平衡缓冲液的烧杯中以中和洗脱液pH至7.4。洗脱出来的抗体溶液装入透析袋中4℃透析过夜。
1.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定纯化后抗体纯度
配制12%的分离胶和5%的浓缩胶,取80 μL抗体样品与20 μL 5×上样缓冲液混匀,在沸水中煮沸5 min。每孔上样12 μL,电压调为80 V开始电泳,当指示染料进入分离胶后,将电压调至120 V,继续电泳直至染料抵达距分离胶下端约1 cm处停止电泳,固定液固定,考马斯亮蓝染色,脱色液脱色,直至条带清晰可辨,用凝胶成像系统拍照观察。
1.8 ELISA法检测纯化后抗体的效价
将 αs-酪蛋白标准品用包被液稀释至20 μg/mL,每孔 100 μL 包被酶标板过夜,并用PBS做阴性对照,用磷酸盐吐温缓冲液(PBST)洗涤3次,每次静置5 min后迅速倾去洗涤液。每孔中加入200 μL封闭液(1%猪源明胶),置37℃恒温箱1 h,洗涤,倾去液体。取不同稀释度的纯化后的抗体(1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400和1∶12 800),每个稀释度5个重复,37℃温育1 h,然后倾去液体,PBST洗涤,倾去液体。每孔加100 μL 按 1∶5 000 稀释的羊抗兔 IgG-HRP 抗体,37℃温育1 h,PBST反复洗涤,倾去液体。每孔加入100 μL底物溶液室温孵育15 min。每孔加入 100 μL 硫酸(H2SO4,2 mol/L),5 min 后在酶标仪上测定450 nm下的吸光度值。
1.9 Western-blot法鉴定纯化后抗体特异性
1.9.1 纯化后抗体与αs-酪蛋白纯品反应性鉴定
配制12%的分离胶和5%的浓缩胶对αs-酪蛋白溶液进行SAS-PADE,电泳结束后,根据预染蛋白质分子质量标准指示进行切胶,然后将蛋白质转移到聚偏氟乙烯(PVDF)膜上(60 V恒压2 h)。用3%猪源明胶室温封闭1.5 h,然后将抗体溶液按1∶1 600稀释后,室温孵育1.5 h,PBST洗膜,用羊抗兔IgG-HRP(1∶5 000稀释)室温孵育1.5 h,PBST洗膜,DAB显色剂显色,扫描观察结果。
1.9.2 纯化后抗体与奶牛乳腺组织αs-酪蛋白反应性鉴定
将从屠宰场采集的鲜活奶牛乳腺组织剪成细小碎片于-80℃冻存。鉴定时取出冻存的组织加液氮研磨并用RIPA裂解液将其充分裂解后,14 000×g离心5 min,移取上清液,用BCA法测定蛋白质浓度,SAS-PADE电泳,转膜,1抗、2抗杂交,DAB显色观察(详细条件同1.9.1)。
2 结果
2.1 αs-酪蛋白抗体纯度
SDS-PAGE结果(图1)显示,经过饱和硫酸铵法和蛋白A树脂2步纯化后得到的αs-酪蛋白抗体重链清晰可见,表明通过纯化得到了纯度较高的αs-酪蛋白抗体。
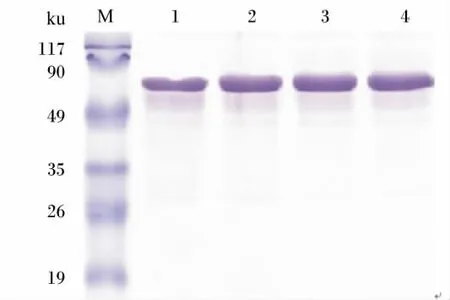
M:蛋白质分子质量标准 Protein molecular weight marker,1 ~4:αs- 酪蛋白抗体 Antibody against αs-casein。图1 SDS-PAGE鉴定αs-酪蛋白抗体纯度Fig.1 Identification of purity of antibody against αs-casein by SDS-PAGE
2.2 αs-酪蛋白抗体效价
经过纯化以后,ELISA法检测抗体的效价为1∶1 600。
2.3 αs-酪蛋白抗体特异性
Western-blot结果(图 2)显示,纯化后的抗体能够与αs-酪蛋白标准品专一性结合,表明得到的抗体能够特异性识别αs-酪蛋白。

图2 Western-blot法鉴定αs-酪蛋白抗体特异性Fig.2 Identification of specificity of antibody againstαs-casein by the method of Western-blot
Western-blot结果(图 3)显示,纯化后的抗体与奶牛乳腺组织中提取的αs-酪蛋白具有反应性,表明得到的抗体可以用于特异性检测奶牛乳腺组织αs-酪蛋白的含量。

图3 Western-blot法鉴定抗体与奶牛乳腺组织中提取的αs-酪蛋白的反应性Fig.3 Identification of reactivity of antibody against αs-casein extracted from bovine mammary gland tissues by the method of Western-blot
3 讨论
与制备抗体相比,制备抗血清无需进行纯化相对容易,国内学者李震等[4]、张涛等[5-6]相继成功制备了兔抗牛β-酪蛋白、αs-酪蛋白和κ-酪蛋白的抗血清,但由于未经纯化的抗体纯度不高,其他物质可能影响到抗体与抗原的作用,因此有必要对抗体进行纯化。常见的抗体纯化的有效方法包括离子交换层析法、盐析法和亲和层析法。离子交换层析法是利用蛋白质与离子交换树脂的选择性结合来达到分离纯化蛋白质的目的[7],Majidi等[8]利用 DEAE-Sepharose Fast Flow 柱进行离子交换层析得到了高纯度的兔抗牛IgG。盐析法主要是利用蛋白质在高浓度盐溶液中聚集形成沉淀的原理来进行纯化的[7],宋宏新等[9]用饱和硫酸铵分级沉淀法纯化了兔抗牛β-酪蛋白多克隆抗体,张和平等[3]对饱和硫酸铵法纯化血清中免疫球蛋白的条件进行了优化。饱和硫酸铵法具有方便、廉价、高效等优点,但该法纯化后的抗体纯度为75%~80%,而亲和层析法的纯化后的抗体纯度高达90%以上,该法是利用蛋白质与介质中的配基特异性结合的原理来分离纯化蛋白质的[7],蛋白A和蛋白G树脂是从细菌细胞壁中得到的能够特异性结合免疫球蛋白的介质,能够有效地分离提纯哺乳动物的多克隆抗体[10],杨苗等[2]用蛋白G树脂成功纯化了兔抗牛β-酪蛋白多克隆抗体,Vítková 等[11]用蛋白 A 树脂纯化了兔源多克隆抗体,并成功用于乳中α-酪蛋白、β-酪蛋白和κ-酪蛋白的检测。尽管蛋白A和蛋白G树脂纯化多克隆抗体得到的免疫球蛋白纯度较高,但这种树脂价格昂贵,而且多次反复使用后与免疫球蛋白的结合活性降低,基于此,为了提高蛋白A树脂的使用寿命,本试验先用饱和硫酸铵对抗体进行粗提纯后再用蛋白A树脂进行亲和层析纯化,最终得到了纯度较高的抗体,而且能够特异性与αs-酪蛋白发生抗原抗体结合反应,并成功用于鉴定奶牛乳腺组织中 αs-酪蛋白的合成。
随着动物营养学的发展,以组织、细胞为模型研究营养调控机理已逐渐成为热点,蛋白质和肽作为细胞内基因表达的产物,用免疫学方法鉴定这些产物常常要用到抗体,而商品化的抗体种类的不足往往难以满足所有科研的需求,因此,有必要建立一套系统、可靠的实验室制备抗体的方法来满足鉴定蛋白质、肽的需要。本试验成功制备了高纯度和特异性的兔抗牛αs-酪蛋白多克隆抗体,为进一步研究通过营养素调控奶牛αs-酪蛋白的合成提供了有效的试验材料。
4 结论
本试验通过免疫新西兰大白兔成功制备了纯度较高、特异性较强的兔抗牛αs-酪蛋白抗体,可以用于鉴定奶牛乳腺合成的αs-酪蛋白,为后续奶牛αs-酪蛋白合成调控的研究工作的开展奠定了基础。
[1] 秦宜德,邹思湘.乳蛋白的主要组分及其研究现状[J].生物学杂志,2003,20(2):5 -7.
[2] 杨苗,侯先志,杨银芬,等.牛β酪蛋白多克隆抗体的制备及鉴定[J].中国兽医科学,2010,40(11):1180-1183.
[3] 张和平,岳喜庆,冯巧萍,等.饱和硫酸铵法提取血清中IgG最佳条件的研究[J].中国乳品工业,2006,34(1):4 -8.
[4] 李震,陈永福.牛乳中β-酪蛋白检测的ELISA方法[J].山东农业大学学报,1999,30(4):451-452.
[5] 张涛,庞广昌.酶联免疫法快速测定原料乳中αs-酪蛋白质量浓度[J].中国乳品工业,2006,34(2):56-58.
[6] 张涛,庞广昌.酶联免疫法快速测定原料乳中κ-酪蛋白含量[J].食品工业科技,2006,27(11):179 -181.
[7] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:65-190.
[8] MAJIDI J,ABDOLALIZADEH J,AMIRKHIZ M B,et al.Production and purification of polyclonal antibody against bovine immunoglobulins in rabbits[J].African Journal of Biotechnology,2007,6(12):1369-1372.
[9] 宋宏新,韩燕,孟静.牛乳β-酪蛋白检测的间接ELISA 方法[J].食品科技,2008(8):213-215.
[10] HUSE K,BOHME H J,SCHOLZ G H.Purification of antibodies by affinity chromatography[J].Journal of Biochemistry Biophysical Methods,2002,51:217 -231.
[11] VÍTKOVÁM,RAUCH P,FUKAL L.Optimisation of indirect competitive ELISAs of α-,β-,and κ-caseins for the recognition of thermal and proteolytic treatment of milk and milk products[J].Czech Journal of Food Science,2002,20(2):53 -62.
