饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响
2012-09-04石桂城董晓慧谭北平迟淑艳杨奇慧刘泓宇
石桂城 董晓慧* 陈 刚 谭北平 迟淑艳杨奇慧 刘泓宇
(1.广东海洋大学水产学院水产动物营养与饲料实验室,湛江 5 24025;2.广东普通高等学校南海水产经济动物增养殖重点实验室,湛江 524025)
吉富罗非鱼(GIFT,Oreochromis niloticus)属鲈形目(Perciformes)丽鱼科(Cichlidae)罗非鱼属(Tilapia),属于热带暖水性鱼类,适宜在一年中水温较高的季节生长,适宜生长温度为20~35℃,其低温耐受能力比较弱,冬季严寒天气常常造成养殖生产上大量死亡。低温应激是鱼类养殖过程中经常面临的问题,人们一直在寻求有效的方法减轻低温应激对水产养殖所带来的危害。许多学者对鱼类在低温应激下血液指标的变化进行了研究,包括遮目鱼(Chanos chanos)[1]、鲤鱼(Cyprinus capio)[2]、大黄鱼(Pseudosciaena crocea)[3]、吉富罗非鱼[4]等。鱼类血液指标与机体自身的代谢、营养状况及疾病有着密切关系,当鱼体受到外界环境影响发生生理或病理变化时,血液生理生化指标往往能够反映鱼类在环境应激下的健康状况、营养状况及对环境的适应状况。应激情况下,鱼类必须调动机体内大量糖、脂肪和蛋白质等能量物质分解供能以抵抗应激,因此均衡充裕的营养是保证养殖动物健康生长和提高抵抗应激能力的关键。脂肪是鱼类体内重要的能源物质和主要的能量贮备形式,饲料中添加适量的脂肪可以改善饲料的适口性,提高鱼体的生长速率和饲料的利用效率[5-6],过多摄入脂肪则会使代谢系统紊乱,从而导致机体组织器官损害,影响生长[7-8]。饲料脂肪还能为养殖动物提供必需脂肪酸,而脂肪酸在预防和缓解应激负效应中起着重要作用,特别是二十二碳六烯酸(DHA)及大豆磷脂。相关研究表明,在真鲷(Pugrus major)[9]和黄盖鲽(Limanda yokohamae)[10]饲料中添加 DHA及大豆磷脂能有效减缓应激反应,增强机体抵抗应激的能力。到目前为止,国内外通过脂肪营养调控途径来调节鱼类低温应激下的生理代谢,调整鱼体脂肪酸组成,尤其在提高暖水性鱼类抵抗低温应激能力方面的研究报道较少。因此,本试验通过配制4种不同脂肪水平的饲料,旨在探讨饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血液指标及脂肪酸组成的影响,了解罗非鱼抵抗低温应激的生理代谢机制,为越冬罗非鱼饲料脂类的运用提供科学依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、棉籽粕、菜籽粕等为主要原料,通过添加0、4%、6%、8%的豆油制成脂肪水平分别为1.95%(F2组)、6.19%(F6 组)、8.03%(F8组)、9.95%(F10组)的4种试验饲料(表1),其脂肪酸组成见表2。将各种饲料原料粉碎过60目筛,按配方比例准确称重后混匀,少量组分采用逐级扩大法混合,然后加入豆油,搅拌机搅拌15 min,加入氯化胆碱和磷酸二氢钙,继续搅拌15 min,将搅拌好的饲料压制成粒径为3.0 mm的颗粒饲料,风干后用封口袋编号分装,-20℃冰箱保存备用。
1.2 试验动物及饲养管理
试验用吉富罗非鱼由广东海洋大学水产经济动物养殖实验室提供,养殖试验在广东海洋大学霞山校区第二实验楼可控温循环水族系统中进行。暂养时试验鱼投喂商品饲料(蛋白质水平为30%,脂肪水平为5%),暂养期2周。试验开始前鱼禁食24 h后,挑选规格一致、体格健壮的试验鱼[平均体重为(37.0±1.0)g]300尾,随机分为4组,每组3个重复,每个重复25尾鱼,以重复为单位放养于水族箱(长80 cm×宽45 cm×高45 cm)中。饲养试验持续8周,每天投喂2次(08:00和18:00),日投喂量为鱼体重的5%,每天记录投喂量和水温。养殖期间不间断充氧,水温(28±1)℃,溶氧 >6 mg/L,氨氮 <0.01 mg/L,pH 为7.2~7.6。
1.3 低温应激试验设计及样品采集
饲养试验结束后,统计生长指标,然后在养殖水温(28℃)条件下,每个重复随机取3尾鱼作为对照条件的样品分析,然后利用自动控温装置(HXSWT-301,大连汇新)以1℃/h的速率降至15℃,3 h后每个重复随机取3尾鱼作为应激条件的样品分析。低温应激期间不投喂。
采样时,将鱼捞起,用毛巾拭干体表水分,尾静脉采血,血样在4℃冰箱静置5 h后,4℃4 500 r/min离心15 min制备血清。血清放置于-20℃保存待分析。采血后解剖,取20 g左右肝脏放入封口袋后,立即放入-80℃冰箱中,备测脂肪酸组成。
1.4 测定指标及方法
1.4.1 生长性能
成活率(survival rate,SR,%)=100 ×试验结束时鱼尾数/试验开始时鱼尾数;
增重率(weigh gain rate,WGR,%)=100 ×(终末体重-初始体重+死亡体重)/初始体重;特定生长率(specific growth rate,SGR,%/d)=100×(ln终末体重-ln初始体重)/试验天数;饲料系数(feed conservation rate,FCR)=摄食量/
(终末体重-初始体重+死亡体重)。1.4.2 血清生化指标
血清生化指标用日立7600-110型全自动生化分析仪测定,测定指标包括血清葡萄糖(GLU)、总蛋白(TP)、甘油三酯(TG)、胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT)。
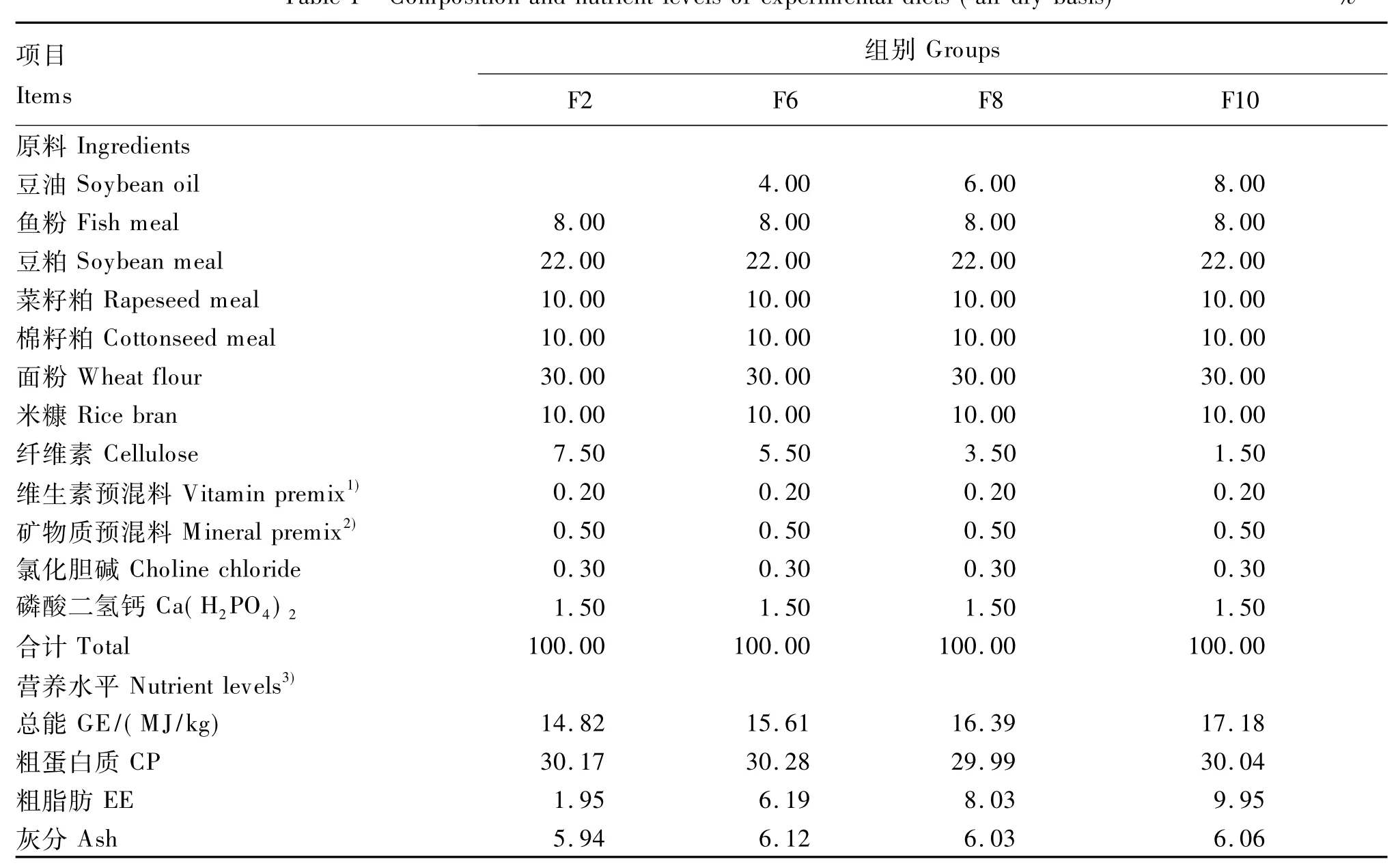
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1)维生素预混料可为每千克饲料提供The vitamin premix provided the following per kg of diets:VA 75 000 IU,VD33 000 IU,VE 120 mg,VC 75 mg,VK 15 mg,VB115 mg,VB27.5 mg,VB615 mg,VB120.075 mg,烟酸 nicotinic acid 180 mg,泛酸钙 calcium pantothenate 75 mg,叶酸 folic acid 7.5 mg,生物素 biotin 1.5 mg,肌醇 inositol 600 mg。
2)矿物质预混料可为每千克饲料提供The mineral premix provided the following per kg of diets:MgSO4·7H2O 126 mg,ZnSO4·7H2O 107 mg,KI 10 mg,FeSO4·7H2O 369 mg,CuSO4·5H2O 32 mg,MnSO4·H2O 74 mg,CoCl21 mg,Na2SeO33 mg,NaCl 52 mg。
3)总能为计算值,其余为实测值。GE was a calculated value,while others were measured values.1.4.3 肝脏脂肪酸组成
总脂肪提取参照Folch等[11]介绍的氯仿-甲醇法,脂肪甲酯化参考氢氧化钾-甲醇酯化法[12],方法略有改进,处理后含脂肪酸的甲酯溶液供色谱分析用。色谱分析条件:气相色谱仪为瓦里安430-GC,色谱柱为60 m ×0.25 mm ×0.2 μm(安捷伦HP-88);氢离子火焰检测器(FID)温度为260℃,进样口温度为260℃,分流比为30∶1;柱温程序升温,初始温度 140℃,维持 5 min,以5℃/min的速率升至240℃保持20 min;柱流量2 mL/min,线速度59.6 cm/min;载气为高纯氮气(25 mL/min);燃气为高纯氢气(30 mL/min)。以单种和混合标准脂肪酸甲酯(Sigma)进行定性分析,脂肪酸组成用面积归一化方法计算。
1.5 数据处理与统计分析
试验结果以平均值±标准差表示。试验数据用SPSS 16.0软件进行统计分析,先对数据进行单因素方差分析(one-way ANOVA),如有显著差异(P<0.05),则采用Duncan氏法进行多重比较。
2 结果
2.1 生长性能
由表3可知,F8组和F10组WGR及SGR均显著高于F2组(P<0.05),与F6组无显著差异(P>0.05)。饲料脂肪水平对SR、FCR无显著影响(P>0.05)。
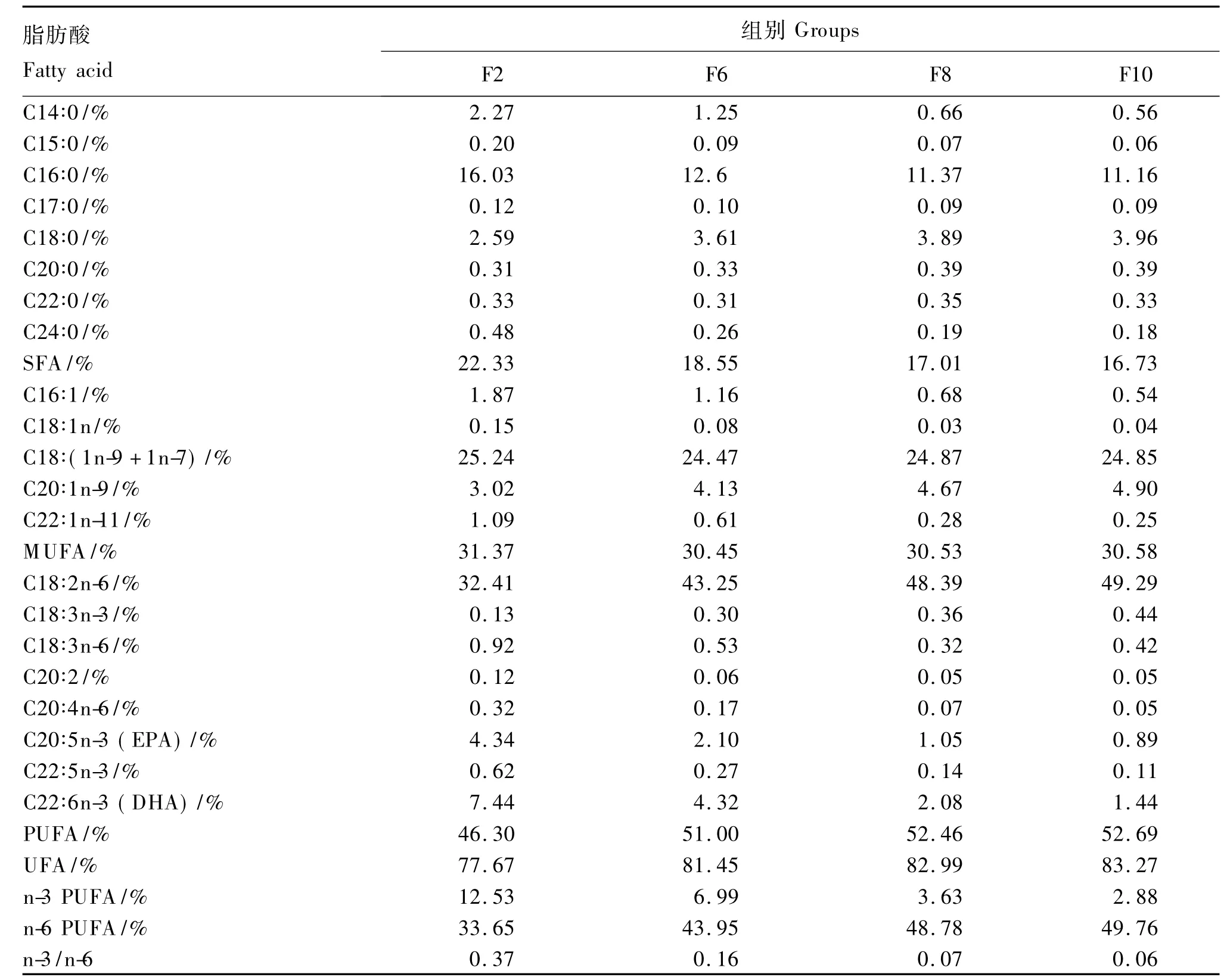
表2 试验饲料脂肪酸组成(相对比例)Table 2 Fatty acid composition of experimental diets(relative proportion)
SFA:饱和脂肪酸;MUFA:单不饱和脂肪酸;EPA:二十碳五烯酸;DHA:二十二碳六烯酸;PUFA:多不饱和脂肪酸;UFA:不饱和脂肪酸。表5同。
SFA:saturated fatty acid;MUFA:monounsaturated fatty acid;EPA:eicosapentaenoic acid;DHA:docosahexenoic acid;PUFA:polyunsaturated fatty acid;UFA:unsaturated fatty acid.The same as Table 5.
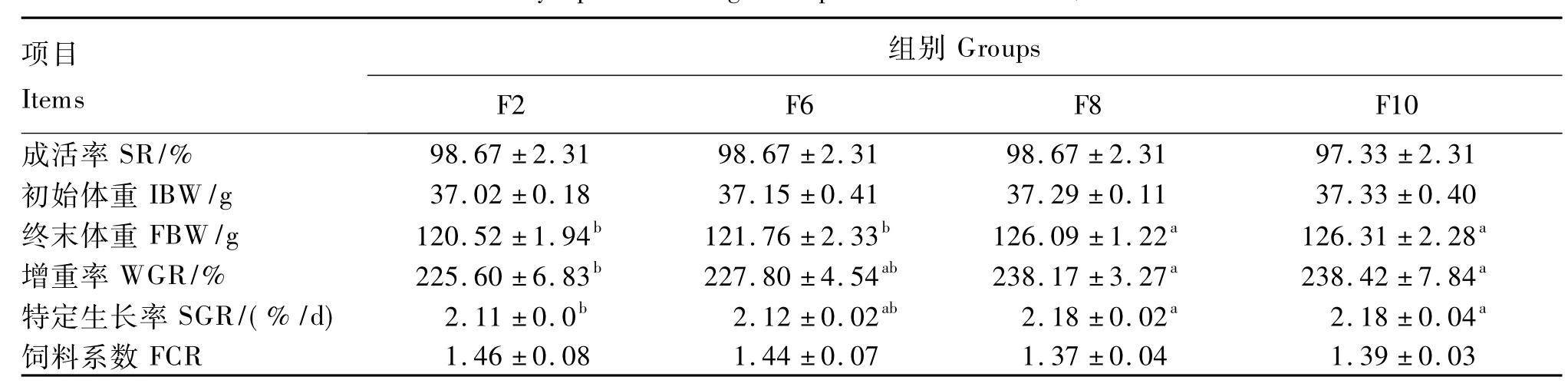
表3 饲料脂肪水平对吉富罗非鱼生长性能的影响Table 3 Effects of dietary lipid level on growth performance of GIFT,Oreochromis niloticus
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
In the same row,values with no letter or the same letter superscripts mean no significant difference(P>0.05),while with different small letter superscripts mean significant difference(P<0.05).
2.2 血清生化指标
28℃下不同处理间各指标的比较见表4。各血清生化指标除TG外均随饲料脂肪水平升高呈逐渐升高的趋势。F10组GLU水平显著高于F2组(P<0.05),其他各组间无显著差异(P>0.05)。F8组和F10组TP水平均显著高于F2组和F6组(P<0.05),且 F8组与 F10组、F2组与F6组间无显著差异(P>0.05)。CHOL水平除F6组和F8组间无显著差异(P>0.05)外,其他各组间均差异显著(P<0.05)。TG水平各组间无显著差异(P>0.05)。F10组HDL-C水平显著高于其他各组(P<0.05),其他各组间无显著差异(P>0.05)。F8组 LDL-C水平显著高于 F2组(P<0.05),其他各组间无显著差异(P>0.05)。F10组AST活性显著高于F2组和 F6组(P<0.05),F8组显著高于F2组(P<0.05),其他各组间无显著差异(P>0.05)。F8组和F10组ALT活性显著高于F2组和F6组(P<0.05),且F8组与F10组、F2组与 F6组间无显著差异(P>0.05)。
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同大写字母表示28℃下差异显著(P<0.05),不同小写字母表示15℃下差异显著(P<0.05),*表示同一处理不同温度下差异显著(P<0.05)。下表同。
In the same row,values with no letter or the same letter superscripts mean no significant difference(P>0.05),while with different capital letter superscripts mean significant difference at 28℃ (P<0.05),with different small letter superscripts mean significant difference at 15℃ (P<0.05),and with* superscripts mean significant difference under different temperatures with the same treatment(P<0.05).The same as below.
15℃下不同处理间各指标的比较见表4。TP、CHOL、TG、LDL-C 水平随着饲料脂肪水平升高有逐渐升高的趋势。GLU、TG水平各组间无显著差异(P>0.05)。F10组TP水平显著高于F2组和F6组(P<0.05),其他各组间无显著差异(P>0.05)。F10组CHOL水平显著高于F2组(P<0.05),其他各组间无显著差异(P>0.05)。F10组和F8组LDL-C水平显著高于F2组和F6组(P<0.05),且F8组与F10组、F2组与F6组间无显著差异(P>0.05)。HDL-C水平随着脂肪水平升高呈先升高后降低趋势。F6组HDL-C显著高于F10组和F2组(P<0.05),其他各组间无显著差异(P>0.05)。AST、ALT活性随着饲料脂肪水平升高先略微下降后逐渐升高。F10组AST活性显著高于F2组和F6组(P<0.05),其他各组间无显著差异(P>0.05)。F2组、F8组和 F10组ALT活性显著高于F6组(P<0.05),其他各组间无显著差异(P>0.05)。
2种温度下同一处理各指标的比较见表4。各组 GLU、TP、CHOL、TG、LDL-C 水平在 2 种温度下无显著差异(P>0.05)。F6组和F8组15℃下HDL-C水平显著高于28℃下(P<0.05),F2组和F10组HDL-C水平在2种温度下无显著差异(P>0.05)。各组15℃下AST、ALT活性均显著高于28℃下(P<0.05)。
2.3 肝脏脂肪酸组成
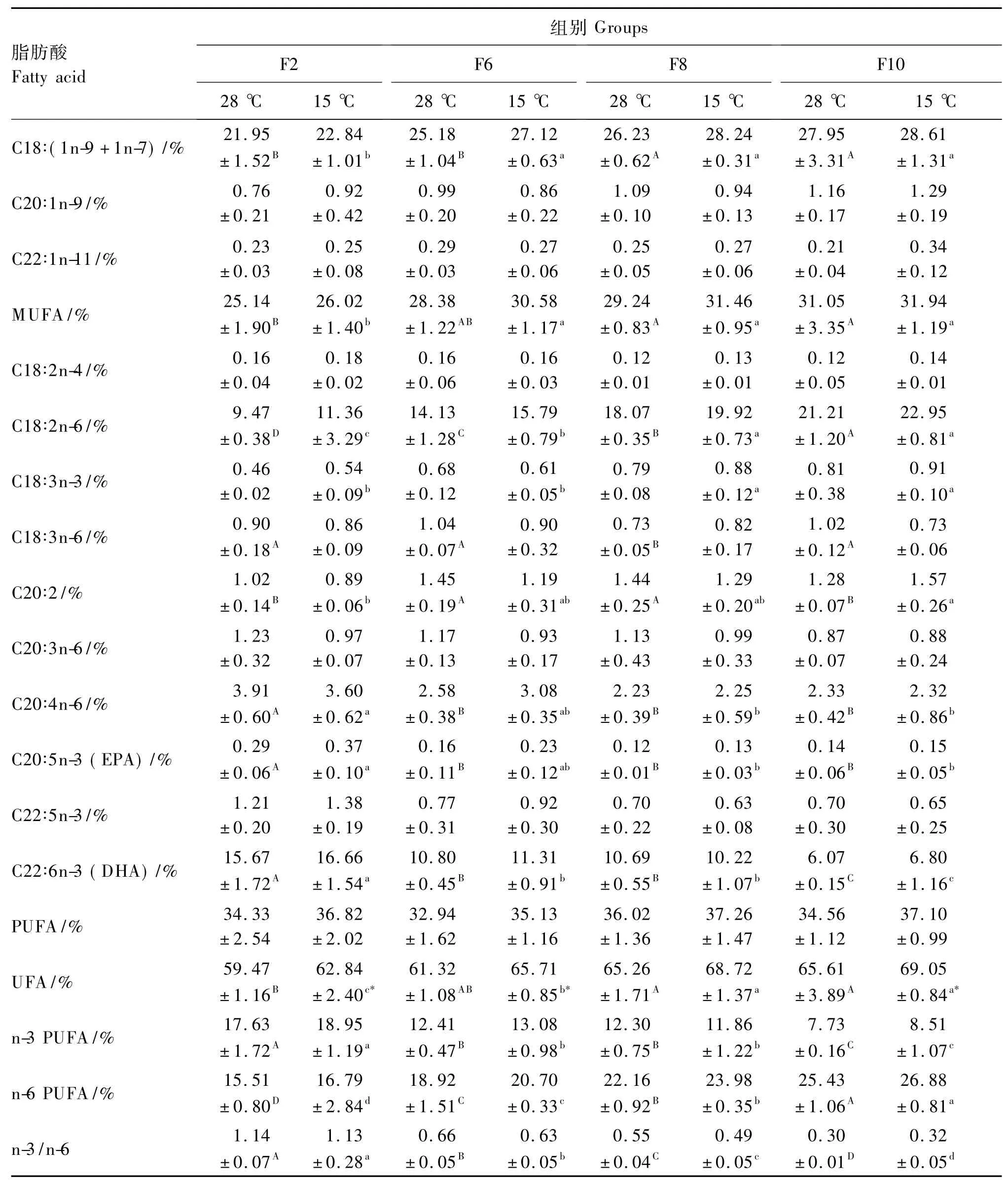
28℃下不同处理间肝脏脂肪酸组成的比较见表5。吉富罗非鱼肝脏脂肪酸组成与饲料脂肪酸组成具有较高的相关性。随着饲料脂肪水平升高,饱和脂肪酸(SFA)比例呈下降趋势,不饱和脂肪酸(UFA)比例呈上升趋势,与饲料中二者的变化规律相一致。F2组二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)比例显著高于F6组、F8组和F10组(P<0.05),F6组DHA比例显著高于F8组和F10组(P<0.05)。F2组单不饱和脂肪酸(MUFA)比例显著低于F10组和F8组(P<0.05),其他各组间无显著差异(P>0.05)。多不饱和脂肪酸(PUFA)比例各组间均无显著差异(P>0.05)。F2组n-3 PUFA比例显著高于其他各组(P<0.05),F6组和F8组显著高于F10组(P<0.05)。随着饲料脂肪水平升高,n-6 PUFA比例显著升高(P <0.05),n-3/n-6 显著降低(P <0.05)。

表5 饲料脂肪水平对吉富罗非鱼肝脏脂肪酸组成的影响(相对比例)Table 5 Effects of dietary lipid level on fatty acid composition in liver of GIFT,Oreochromis niloticus(relative proportion)
续表5
脂肪酸Fatty acid组别Groups F2 28℃ 15℃F6 28℃ 15℃F8 28℃ 15℃F10 28℃ 15℃C18∶(1n-9+1n-7)/% 21.95±1.52B 22.84±1.01b 25.18±1.04B 27.12±0.63a 26.23±0.62A 28.24±0.31a 27.95±3.31A 28.61±1.31a C20∶1n-9/% 0.76±0.21 0.92±0.42 0.99±0.20 0.86±0.22 1.09±0.10 0.94±0.13 1.16±0.17 1.29±0.19 C22∶1n-11/% 0.23±0.03 0.25±0.08 0.29±0.03 0.27±0.06 0.25±0.05 0.27±0.06 0.21±0.04 0.34±0.12 MUFA/% 25.14±1.90B 26.02±1.40b 28.38±1.22AB 30.58±1.17a 29.24±0.83A 31.46±0.95a 31.05±3.35A 31.94±1.19a C18∶2n-4/% 0.16±0.04 0.18±0.02 0.16±0.06 0.16±0.03 0.12±0.01 0.13±0.01 0.12±0.05 0.14±0.01 C18∶2n-6/% 9.47±0.38D 11.36±3.29c 14.13±1.28C 15.79±0.79b 18.07±0.35B 19.92±0.73a 21.21±1.20A 22.95±0.81a C18∶3n-3/% 0.46±0.02 0.54±0.09b 0.68±0.12 0.61±0.05b 0.79±0.08 0.88±0.12a 0.81±0.38 0.91±0.10a C18∶3n-6/% 0.90±0.18A 0.86±0.09 1.04±0.07A 0.90±0.32 0.73±0.05B 0.82±0.17 1.02±0.12A 0.73±0.06 C20∶2/% 1.02±0.14B 0.89±0.06b 1.45±0.19A 1.19±0.31ab 1.44±0.25A 1.29±0.20ab 1.28±0.07B 1.57±0.26a C20∶3n-6/% 1.23±0.32 0.97±0.07 1.17±0.13 0.93±0.17 1.13±0.43 0.99±0.33 0.87±0.07 0.88±0.24 C20∶4n-6/% 3.91±0.60A 3.60±0.62a 2.58±0.38B 3.08±0.35ab 2.23±0.39B 2.25±0.59b 2.33±0.42B 2.32±0.86b C20∶5n-3(EPA)/% 0.29±0.06A 0.37±0.10a 0.16±0.11B 0.23±0.12ab 0.12±0.01B 0.13±0.03b 0.14±0.06B 0.15±0.05b C22∶5n-3/% 1.21±0.20 1.38±0.19 0.77±0.31 0.92±0.30 0.70±0.22 0.63±0.08 0.70±0.30 0.65±0.25 C22∶6n-3(DHA)/% 15.67±1.72A 16.66±1.54a 10.80±0.45B 11.31±0.91b 10.69±0.55B 10.22±1.07b 6.07±0.15C 6.80±1.16c PUFA/% 34.33±2.54 36.82±2.02 32.94±1.62 35.13±1.16 36.02±1.36 37.26±1.47 34.56±1.12 37.10±0.99 UFA/% 59.47±1.16B 62.84±2.40c*61.32±1.08AB 65.71±0.85b*65.26±1.71A 68.72±1.37a 65.61±3.89A 69.05±0.84a*n-3 PUFA/% 17.63±1.72A 18.95±1.19a 12.41±0.47B 13.08±0.98b 12.30±0.75B 11.86±1.22b 7.73±0.16C 8.51±1.07c n-6 PUFA/% 15.51±0.80D 16.79±2.84d 18.92±1.51C 20.70±0.33c 22.16±0.92B 23.98±0.35b 25.43±1.06A 26.88±0.81a n-3/n-6 1.14±0.07A 1.13±0.28a 0.66±0.05B 0.63±0.05b 0.55±0.04C 0.49±0.05c 0.30±0.01D 0.32±0.05d
15℃下不同处理间肝脏中脂肪酸组成的比较见表5,低温应激下,吉富罗非鱼肝脏脂肪酸组成与饲料脂肪酸组成同样具有较高的相关性。随着饲料脂肪水平升高,SFA比例呈下降趋势,UFA比例呈上升趋势,与饲料中二者的变化规律相一致。F2组EPA显著高于F8组和F10组(P<0.05),其他各组间无显著差异(P>0.05)。F2组DHA比例显著高于F6组、F8组和F10组(P<0.05),F6组和F8组显著高于F10组(P<0.05),F6组与F8组间差异不显著(P>0.05)。F2组MUFA比例显著低于F6组、F8组和F10组(P<0.05),其他各组间无显著差异(P>0.05)。PUFA比例各组间均无显著差异(P>0.05)。F2组 n-3 PUFA比例显著高于其他各组(P<0.05),F6和F8组显著高于F10组(P<0.05),F6组与F8组间差异不显著(P>0.05)。随着饲料脂肪水平升高,n-6 PUFA 比例显著升高(P < 0.05),n-3/n-6 显著降低(P<0.05)。
2种温度下同一处理肝脏脂肪酸组成的比较见表5。F2组、F6组和F10组15℃下SFA比例显著低于28℃下(P<0.05),UFA比例显著高于28℃下(P<0.05),温度对其余脂肪酸比例均无显著影响(P>0.05)。F8组各种脂肪酸比例在2种温度下均无显著差异(P>0.05)。
3 讨论
3.1 饲料脂肪水平对吉富罗非鱼生长性能的影响
大量研究表明,通过在饲料中添加适量的脂肪可以改善饲料的适口性,提高鱼体的生长率和饲料的利用效率。庞思成[13]研究了饲料脂肪水平对尼罗罗非鱼(Oreochromis niloticus)生长的影响,结果表明,当添加3% ~5%的豆油,使饲料的总脂肪水平达到8.8%~10.7%时,尼罗罗非鱼生长最佳,饲料系数最低,蛋白质效率最高。Chou等[14]研 究 发 现,杂 交 罗 非 鱼 (Oreochromis niloticus×Oreochromis aureu)获得最大生长率的最适饲料脂肪水平为12%,而5%即能满足其最低需求。甘辉等[5]研究表明,随着饲料脂肪水平升高,奥尼罗非鱼幼鱼的增重率、肥满度和摄食量先上升后下降,而饲料系数则先下降后上升,饲料脂肪水平为4%时幼鱼的生长最好,肥满度最高,超过6%时罗非鱼幼鱼的各项生长指标下降,饲料系数上升。池作授等[8]通过对饲料脂肪添加水平和增重率的二次回归分析发现,饲料脂肪含量在10.98%时,奥尼罗非鱼仔稚鱼有最大的增重效果。韩光明等[6]研究发现,当饲料蛋白质水平为30%、脂肪水平为7.67%时,吉富罗非鱼的生长效果最佳,脂肪水平过低或过高均会导致吉富罗非鱼成活率及增重率下降。本研究结果表明,饲料脂肪水平对吉富罗非鱼的生长性能有显著影响,罗非鱼的增重率及特定生长率随饲料脂肪水平升高而升高,但当饲料脂肪水平达到6.19%时其增重率及特定生长率变化不再显著,这说明本试验条件下饲料脂肪水平达到6.19%时即可满足吉富罗非鱼最大生长需求。由此可见,罗非鱼对脂肪的需要量因品种或试验初始体重、环境等因素的不同而不同。
3.2 饲料脂肪水平对吉富罗非鱼血清生化指标的影响
鱼类血液生理生化指标与机体自身的代谢、营养状况及疾病有着密切关系,当鱼体受到外界环境影响发生生理或病理变化时,血液生理生化指标往往能够反映鱼类在环境应激下的健康状况、营养状况及对环境的适应状况。本试验中,低温应激下饲料脂肪水平对血清GLU水平没有产生显著影响,说明低温应激下罗非鱼的糖代谢没有受到脂肪水平的影响,可能是应激时间较短,罗非鱼体内糖原贮备充足,未出现能量供应不足而导致的血糖降低的现象[15]。Chatzifotis等[16]也指出,饲料脂肪水平不影响鱼类对GLU的利用,与本试验结果一致,但低温应激使各组血清GLU水平略有升高,说明低温下鱼类首先利用糖类作为能量来源,肝脏、肌肉组织将糖原分解为GLU,GLU进入血液供组织利用而使血糖升高。本试验中,血清TG水平随饲料脂肪水平升高而显著升高,可能是随着脂肪摄入的增加,鱼类肝脏代谢合成的TG相应升高,使得脂类代谢运输中的血脂水平升高所致,此结果与王爱民等[17]研究结果一致。低温应激下饲料脂肪水平对血清CHOL水平没有显著影响,但有随饲料脂肪水平升高而升高的趋势,说明低温下脂类的代谢速度加快,鱼类动员脂类释放能量以抵御低温应激。血液中的TP主要包括白蛋白及球蛋白,白蛋白的主要功能是维持血液中胶体的渗透压,而球蛋白主要参与脂类或脂溶性物质的运输以及机体免疫反应[18]。本试验发现,低温应激下血清TP水平随饲料脂肪水平升高而升高,其机制可能是脂肪进入血液后,参与血液物质代谢或产生反馈机制,从而改变血液渗透压,鱼体通过合成白蛋白来调节,而球蛋白运输脂类或脂溶性物质的功能可能会进一步影响鱼体免疫抵抗能力[17]。本试验中血清HDL-C水平随饲料脂肪水平升高呈先升高后降低的趋势,LDL-C水平的变化趋势与之相反。血清HDL-C水平升高说明肝脏合成的高密度脂蛋白增加并分泌到血液中,将TG从外周组织运输至肝脏进行代谢产能以抵抗低温应激,或合成胆汁酸排泄出体外,减少低温应激引起的脂质过氧化伤害[19]。当饲料脂肪水平过高时,血清HDL-C水平下降,这不利于TG的代谢产能或转运和清除,影响了肝脏的正常脂肪代谢;与此同时,血清LDL-C水平升高,其携带的TG进入血液中,过量的TG在血管壁堆积,容易形成动脉粥样硬化[20],对鱼体健康不利。本研究发现,吉富罗非鱼在低温应激下血清AST、ALT活性升高,且随着饲料脂肪水平升高其活性亦逐渐升高,提示过高的饲料脂肪水平可能会进一步加重低温应激下吉富罗非鱼肝脏或心肌细胞受损程度,导致细胞膜通透性增加,AST、ALT等酶渗入血液,使血液中这些酶的活性显著升高[21]。与此相似的是,在奥尼罗非鱼(Oreochromis aureus)[5]、鱼(Elopichthys bambusa)[22]及 红白锦鲤(Cyprinus capio)[23]的研究中均发现饲料脂肪水平升高会导致血液转氨酶活性升高,对鱼类机体组织造成损伤。
3.3 饲料脂肪水平对吉富罗非鱼肝脏脂肪酸组成的影响
在杂交罗非鱼[24]、鲈鱼(Atractoscion nobilis)[25]和吉富罗非鱼[6]的研究中发现,鱼体脂肪的脂肪酸组成明显受所摄食饲料脂肪酸组成模式的影响。本试验结果显示,吉富罗非鱼肝脏脂肪酸组成反映了饲料脂肪水平和脂肪酸组成,随着饲料脂肪水平升高,鱼体肝脏中SFA比例呈下降趋势,UFA比例呈上升趋势,与饲料中的变化规律具有较高的相关性。此外,结果还显示,当吉富罗非鱼受到低温应激时,肝脏组织中不同脂肪酸种类的比例变化明显,C16∶0及C18∶0等饱和脂肪酸比例明显下降,亚油酸(C18∶2n-6)、油酸[C18∶(1n-9+1n-7)]、花生四烯酸(C20∶4n-6)等主要不饱和脂肪酸比例明显升高。Hsieh等[26-27]研究发现,遮目鱼(Chanos chanos)、草鱼(Ctenopharyngodon idella)、杂交罗非鱼等鱼类的肝脏脂肪酸不饱和程度组成受水温影响,低温应激后鱼类肝脏的饱和脂肪酸比例减少,不饱和脂肪酸比例增加,有利于提高鱼类抵抗低温应激的能力。本试验中,饲料脂肪水平为1.95%和6.19%的组15℃下SFA比例显著低于28℃下,而UFA比例则显著高于28℃下,说明适当的饲料脂肪水平有利于吉富罗非鱼调整机体组织脂肪酸组成以应对外界环境应激,此结果进一步验证了上述观点。本试验添加的脂肪源为豆油,豆油中 C18∶2n-6比例高达54.97%。有 研 究 表 明,C18∶2n-6 及 亚 麻 酸(C18∶3n-3)是淡水鱼的必需脂肪酸,淡水鱼能将饲料中的 C18∶2n-6 或 C18∶3n-3 有效地转化为DHA、EPA 等高不饱和脂肪酸(HUFA)[28-29]。本试验结果表明,吉富罗非鱼肝脏中DHA、EPA比例远远高于饲料中二者的比例,说明吉富罗非鱼能有效地将 C18∶2n-6 或 C18∶3n-3 转化 DHA、EPA等HUFA,而DHA、EPA等HUFA在提高鱼类抵抗应激能力方面有重要作用,这在真鲷[9]和黄盖鲽[10]等鱼类中已有过报道。对4种鲤科鱼类的研究表明,越冬期间鱼体 UFA比例上升,其中 n-3 PUFA与越冬成活率关系极大,因此,在越冬前的配合饲料中增加n-3 PUFA,特别是 EPA和DHA的添加量,提高越冬前鱼体内的长链UFA比例,对鱼类越冬是有重要作用的[30]。但是,随着饲料脂肪水平升高,肝脏中EPA及DHA比例呈下降趋势,可能是当饲料中脂肪酸满足了鱼体的生长需求后,过多的 C18∶2n-6 或 C18∶3n-3 不再转化为EPA和DHA,而是直接被吸收,造成EPA及DHA在肝脏脂肪酸组成中相对比例下降。因此,在以植物油(豆油)为脂肪源的条件下若能适当添加动物油(鱼油)进行配比,则可以增加饲料中EPA和DHA等HUFA的比例,这有利于提高鱼类抵抗低温应激的能力。
4 结论
①适当的饲料脂肪水平(6.19%)能够促进吉富罗非鱼的生长,饲料脂肪水平高于6.19%后其生长性能不再显著增加。
②饲料脂肪水平影响吉富罗非鱼血清生化指标,适当的饲料脂肪水平(6.19%)能够改善脂肪代谢,有利于提高鱼类抵抗低温应激的能力;过高的饲料脂肪水平(8.03%及以上)可导致血清转氨酶活性升高,加重低温应激下鱼类代谢负担,甚至造成机体组织器官损害,不利于鱼体健康及生长。
③吉富罗非鱼肝脏脂肪酸组成与饲料脂肪酸组成具有较高相关性,鱼体肝脏SFA比例降低,UFA比例升高有利于提高鱼类抵抗低温应激的能力。
致谢
感谢广东海洋大学水产学院董晓慧教授对文稿所提的宝贵意见。
[1] HSIEH S L,CHEN Y N,KUO C M.Physiological re-sponses,desaturase activity,and fatty acid composition in milkfish(Chanos chanos)under cold stress[J].Aquaculture,2003,220:903 -918.
[2] 常玉梅,匡友谊,曹鼎臣,等.低温胁迫对鲤血液学和血清生化指标的影响[J].水产学报,2006,30(5):701-706.
[3] 冀德伟,李明云,王天柱,等.不同低温胁迫时间对大黄鱼血清生化指标的影响[J].水产科学,2009,28(1):1-4.
[4] 刘波,王美垚,谢骏,等.低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J].生态学报,2011,3(17):4866 -4873.
[5] 甘辉,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海海洋大学学报,2009,18(1):35 -41.
[6] 韩光明,王爱民,徐跑,等.饲料脂肪水平对吉富罗非鱼体脂沉积及脂肪酸组成的影响[J].中国水产科学,2011,18(2):338 -349.
[7] 李坚明,甘辉,冯广朋,等.饲料脂肪含量与奥尼罗非鱼幼鱼肝脏形态结构特征的相关性[J].南方水产,2008,4(5):37 -43.
[8] 池作授,耿旭,郭云学,等.奥尼罗非鱼仔稚饲料中适宜脂肪水平的研究[J].中国饲料,2010(4):32-36.
[9] 陈世杰.添加饲料营养以缓解真鲷仔鱼的应激反应[J].福建水产,1995(3):72 -73.
[10] KANAZAWA A.Effects of docosahexaenoic acid and phospholipids on stress tolerance of fish[J].Aquaculture,1997,155:129 -134.
[11] FOLCH J,LEES M,SLOANE-STANLEY G M.A simple method for the isolation and purification of total lipids from animal tissues[J].Journal of Biological Chemistry,1957,226:497 -509.
[12] 寇秀颖,于国萍.脂肪和脂肪酸甲酯化方法的研究[J].食品研究与开发,2005,26(2):46 -47.
[13] 庞思成.饲料中脂肪含量对罗非鱼生长的影响[J].饲料研究,1994(12):10-11.
[14] CHOU B S,SHIAU S Y.Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromis niloticus × Oreochromis aureus[J].Aquaculture,1996,143:185 -195.
[15] ZHOU M,WANG A L,XIAN J A.Variation of free amino acid and carbohydrate concentrations in white shrimp,Litopenaeus vannamei:effects of continuous cold stress[J].Aquaculture,2011,317:182 - 186.
[16] CHATZIFOTIS S,PANAGIOTIDOU M,PAPAIOANNOU N,et al.Effeet of dietary lipid levels on growth,feed utilization,body composition and serum metabolites of meager(Argyrosomus regius)juveniles[J].Aquaculture,2010,307:65 - 70.
[17] 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J].水生生物学报,2011,35(1):80 -87.
[18] 尾崎久雄.鱼类血液与循环生理[M].许学龙,熊国强,缪圣赐,译.上海:上海科学出版社,1982:116-120.
[19] FREDENRICH A,BAYER P.Reverse cholesterol transport,high density lipoproteins and HDL cholesterol:recent data[J].Diabetes & Metabolism,2003,29:201-205.
[20] 何志谦.人类营养学[M].2版.北京:人民卫生出版社,2000:123.
[21] 刘莉.动物生物化学[M].北京:中国农业出版社,2001:147.
[22] 赵巧娥.饲料脂肪水平对鱤幼鱼生长、血液生化指标及消化生理的影响[D].硕士学位论文.武汉:华中农业大学,2011:24-25.
[23] 崔培,姜志强,韩雨哲,等.饲料脂肪水平对红白锦鲤体色、生长及部分生理生化指标的影响[J].天津农学院学报,2011,18(2):23 -31.
[24] HUANG C H,HUANG M C,HOU P C.Effect of dietary lipids on fatty acid composition and lipid peroxidation in sarcoplasmic reticulum of hybrid tilapia,Oreochromis niloticus × O.aureus[J].Comparative Biochemistry and Physiology,1998,120:331 -336.
[25] LOPEZ L M,DURAZO E,VIANA M T,et al.Effect of dietary lipid levels on performance,body composition and fatty acid profile of juvenile white seabass,Atractoscion nobilis[J].Aquaculture,2009,289:101-105.
[26] HSIEH S L,KUO C M.Stearoyl-CoA desaturase expression and fatty acid composition in milkfish(Chanos chanos)and grass carp(Ctenopharyngodon idella)during cold acclimation[J].Comparative Biochemistry and Physiology,2005,141:95 -101.
[27] HSIEH S L,CHUN Y H,HSU Y T,et al.Influence of dietary lipids on the fatty acid composition and stearoyl-CoA desaturase expression in hybrid tilapia(Oreochromis niloticus×O.aureus)under cold shock[J].Comparative Biochemistry and Physiology:Part B,2007,147:438 -444.
[28] OLSEN R E,RINGO E.Lipids of Arctic charr,Salvelinus alpinus(L.)Ⅱ.Influence of dietary fatty acids on the elongation and desaturation of linoleic and linolenic[J].Fish Physiological Biochemistry,1992,9:393-399.
[29] YANG X,DICK T A.Arctic char(Salvelinus alpinus)and rainbow trout(Oncorynchus mykiss)differ in their growth and lipid metabolism in response to dietary polyunsaturated fatty acids[J].Canadian Journal of Fisheries and Aquatic Sciences,1994,51:1391 -1400.
[30] 童圣英.四种鲤科鱼类越冬时脂肪酸组成的变化[J].水产学报,1997,21(4):373-379.
