瘤胃保护性精氨酸及N-氨甲酰谷氨酸对细毛羊肠道黏膜蛋白质合成率的影响
2012-09-04赵宏丽孙海洲李金霞赵存发李胜利张春华
赵宏丽 孙海洲 李金霞 赵存发 桑 丹 李胜利 张春华
(1.内蒙古农牧业科学院动物营养研究所,呼和浩特 010031;2.内蒙古农业大学动物科学院,呼和浩特 010018;3.海拉尔农垦集团特泥河分公司,海拉尔 021024)
提高动物机体蛋白质的利用率是动物营养学者的主要目标之一。蛋白质利用率的提高不仅意味着可以降低饲养成本,而且可以减少碳氮排放起到保护环境的作用。与单胃动物相比,反刍动物氮的利用率只有20% ~30%,具有很大的提高潜力,因此提高反刍动物氮的利用率一直是动物营养研究者的重任之一。肠道作为氨基酸及蛋白质等营养物质吸收的最终场所,起到调节氨基酸进入门脉循环及血液的形式的作用[1],其结构的完整性以及功能的正常发挥对氨基酸代谢起着关键的作用[2]。与外周组织相比,肠道蛋白质合成占机体9% ~12%[3]。肠道不仅是机体重要的消化代谢吸收器官,也是很重要的免疫器官和防护屏障,参与机体的特异性免疫和非特异性免疫[4-5],同时其紧密连接的连续的单层上皮细胞构成一道隔离外界复杂环境的物理屏障[6]。
随着对氨基酸功能研究的不断深入,在啮齿类动物和单胃动物上研究发现,功能性氨基酸精氨酸(Arg)和亮氨酸作为肠上皮细胞哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的有效调节因子,可以促使肠道蛋白质合成,抑制蛋白质降解,从而促进肠黏膜上皮细胞增殖生长[7]。特别是Arg不仅参与蛋白质的合成,而且也是一氧化氮(NO)、尿素、多胺、鸟氨酸、脯氨酸、肌酸、谷氨酸盐和胍丁胺等重要生理活性物合成的主要前体物。其中NO在调节肠道的血流量及内分泌,维持肠道完整性和肠细胞迁移方面均发挥着重要的作用[8]。目前关于Arg对肠道生理功能方面的研究主要集中在单胃动物猪、鸡和啮齿类动物鼠上,已有报道指出Arg具有调节肠道及机体免疫力的功能[9-10],因此对肠道损伤也具有一定的治疗作用[11]。关于Arg的中间代谢产物N-乙酰谷氨酸(NAG)的类似物N-氨甲酰谷氨酸(NCG),目前在单胃动物仔猪上有报道表明,基础饲粮中添加0.08%的NCG可以提高日增重以及空肠、十二指肠、回肠的绒毛高度和隐窝深度,进而提高了肠道重量,同时提高了空肠和十二指肠的杯状细胞数量[12]。关于Arg及NCG在幼龄反刍动物上面的作用,李金霞[13]在2010年通过饲养试验在饲粮中添加瘤胃保护性Arg及NCG进行了相关的研究。本试验采用一次性大剂量灌注L-苯丙氨酸来研究瘤胃保护性Arg及NCG对羔羊肠道黏膜蛋白质合成率的影响。
1 材料与方法
1.1 试验动物
选用15只体况良好,平均体重为(25.00±3.39)kg的5月龄半同胞羯鄂尔多斯细毛羊,按体重随机分为5组,每组3只。
1.2 试验饲粮
试验基础饲粮配制参照NRC(2007)绵羊饲养标准,基础饲粮组成及营养水平参见表1。对照组饲喂基础饲粮(1组),试验组饲喂在基础饲粮中分别添加0.15 g/d NCG(2组)、0.20 g/d NCG(3组)、1.50 g/d Arg(4组)和 2.00 g/d Arg(5组)的试验饲粮。Arg及NCG分别购自北京优尼康生物科技有限公司和北京菲迪饲料科技有限责任公司。关于瘤胃保护性Arg和NCG的制备及稳定性检测参见李金霞[13]的方法。
1.3 饲养管理
试羊空腹称重后,安装集粪袋、集尿袋,放入代谢笼饲养,每日在06:00和18:00分别先粗后精等量饲喂2次,自由饮水。每日准确记录试验羊的采食量和剩草料量,预试期为15 d,正试期为45 d。
1.4 试验方法
每组分别选取1只羔羊,采用大剂量一次灌注法,测定肠道黏膜的蛋白质合成率。1.4.1 灌注液的制备
灌注剂量:按每千克代谢体重(kg W0.75)灌注0.2 g L-苯丙氨酸(其中含99%L-苯丙氨酸-D5,Cambridge Isotope Laboratory,美国)。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels ofthe basal diet(DM basis)
1)每千克预混料含有One kilogram of premix contained the following:VA 600 000IU,VD3120 000IU,VE 2 400 mg,Fe 9 000 mg,Cu 1 500 mg,Zn 9 000 mg,Mn 4 000 mg,I 90 mg。
2)干物质、粗蛋白质、钙、磷、中性洗涤纤维和酸性洗涤纤维为测定值,其他营养水平均为计算值。DM,CP,Ca,P,NDF and ADF were measured values,while the other nutrient levels were calculated values.
将所有羊只用的L-苯丙氨酸一次称好,按每只羊150 mL生理盐水溶解。用0.2 μm的滤膜过滤溶液,用真空泵或水泵可加速过滤。溶液高压灭菌15 min。高压灭菌后的溶液可置于室温过夜。在灌注的当天,将灌注液稍稍加热至约40℃,然后将灌注液吸入50 mL无菌注射器中,并放在40℃的培养箱内准备灌注。平均每只羊灌注150 mL灌注液。
1.4.2 颈静脉血插管的安装
于灌注L-苯丙氨酸前30 min在2侧颈静脉插入静脉滞留针,接上三通,其中一侧三通的另一侧接上静脉延长管,用于L-苯丙氨酸的灌注;另一个直接用于血液样本的采集。
1.4.3 灌注和采样
原因:钙剂作为骨骼重建所需要的一种原材料,当将其补充入体内后,首先需要人体能够将其吸收利用,而维生素D 或活性维生素D恰恰可以起到促进钙吸收的作用。
将试验羊于第16天08:00开始灌注L-苯丙氨酸,进行蛋白质周转的测定。
灌注前在预先刮好的皮肤上用普鲁卡因进行局部麻醉,用直径1 cm的环钻在该区域的后底缘采取2个皮肤组织样品,用作组织的本底样品(t0)。采下的样品用冰生理盐水冲洗,液氮冷冻,-80℃冷藏保存。
通过一侧颈静脉插管将L-苯丙氨酸灌注液缓慢注入,10 min内注完。注完后,用生理盐水冲洗插管。不能用该插管采集任何血液样品。
灌注前,从另一侧颈静脉插管采取血液样品作为0时间点样品。灌注开始后,分别在5(灌注中)、10(灌注后)、20、40、60、90 min 采取血样,每次采血5~10 mL。置于冰中保存,然后在4℃条件下2 000×g离心15 min,血浆样品 -20℃保存,供同位素苯丙氨酸分析。采完血样后,要用肝素-生理盐水冲血插管。
灌注90 min后,再用戊巴比妥钠麻醉,之后屠宰,防止肠道细胞死亡形成腐肉。
迅速放血屠宰。切开腹腔取出全部小肠,迅速置入含有双抗的冰冻磷酸盐缓冲液(PBS)中。剪开肠系膜,将肠段打开,将各肠断剪成5 cm的小段,将部分空肠和十二指肠剖开肠管,冰冻PBS冲洗干净后,用定性滤纸将黏膜表面的PBS吸干,用载玻片将肠黏膜轻轻地刮下来,分装后液氮保存,待测。准确记录组织样品的采样时间。
1.5 分析方法
1.5.1 血浆样品及组织样品的前处理
方法参考 Garlick 等[14]。
方法参考 Liu 等[15]。
1.6 计算方法
血浆游离氨基酸中示踪苯丙氨酸丰度(MPEp)等于采样期内各时间点血浆示踪苯丙氨酸丰度的加权平均值,公式如下:
MPEp=5×(MPE0+MPE5)/2+5×
(MPE5+MPE10)/2+10×(MPE10+
MPE20)/2+20×(MPE20+MPE40)/2+20×
(MPE40+MPE60)/2+30×(MPE60+
MPE90)/2-MPE0。
式中:MPE0、…、MPE90 分别为 0、…、90 min的血浆游离氨基酸中示踪苯丙氨酸丰度。
组织蛋白质合成率根据Lobley等[16]的公式计算。
蛋白质合成

式中:MPEt0和 MPEt分别为0(本底值)和90 min组织中蛋白质结合的示踪苯丙氨酸丰度。
1.7 数据统计与分析
采用SAS 9.0软件包中的ANOVA过程进行方差分析和F检验。
2 结果
由表2所示的各组蛋白质合成率来看,各试验组的空肠黏膜和十二指肠黏膜的蛋白质合成率与对照组比较差异均显著(P<0.05)。
对于空肠黏膜,各组的蛋白质合成率依次为:4组>3组>5组>2组>1组,与1组相比,4组、3组、5组和2组的空肠黏膜蛋白质合成率分别显著提高了 38.41%、31.37%、29.27%、17.48%(P<0.05),其中4组与其他各试验组差异显著(P<0.05),但3组与5组差异不显著(P>0.05)。
十二指肠黏膜蛋白质合成率依次为:4组>5组 >3组 >2组 >1组,与1组相比,4组、5组、3组和2组的十二指肠黏膜的蛋白质合成率分别显著提高了 35.18%、12.39%、9.51%、和 6.62%(P<0.05),4组与其他各试验组差异显著(P<0.05),3组与5组差异不显著(P>0.05),与空肠黏膜结果相一致,但2组与3组差异不显著(P>0.05)。
综合空肠黏膜和十二指肠黏膜的试验结果得出,3组、4组与5组对肠道黏膜蛋白质合成率提高幅度较大,其中以4组提高幅度最大,效果最好。
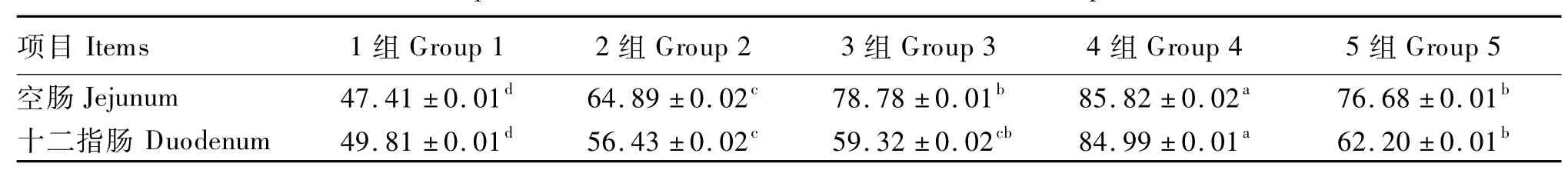
表2 瘤胃保护性Arg及NCG对细毛羊小肠黏膜蛋白质合成速率的影响Table 2 Effects of rumen protected arginine and N-carbamylglutamic acid on synthesis rate of protein in small intestinal mucosa of fine-wool sheep %/d
同行数据肩标不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。
In the same row,values with different small letter superscripts mean significant difference(P <0.05),while with the same small letter superscripts mean no significant difference(P>0.05).
3 讨论
小肠作为营养物质吸收的首要器官,对饲粮蛋白质和氨基酸的消化、吸收、代谢均起着重要的作用。有研究表明小肠是人和动物氨基酸代谢的主要场所,饲粮中30% ~50%的必需氨基酸首先被肠道所代谢[2],其每天的蛋白质合成率是周缘组织的数倍[17-18]。因此研究肠道对氨基酸不同代谢途径对于掌握机体氨基酸的利用率和蛋白质的需要量有着重要的意义。
表3涵盖了1987年至2007年应用稳定性同位素试验法得出的猪、鸡、牛和羊的肠道蛋白质合成率。这些究结果均表明,与外周组织相比,肠道的蛋白质合成率较高。本试验在5月龄羯鄂尔多斯细毛羊羔羊的基础饲粮中添加瘤胃保护性Arg及NCG得到的肠黏膜蛋白质合成率处于50%~90%。
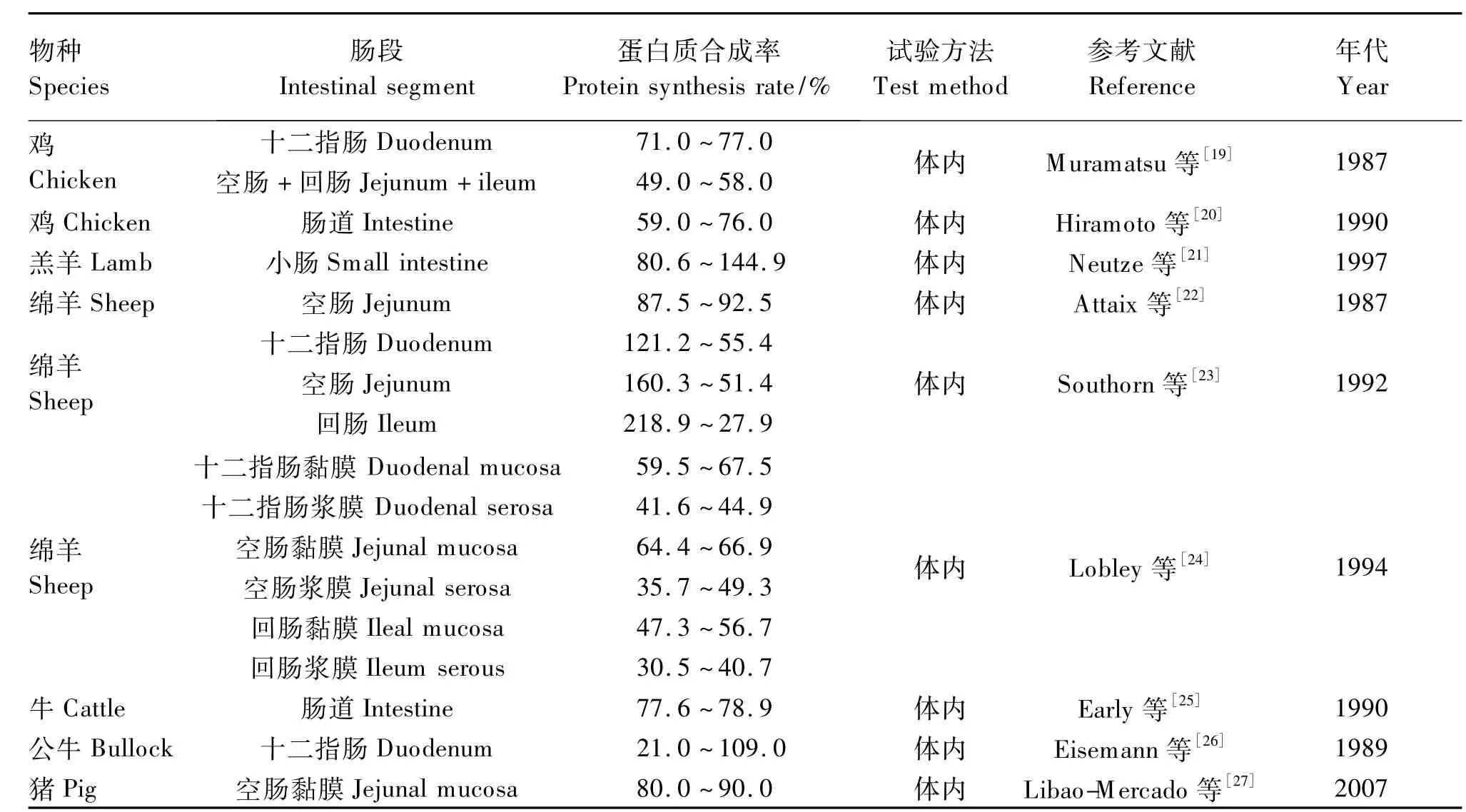
表3 畜禽肠道蛋白质合成率Table 3 Intestinal protein synthesis rate in livestock and poultry
肠道作为联系机体第1基因组(机体本身的基因组)与第2基因组(微生物基因组)的纽带,对于成年动物是Arg内源合成很关键的场所之一。存在于肠道的NAG合成酶和二氢化吡咯-5羧化酶(P5C)可以合成Arg的前体物瓜氨酸,瓜氨酸进入肾脏以后在精氨基琥珀酸合酶和裂解酶的催化下进一步合成机体所需的Arg[28-29]。但对于幼龄动物,Wu等[30]于2004年在仔猪上的报道指出,仔猪出生1~7日龄时,肠道的Arg琥珀酸合酶和裂解酶活性很高,瓜氨酸可以局部合成Arg来满足其生长需要,但14~21日龄时,肠道内2个关键性的酶活降低,Arg的内源合成受限必须通过饲粮供给得以满足。此外甄玉国等[31]在反刍动物绒山羊上发现小肠可吸收氨基酸的供应对组织蛋白质有着显著的影响作用,而反刍动物对蛋白质和氨基酸的利用有限,因此在饲粮中添加一些具有调节肠道功能的氨基酸具有一定的生理意义。而功能性氨基酸Arg与谷氨酰胺一样对肠道功能具有调节作用[32-33]。
本试验在羔羊饲粮中添加瘤胃保护性Arg及NAG的类似物NCG来探究其对反刍动物肠道蛋白质合成能力的作用,得到了较为理想的试验结果,为开拓Arg在反刍动物方面的应用提供参考。试验中采用的一次性大剂量灌注同位素示踪法克服了连续性灌注同位素法的游离氨基酸难以标记的缺陷以及传统氮代谢试验的不精确性。关于该法的优势和实用性Garlick等[14]在1980年进行了详尽的报道。
4 结论
添加瘤胃保护性Arg及NCG对肠道黏膜蛋白质合成率具有提高作用,分别以1.50 g/d Arg和0.20 g/d NCG 2个剂量较好。
[1] STOLL B,HENRY J,REEDS P J,et al.Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed piglets[J].The Journal of Nutrition,1998,128(3):606 -614.
[2] WU G.Intestinal mucosal amino acid catabolism[J].The Journal of Nutrition,1998,128(8):1249 -1252.
[3] REEDS P J,BURRIN D G,STOLL B,et al.Enteral glutamate is the preferential source for mucosal glutathione synthesis in fed piglets[J].American Journal of Physiology,1997,273(2):E408 - E415.
[4] FIELD C J,JOHNSON I R,SCHLEY P D.Nutrients and their role in host resistance to infection[J].Journal of Leukocyte Biology,2002,71(1):16 -32.
[5] VAN GOUDOEVER J B,VAN DER SCHOOR S R,STOLL B,et al.Intestinal amino acid metabolism in neonates[J].Nestlé Nutrition Institute Workshop Series,2006,58:95 -108.
[6] GEWIRTZ A T,LIU Y,SITARAMAN S V,et al.Intestinal epithelial pathobiology:past,present and future[J].Best Practice&Research Clinical Gastroenterology,2002,16(6):851 -867.
[7] BAN H,SHIGEMITSU K,YAMATSUJI T,et al.Arginine and leucine regulate p70S6 kinase and 4E-BP1 in intestinal epithelial cells[J].International Journal of Molecular Medicine,2004,13(4):537 -543.
[8] ALICAN I,KUBES P.A critical role for nitric oxide in intestinal barrier function and dysfunction[J].A-merican JournalofPhysiology,1996,270(2):G225-G237.
[9] TAN B,LI X G,KONG X,et al.Dietary L-argininesupplementation enhances the immune statusin earlyweaned piglets[J].Amino Acids,2009,37(2):323-331.
[10] KIDD M T,PEEBLES E D,WHITMARSH S K,et al.Growth and immunity of broiler chicks as affected by dietary arginine1[J].Poultry Science,2001,80(11):1535-1542.
[11] YULAN L,JING H,YONG Q H,et al.Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J].British Journal of Nutrition,2008,100(3):552-560.
[12] XIN W,ZHENG R,YUNLING G,et al.Dietary supplementation with L-arginine or N-carbamylglutama enhances intestinal growth and heat shock protein-70 expressio in weanling pigs fed a corn-and soybean meal-based diet[J].Amino Acids,2010,39(3):831-839.
[13] 李金霞.精氨酸及大豆油对细毛羊骨骼肌蛋白质合成和肌内脂肪含量变化的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011:1-96.
[14] GARLICK P J,MCNURLAN M A,PREEDY V R.A rapid and convenient technique of measuring the rate of protein synthesis in tissues by injection of[3H]phenylalanine[J].Biochemical Journal,1980,192(2):719-723.
[15] LIU S M,SMITH T L,BRIEGEL J,et al.Fractional protein synthesis rate and polyamine concentrations in tissues of Merino sheep selected for gastrointestinal nematode resistance[J].Livestock Science,2007,106(1):65-75.
[16] LOBLEY G E,HARRIS P M,SKENE P A,et al.Responses in tissue protein synthesis to sub and suvra-maintenance intake in young growing sheep:comparison of large-dose and continuous-infusion techniques[J].British Journal of Nutrition,1992,68(2):373 -388.
[17] BURRIN D G,SHULMAN R J,REEDS P J,et al.Porcine colostrum and milk stimulate visceral organ and skeletal muscle synthesis in neonatal piglets[J].The Journal of Nutrition,1992,122(6):1205 -1213.
[18] ATTAIX D,MANGHEBATI A,GRIZARD J,et al.Assessment of in vivo protein synthesis in lamb tissues with[3H]valine flooding doses[J].Biochimica et Biophysica Acta,1986,882(3):389 -397.
[19] MURAMATSU T,TAKASU O,FURUSE M,et al.Influence of the gut microflora on protein synthesis in tissues and in the whole body of chicks[J].Biochemical Journal,1987,246(2):475 - 479.
[20] HIRAMOTO K,MURAMATSU T,OKUMURA J.Protein synthesis in tissues and in the whole body of laying hens during egg formation[J].Poultry Science,1990,69(2):264 -269.
[21] NEUTZE S A,GOODEN J M,ODDY V H,et al.Measurement of protein turnover in the small testine of lambs.Ⅱ.Effects of feed intake[J].Journal of Agricultural Science,1997,128(2):233 -246.
[22] ATTAIX D,ARNL M.Protein synthesis and growth in the gastrointestinal tract of young preruminant lamb[J].British Journal of Nutrition,1987,58(1):159 -169.
[23] SOUTHORN B G,KELLY J M,MCBRIDE B W.Phenylalanine flooding dose pro-cedure is effective in measuring intestinal and liver protein synthesis in sheep[J].The Journal of Nutrition,1992,122(12):2398-2407.
[24] LOBLEY G E,CONNELL A,MILNE E,et al.Protein synthesis in splanchnic tissues of sheep offered two levels of intake[J].British Journal of Nutrition,1994,71(1):3-12.
[25] EARLY R J,MCBRIDE B W,BALL R O.Tissue energy expenditures growth and metabolism in somatotropin treated steers[J].Journal of Animal Science,1990,68(12):4153 -4166.
[26] EISEMANNA J H,HAMMONDA A C,RUMSEYA T S.Tissue protein synthesis and nucleic acid concentrations in steers treated with somatotropin[J].British Journal of Nutrition,1989,62(6):657 -671.
[27] LIBAO-MERCADO A J,ZHUA C L,FULLER M F,et al.Effect of feeding fermentable fiber on synthesis of total and mucosal protein in the intestine of the growing pig[J].Livestock Science,2007,109(1):125-128.
[28] WAKABAYASHI Y,YAMADA E,HASEGAWA T,et al.Enzymological evidence for the indispensability of small intestine in the synthesis of arginine from glutamate.Ⅰ.Pyrroline-5-carboxylate synthase[J].Archives of Biochemistry and Biophysics,1991,291(1):1-8.
[29] WU G.Synthesis of citrulline and arginine from proline in enterocytes of postnatal pigs[J].American Journal of Physiology,1997,272(6):G1382 -G1390.
[30] WU G,KNABLE D A,KIM S W.Arginine nutrition in neonatal pigs[J].The Journal of Nutrition,2004,134(10):2783s-2790s.
[31] 甄玉国,卢德勋,王洪荣.小肠可吸收氨基酸模式对内蒙古白绒山羊组织蛋白质周转的影响[J].畜牧兽医学报,2007,38(10):1047 -1053.
[32] JOBGEN W,FU W J,GAO H,et al.High fat feeding and dietary L-arginine supplementation differentially regulate gene expression in rat white adipose tissue[J].Amino Acids,2009,37(1):187 - 198.
[33] WANG J J,CHEN L X,LI P,et al.Gene expression is altered inpiglet small intestine by weaning and dietary glutamine supplementation[J].The Journal of Nutrition,2008,138(6):1025 -1032.
