壳寡糖对虹鳟生长性能、血清生化指标及非特异性免疫功能的影响
2012-09-04刘含亮孙敏敏王红卫万文菊王纪亭
刘含亮 孙敏敏 王红卫 万文菊 王纪亭*
(1.山东农业大学动物科技学院,泰安 271000;2.泰山医学院,泰安 271000)
开发利用具有无污染、无残留、不产生耐药性特点,同时可提高动物机体抵抗能力,预防动物疾病的绿色环保型促生长饲料添加剂已经成为饲料业发展的必然趋势。素有“人体第六生命要素”、“软黄金”之美誉的甲壳素(又称几丁质)广泛存在于海产品和丝状菌类中,但由于其不溶于水,在开发应用上受到了很大的限制。壳寡糖(又称寡聚氨基葡糖、甲壳低聚糖)由甲壳素脱乙酰化的产物壳聚糖降解获得,是由2~10个氨基葡萄糖通过β-1,4-糖苷键连接而成的低聚糖[1]。壳寡糖是天然糖中唯一大量存在的带正电荷的碱性氨基多糖,水溶性好,可通过动物肠道上皮细胞直接被吸收。壳寡糖以功能性食品形式早已应用于食品工业中,在畜牧业生产中也被作为新型的饲料添加剂广泛运用。王秀武等[2]报道,壳寡糖可抑制肉仔鸡肠道有害菌的增殖,促进微绒毛生长发育,提高免疫能力和生产性能。马利等[3]研究表明,饲料中添加壳寡糖能够促进南美白对虾的生长,降低机体脂肪和胆固醇沉积,维护各个器官功能的正常。虽然水产饲料中添加壳寡糖并运用于养殖过程的已有较多报道,但大多都局限于促生长效果的研究。作为低等的脊椎动物,鱼类主要依靠非特异性免疫系统来抵抗病原的入侵[4],非特异性免疫防御机制是鱼类抵抗病原的第1道屏障。本试验通过在饲料中添加不同剂量的壳寡糖,研究其对虹鳟(Oncorhynchus mykiss)生长性能、血清生化指标和非特异性免疫功能的影响,旨在为壳寡糖在水产饲料中的应用提供理论依据。
1 材料与方法
1.1 试验材料
试验用壳寡糖(脱乙酰度>90%)购自济南海得贝生物工程有限公司,以水产动物甲壳为原料,采用酶法制备,分子质量为3 000 u。
1.2 试验饲料
以小麦、豆粕、鱼粉为主要原料,按照 NRC(1993)鱼类营养标准配制基础饲料,其组成及营养水平见表1。在基础饲料中分别添加0(对照组)、100、200和400 mg/kg的壳寡糖,配制成4种试验饲料。饲料原料经粉碎(40目以上)后加水挤压成粒径为1.5~2.5 mm的颗粒料,自然晾干后备用。
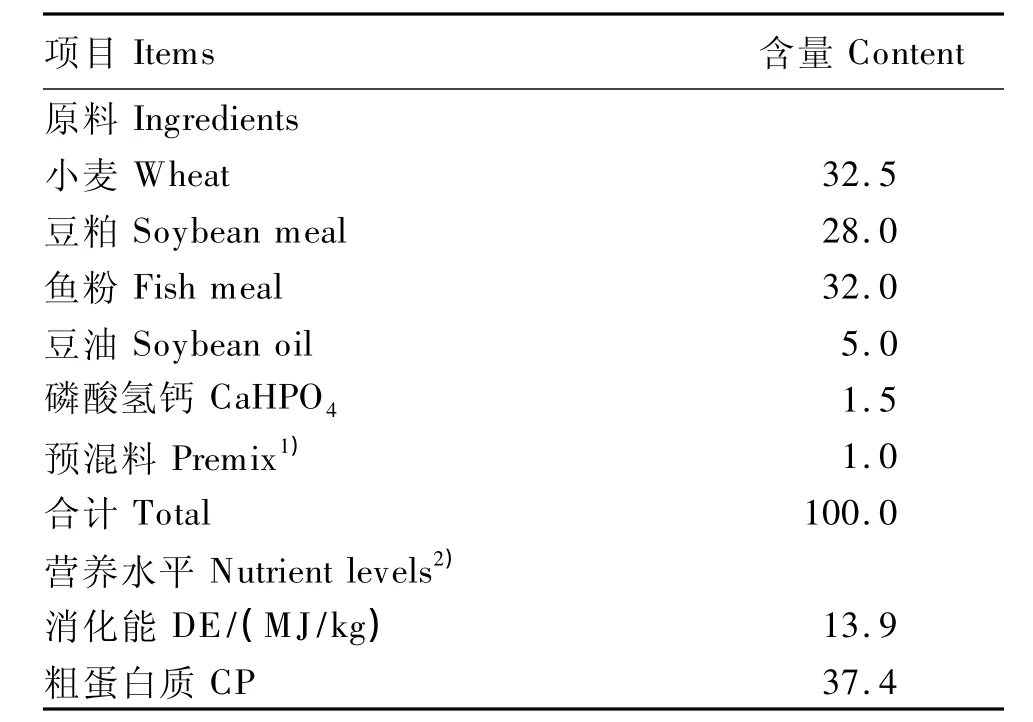
表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels ofthe basal diet(air-dry basis) %
1)预混料为每千克饲料提供 Premix provided the following per kg of diet:VC 800 mg,VA 12 000 IU,VD33 000 IU,VE 80 mg,VK 7 mg,VB120 mg,VB240 mg,VB620 mg,VB120.8 mg,泛酸钙 calcium pantothenate 60 mg,烟酸 nicotinic acid 215 mg,叶酸 folic acid 10 mg,肌醇 inositol 1 200 mg,生物素 biotin 3.0 mg,氯化胆碱 choline chloride 2 g,抗氧化剂 antioxidant 200 mg,甜菜碱 betaine 1.2 g,FeSO4·7H2O 100 mg,CuSO4·5H2O 20 mg,MnSO4·H2O 67 mg,KI 0.59 mg,MgSO4·7H2O 9.28 g。
2)计算值 Calculated values。
1.3 试验设计与饲养管理
选用体重约为60 g的虹鳟480尾,随机分为4组(每组4个重复,每个重复30尾),分别饲喂在基础饲料中添加0、100、200和400 mg/kg壳寡糖的试验饲料。试验鱼以重复为单位放养于水族箱中,水族箱的规格为0.30 m3,水体积为0.25 m3。
按照常规饲养管理程序进行,试验开始前用基础饲料驯养1周,日投喂量为试验鱼体重的2% ~4%,每天分别在09:00、14:00各投喂1次,根据摄食情况适当调整投喂量。试验期间水温为(15.5±2.0)℃,溶氧为(8.2±1.1)mg/L。试验期为49 d。
1.4 测定指标与方法
1.4.1 生长性能
特定生长率(specific growth rate,SGR,%/d)=
100×[ln初重-ln末重]/试验天数;增重率(weight gain rate,WGR,%)=
100×(初重-末重)/初重;
饲料系数(feed conversion rate,FCR)=
(投料量-残料量)/(死亡个体重+末重-初重);蛋白质效率(protein efficiency rate,PER,%)=100×鱼体净增重/(饲料摄取量×蛋白质含量)。1.4.2 血清生化指标
试验结束次日,每重复随机取4尾鱼,从尾静脉采血,室温放置60 min后,3 000 r/min离心10 min,将4尾鱼的离心上清液混合,制备待测血清样。血清中总蛋白、白蛋白、球蛋白、葡萄糖、甘油三酯、胆固醇含量以及谷丙转氨酶、谷草转氨酶活性采用南京建成生物工程研究所生产的试剂盒测定。
1.4.3 非特异性免疫指标
1.4.3.1 白细胞吞噬能力的测定
参照王军等[5]的方法进行,具体操作如下:1)每重复随机取4尾鱼,用无菌注射器从尾动脉采血适量,将每个重复4尾鱼所采的血液混合成1个样品,立即吸取2滴于盛有0.02 mL肝素(0.5%)的洁净凹玻片的凹孔内,轻轻搅动混匀;2)用滴管加1滴金黄色葡萄球菌菌液(浓度为6×108个/mL)于凹孔内,充分混匀;3)将凹玻片置于有数层湿纱布的预温带盖容器内,37℃温育30 min;4)以2 000 r/min离心10 min,吸取血浆与红细胞交界面的白细胞做血涂片,每个血样做2张涂片,自然晾干;5)滴加甲醇固定3~4 min,用水冲洗后自然晾干;6)用姬姆萨染色2~3 min,用水冲洗后自然晾干;7)将制备好的血涂片置于显微镜油镜下观察,随机计数100个多形核白细胞中吞噬有细菌的细胞数,即为吞噬百分率(%),再数此100个多形核白细胞中所吞噬的细菌总数,除以100,得出每个细胞吞噬细菌数的平均值,即为吞噬指数。
1.4.3.2 血清杀菌能力的测定
参照 Rainger等[6]、Ourth 等[7]及秦启伟等[8]的方法进行,具体操作如下:1)每重复随机取4尾鱼,用无菌注射器从尾动脉采血适量,将每个重复4尾鱼所采的血液混合成1个样品,血液经1 000 r/min离心5 min,制备血清;2)将创伤弧菌28℃培养24 h后,用0.85%氯化钠溶液洗涤并调整细菌浓度至1×106个/mL;3)取200 μL新鲜血清混合于200 μL细菌悬液中,28℃下温育1 h;4)取细菌和血清混合物培养于温热的大豆酪蛋白琼脂培养基(TSA)平板中,28℃下培养24 h后计算平板中菌落形成单位(colony forming units,CFUs);5)以0.85%NaCl溶液作为对照,计算血清的杀菌百分率。
血清的杀菌百分率计算公式如下:杀菌百分率(%)=100×(1-试验平板中菌落
形成单位/对照平板中菌落形成单位)。
1.4.3.3 血清、肝脏和鳃中溶菌酶活性的测定
参照南京建成生物工程研究所生产的试剂盒的说明书进行,具体操作如下:1)血清制备。每个重复选取3尾鱼,用无菌注射器从心脏采血,放于4℃静置4 h,然后4 000 r/min离心10 min,取上清液用于测定溶菌酶活性。2)肝脏、鳃组织匀浆液制备。分别取试验鱼肝、鳃组织各5 g,置于平皿中,剪碎后置于匀浆器中并加入1倍体积的0.1 mol/L磷酸钾盐缓冲液,充分匀浆且反复冻融数次后匀浆液经5 000 r/min离心15 min,取上清液用于测定溶菌酶活性。3)采用比浊法测定溶菌酶活性。
样品中溶菌酶活性的计算公式如下:溶菌酶活性(U/mL或U/g)=[(样品Tt值-样品To值)/(标准品Tt值-标准品To值)]×
标准品浓度。
式中:Tt值为At值(340 nm下5 min后的吸光度值)换算出的透光度值;To值为Ao值(340 nm下初始时的吸光度值)换算出的透光度值。
1.4.4 体成分
饲养试验结束后,每重复随机取3尾鱼,测定全鱼水分、粗蛋白质、粗脂肪和灰分含量。全鱼水分、粗蛋白质、粗脂肪和灰分含量分别采用恒温烘干失水法、微量凯氏定氮法、索氏抽提法和高温灼烧法测定。
1.5 数据处理与统计分析
试验数据以平均值±标准差表示。采用SPSS 13.0软件对试验数据进行处理和统计学分析,组间若有显著差异,则进行Duncan氏多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 壳寡糖对虹鳟生长性能的影响
由表 2可知,与对照组相比,100、200和400 mg/kg壳寡糖组的特定生长率分别提高了5.60%(P <0.05)、15.89%(P <0.05)和18.69%(P<0.05),增重率分别提高了7.53%(P<0.05)、21.21%(P<0.05)和 26.02%(P<0.05),蛋白质效率分别提高了0.60%(P>0.05)、7.02%(P >0.05)和9.79%(P <0.05),饲料系数分别降低了0.60%(P>0.05)、6.55%(P>0.05)和8.93%(P<0.05)。200和400 mg/kg壳寡糖组的特定生长率、增重率、饲料系数和蛋白质效率均差异不显著(P>0.05)。
2.2 壳寡糖对虹鳟血清生化指标的影响
由表3可知,虹鳟饲料中添加壳寡糖提高了血清总蛋白、白蛋白、球蛋白含量,降低了血清胆固醇、甘油三酯、葡萄糖含量以及谷丙转氨酶、谷草转氨酶活性,但均未达到显著水平(P>0.05)。
2.3 壳寡糖对虹鳟非特异性免疫功能的影响
2.3.1 壳寡糖对虹鳟白细胞吞噬能力的影响
由表4可知,200和400 mg/kg壳寡糖组较对照组和100 mg/kg壳寡糖组显著提高了白细胞的吞噬百分率和吞噬指数(P<0.05),但200和400 mg/kg壳寡糖组之间差异不显著(P>0.05),100 mg/kg壳寡糖组与对照组之间差异也不显著(P>0.05)。
2.3.2 壳寡糖对虹鳟血清杀菌能力的影响
由表5可知,血清杀菌百分率随壳寡糖添加水平的增加而提高,200和400 mg/kg壳寡糖组极显著高于对照组和100 mg/kg壳寡糖组(P<0.01),100 mg/kg壳寡糖组极显著高于对照组(P<0.01),但200和400 mg/kg壳寡糖组之间差异不显著(P>0.05)。
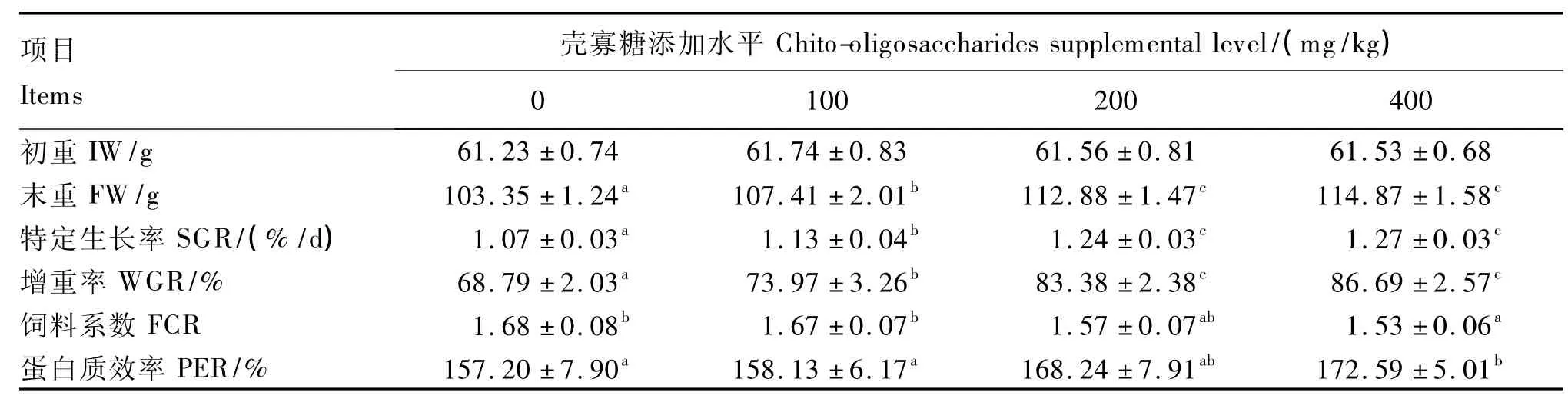
表2 壳寡糖对虹鳟生长性能的影响Table 2 Effects of chito-oligosaccharides on growth performance of rainbow trout
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row,values with different small letter superscripts mean significant difference(P<0.05),and with different capital letter superscripts mean significant difference(P<0.01).The same as below.
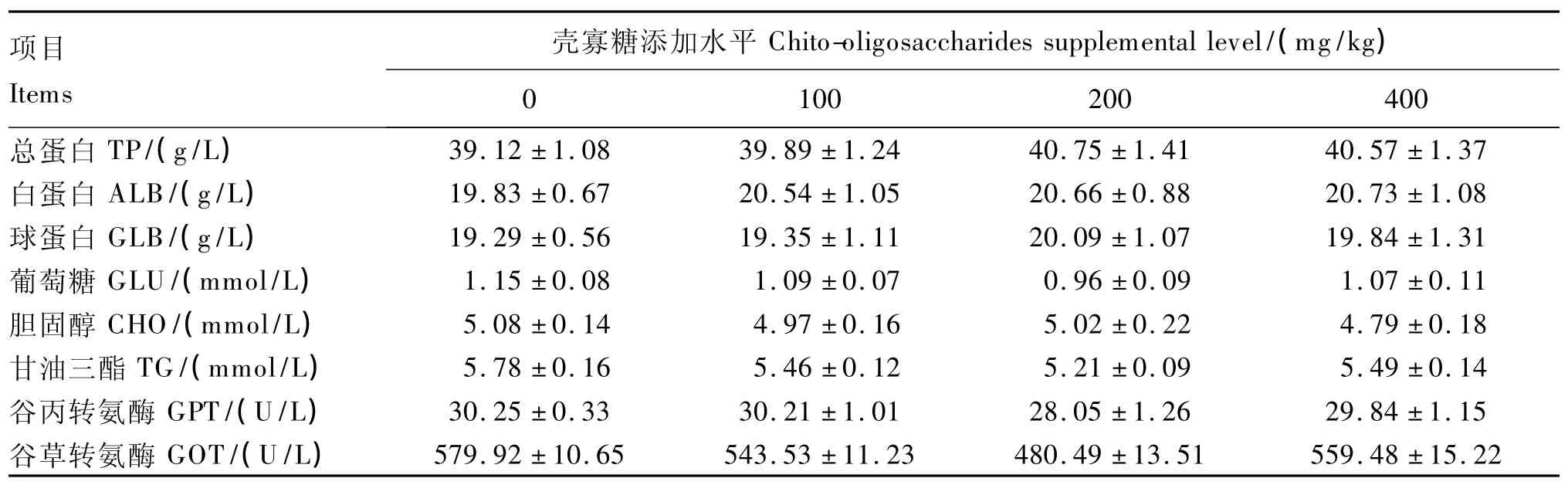
表3 壳寡糖对虹鳟血清生化指标的影响Table 3 Effects of chito-oligosaccharides on serum biochemical indices of rainbow trout

表4 壳寡糖对虹鳟白细胞吞噬能力的影响Table 4 Effects of chito-oligosaccharides on leucocyte phagocytic ability of rainbow trout

表5 壳寡糖对虹鳟血清杀菌能力的影响Table 5 Effects of chito-oligosaccharides on serum bactericidal ability of rainbow trout%
2.3.3 壳寡糖对虹鳟血清、肝脏和鳃中溶菌酶活性的影响
由表6可知,200和400 mg/kg壳寡糖组较对照组和100 mg/kg壳寡糖组显著提高了血清和肝脏中溶菌酶活性(P<0.05),但200和400 mg/kg壳寡糖组之间差异不显著(P>0.05),100 mg/kg壳寡糖组与对照组之间差异也不显著(P>0.05)。随着壳寡糖添加水平的增加,鳃中溶菌酶活性显著增加(P<0.05)。
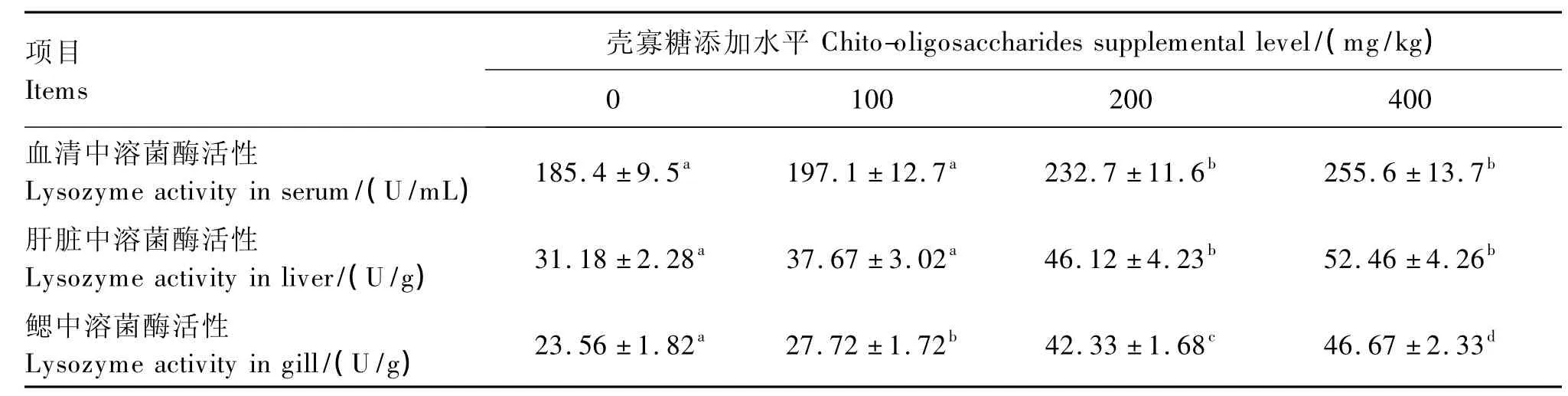
表6 壳寡糖对虹鳟血清、肝脏和鳃中溶菌酶活性的影响Table 6 Effects of chito-oligosaccharides on lysozyme activity in serum,liver and gill of rainbow trout
2.4 壳寡糖对虹鳟体成分的影响
由表7可知,壳寡糖对虹鳟全鱼水分、粗蛋白质、粗脂肪、灰分含量均没有显著影响(P>0.05)。
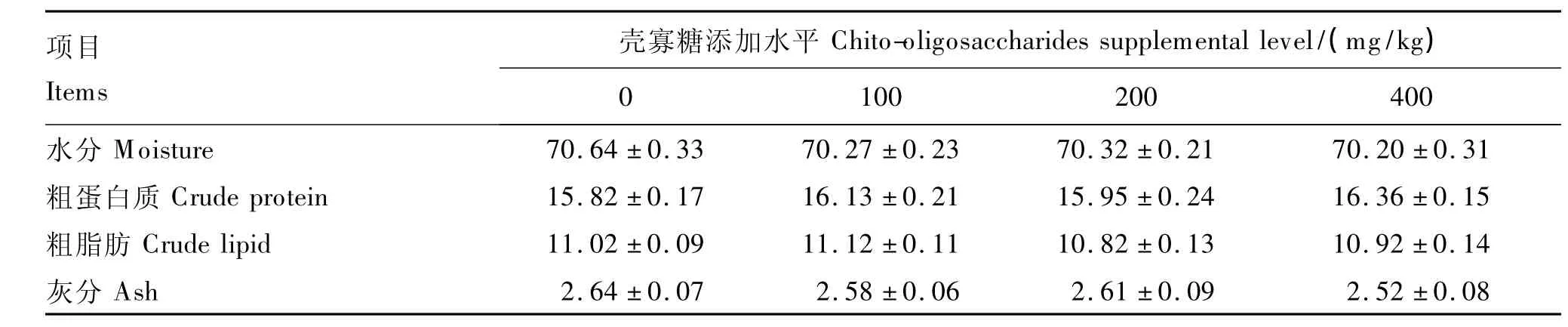
表7 壳寡糖对虹鳟体成分的影响Table 7 Effects of chito-oligosaccharides on body composition of rainbow trout %
3 讨论
3.1 壳寡糖对虹鳟生长性能的影响
Refstie等[9]给大西洋鲑鱼分别饲喂不含和含大豆寡糖的饲料55 d,结果发现,饲喂含大豆寡糖饲料的试验组大西洋鲑鱼在增重率、饲料转化率以及蛋白质和脂肪消化率等方面均优于对照组。刘兴国等[10]在罗非鱼的饲料中分别添加0.25%、0.50%、1.00%、2.00%的壳聚糖(甲壳素酶解所得,分子质量大于壳寡糖),结果表明,壳聚糖显著降低了罗非鱼的饲料系数,提高了蛋白质效率,添加量以0.50%最为适宜。曹丹等[11]在异育银鲫饲料中分别添加0、1.0%、1.5%、2.0%的壳聚糖,饲喂60 d后发现,各试验组的增重率均比对照组显著提高,且以1.0%添加组提高最多。本试验结果表明,饲料中添加100、200和400 mg/kg壳寡糖均提高了虹鳟的特定生长率、增重率和蛋白质效率,降低了饲料系数,表明饲料中添加壳寡糖对虹鳟的生长有良好的促进作用。寡糖主要通过以下途径对动物的生长性能产生影响:1)促进矿物元素的吸收。寡糖发酵产生的酸性物质能吸附钙化合物使其溶解性增加,从而导致钙吸收能力增强。2)生成营养物质。寡糖可促进有益菌如双歧杆菌等的大量增殖,而双歧杆菌在肠道能合成维生素 B1、维生素 B2、维生素 B6、维生素 B12、烟酸、叶酸以及各种氨基酸[12]。
3.2 壳寡糖对虹鳟血清生化指标的影响
寡糖能够降低血清中甘油三酯和胆固醇含量,进而改善脂类代谢;能够降低血清中的尿素氮含量,提高蛋白质沉积率;同时还能够降低尿素在肾脏中的沉积,从而减少肾脏尿素中毒的可能性。此外,寡糖的添加还对血清中的免疫球蛋白含量、生长激素水平以及谷草转氨酶、谷丙转氨酶活性等有一定的影响。血清转氨酶在氨基酸代谢和蛋白质、脂肪和糖三者相互转化的过程中起着极其重要的作用,谷丙转氨酶活性的升高常反映肝功能发生障碍,谷草转氨酶活性的升高常反映心脏或肌肉组织功能发生障碍[13];血清葡萄糖含量可作为机体营养状况的指标,含量较高时表现为鱼类积极摄食,健康状态良好。这些血清生化指标的变化可直接或间接地反映出壳寡糖投喂后对鱼类生长、代谢的影响。马利等[3]在南美白对虾饲料 中 分 别 添 加 壳 寡 糖 0、125、250、500、1 000 mg/kg,饲喂8周后发现,壳寡糖对南美白对虾血清中肌酐、葡萄糖、钙离子、总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量均无显著影响,但可使高密度脂蛋白胆固醇含量显著增加,促进脂类代谢。本试验结果表明,饲料中添加壳寡糖提高了虹鳟血清总蛋白、白蛋白、球蛋白的含量,降低了血清甘油三酯、胆固醇、葡萄糖含量以及谷丙转氨酶和谷草转氨酶活性,但均未达到显著水平,说明壳寡糖提高了饲料蛋白质在体内的沉积,同时也体现了虹鳟鱼体的健康水平。
3.3 壳寡糖对虹鳟非特异性免疫功能的影响
鱼类是较低等的脊椎动物,非特异免疫在鱼类的免疫防御中发挥着重要作用。鱼类抗传染免疫中主要靠体液免疫和细胞免疫,在细胞免疫中,血液中的白细胞起着重要的作用。血清溶菌酶活性是鱼类机体非特异性免疫反应的重要指标,其活性的升高表明巨噬细胞、多型核白细胞的吞噬活性加强。因此,通过测定鱼类血液中白细胞数量和吞噬能力以及肝脏等组织中的溶菌酶活性,可以反映出被测鱼类机体的免疫状态。本研究结果表明,饲料中添加200和400 mg/kg壳寡糖后虹鳟的非特异性免疫功能得到显著改善。Claire等[14]将健康鲤鱼饲养于壳聚糖浓度为150 mg/L的水中作为试验组,正常饲养96 h后采集鲤鱼的肝脏、头肾组织,测其抗体水平,发现试验组的总抗体量显著高于对照组;此外,将寄生有Ptychobothrium sp.(Cestoda)的鲤鱼饲养于壳聚糖和铜离子浓度分别为75.0和0.1 mg/L的水中作为试验组,检测结果仍是试验组的总抗体量显著高于对照组。王树芹等[15]研究发现,在异育银鲫饲料中添加0.5%或1.0%的壳聚糖能够提高血清溶菌酶活性和白细胞的吞噬能力。沈锦玉等[16]研究发现,给中华绒螯蟹注射或口服壳聚糖可显著提高其血清中溶菌酶、超氧化物歧化酶活性。寡糖提高机体免疫功能的可能机制有:1)寡糖本身具有一定的免疫原性,能够刺激机体免疫应答[17];2)寡糖分子与存在于肠内皮细胞上的有害微生物的受体结构相似,能与一定的毒素、病毒和真菌细胞的表面结合,可作为外源抗原的佐剂减缓抗原的吸收,增加抗原的效价,从而增强动物体的细胞和体液免疫反应[18];3)寡糖可促进有益菌如双歧杆菌等的大量增殖,而双歧杆菌可以提高机体的抗体水平,激活巨噬细胞的吞噬活性,从而影响机体的免疫功能[19]。
4 结论
本试验条件下,饲料中添加壳寡糖可提高虹鳟的生长性能和非特异性免疫功能,建议添加量为200 mg/kg。
[1] 胡志鹏.壳寡糖的研究进展[J].中国生化药物杂志,2003,2(44):210 -212.
[2] 王秀武,杜昱光,白雪芳,等.壳寡糖对肉仔鸡肠道主要菌群、小肠微绒毛密度、免疫功能及生产性能的影响[J].动物营养学报,2003,15(4):32-35.
[3] 马利,曹俊明,吴建开,等.壳寡糖对南美白对虾生长和血清生化指标的影响[J].淡水渔业,2006,36(2):6-8.
[4] ALONSO M,LEONG J A.Suppressive subtraction libraries to identify interferon-inducible genes in fish[J].Marine Biotechnology,2002,4(1):74 - 80.
[5] 王军,鄢庆枇,苏永全,等.免疫添加物对大黄鱼血液白细胞数量及其吞噬功能的影响[J].海洋科学,2001,25(9):44 -46.
[6] RAINGER G E,ROWLEY A F.Antibacterial activity in the serum and mucucs of rainbow trout,Oncorhynchus salmonicida[J].Fish & Shellfish Immunology,1993,3(4):475 -482.
[7] OURTH D D,RATTS V D.Bactericidal complement activity and concentrations of immunoglobulin M,transferrin and protein at different ages of channel catfish[J].Journal of Aquatic Animal Health,1991,3(2):274-280.
[8] 秦启伟,吴灶和,周永灿,等.饵料维生素C对青石斑鱼的非特异性免疫调节作用[J].热带海洋,2000,19(1):58 -63.
[9] REFSTIE S,STOREBAKKEN T,ROEM A T.Feed consumption and conversion in Atlantic salmon(Salmo salar)fed diets with fish meal,extracted soybean meal or soybean meal with reduced content of oligosaccharides,trypsin inhibitors,lectins and soya antigens[J].Aquaculture,1998,162:301 - 312.
[10] 刘兴国,宋理平,周洪琪.低分子壳聚糖对罗非鱼肝组织抗氧化能力和肝脂含量影响的研究[J].海洋渔业,2004,26(4):291 -294.
[11] 曹丹,周洪琪.壳聚糖对异育银鲫的生长、蛋白质合成及肌肉营养成分的影响[J].淡水渔业,2004,34(1):6-9.
[12] 孙忠保,阎宏,马永军.寡糖在动物生产中的应用[J].宁夏农学院学报,2004,25(4):80 -84.
[13] 刘伟,李佐锋.温度对鲢鳙鱼生理生化指标的影响[J].东北师范大学学报:自然科学版,1996(2):108-112.
[14] CLAIRE D,STEPHANE B,SEVERINE P,et al.Humoral immune factors modulated by copper and chitosan in healthy or parasitised carp(Cyprinus carpio L.)by Ptychobothrium sp.(Cestoda)[J].Aquatic Toxicology,2004,68(4):325 -338.
[15] 王树芹,周洪琪.壳聚糖对异育银鲫溶菌酶和白细胞吞噬活性的影响[J].上海水产大学学报,2004,13(2):121-125.
[16] 沈锦玉,刘问,曹铮,等.免疫增强剂对中华绒螯蟹免疫功能的影响[J].浙江农业学报,2004,16(1):25-29.
[17] NEWMAN K E,JACQUES K,BUEDE R P.Effect of mannan oligosaccharide supplementation of milk replacer on performance and fecal bacterial of Holstein calves[J].Jouranl of Animal Science,1993,71(Suppl.1):271.(Abstr.)
[18] 唐凌,邝声耀,冯琳,等.甘露寡糖对水生动物肠道菌群和免疫功能的影响[J].中国畜牧兽医,2008,35(6):21-25.
[19] 李风娜,张继成.寡糖对肠道菌群的调节及常用研究方法[J].兽药与饲料添加剂,2005,10(4):23-25.
