MGIT 960系统行二线抗结核药物敏感性试验的实用性评价
2012-09-02蒋俊张娟张红贾琳魏成翠石莲马静红杨立军
蒋俊 张娟 张红 贾琳 魏成翠 石莲 马静红 杨立军
耐药结核病尤其是MDR-TB和XDR-TB的治疗已成为结核病控制工作中亟待解决的问题[1]。我国2007—2008全国结核病耐药性基线调查报告显示,结核病耐多药情况严重[2]。2010年胡远莲等[3]的《我国二线抗结核药物使用现状调查研究》报告中显示,我国二线抗结核药物(second-line anti-tuberculosis drugs,SLD)在各级结核病防治机构使用的很普遍,不同级别、不同类型的医疗机构SLD的使用存在较大差异,而SLD的药敏试验开展的却很少。这一现状严重影响了MDR-TB患者的治疗效果,甚至进一步导致XDR-TB的发生。近年,MGIT960系统快速二线药敏试验倍受业内人士关注。2011年1月,本室在前期完成 MGIT 960液体与罗氏(Löwenstein-Jensen medium,L-J)固体两种方法结核分枝杆菌培养、鉴定及一线抗结核药物药敏比对试验的基础上,以金标准L-J培养法为参照,以卷曲霉素 (capreomycin,Cm)、卡 那 霉 素 (kmamycin,Km)、氧氟沙星(ofloxacin,Ofx)和乙硫异烟胺(etoionamide,Eto)SLD为代表,对 MGIT 960系统SLD药敏试验的实用性进行了评价。
材料和方法
一、患者标本纳入
根据卫生部国际交流与合作中心《碧迪(Becton Dickinson,BD)结核病控制项目辽宁工作方案》(简称:《方案》)的要求,本实验患者严格按照文献[4]选择,在临床表现症状、体征及胸部影像学检查确诊,或高度疑似的沈阳市胸科医院初始入院(未经抗结核治疗)的肺结核患者中进行。2010年8月至2011年1月共纳入上述《方案》要求的患者435例,其中男性319例,女性116例,平均年龄(52.3±17.2)岁(10~86岁),并分别留取该纳入患者经检验人员目视检查合格的痰液(晨痰)标本435例,其中的非合格标本均是经过进一步指导后重新留取送检的标本[5]。
二、实验材料和培养基
1.实验仪器 :全自动BACTEC MGITTM960 TB系统(美国BD公司)。
2.MGIT960液体培养基 :MGIT 960液体培养基(批号:0044761);MGIT生长添加剂(growth supplement)(批号:0131176);MGIT 杂菌抑制剂(PANTA)(批号:0083257)均购置于美国BD公司。
3.L-J固体培养基:L-J固体培养基依据《结核病诊断实验室检验规程》[5]由本室制备。
4.二线药敏质控菌株:(1)10株(1-10依次编号:FJ09094、FJ09094、FJ09094、FJ09094、FJ09094、FJ09094、FJ09094、FJ09094、FJ09094、H37Rv)国家结核病参比实验室提供(菌株库-80℃冻存品);(2)大肠埃希菌(ATCC25922)株,购置于上海生物制品鉴定所。
三、耐药培养基的制备
(一)实验药品
1.一线抗结核药敏药物:异烟肼(INH)、利福平(RFP)、链霉素(S)和乙胺丁醇(EMB),为中国CDC传染病预防控制所提供的美国Sigma公司试剂盒(批号:0047060)。
2.二线抗结核药敏药物:卷曲霉素(批号:029k0266)、卡那霉素(批号:0001440547)、氧氟沙星(批号:040M1313)和乙硫异烟胺(批号:139811010509116),为中国CDC传染病预防控制所提供的美国Sigma公司产品。
3.分枝杆菌菌种鉴定品:对硝基苯甲酸(PNB)和噻吩-2-羧酸肼(TCH),为辽宁省CDC结核病防治所提供的美国Sigma公司产品。
(二)耐药培养基制备
MGIT 960耐药培养基依据文献[6]制备,其终浓度见表1;L-J耐药培养基依据文献[5]制备,其终浓度见表1。

表1 SLD加入MGIT 960和L-J培养基内的含药浓度(μg/ml)
四、二线药敏质量控制
1.室间质控:MGIT 960系统与 L-J培养法SLD药敏比对试验前,L-J培养法Cm、Km、Ofx和Eto 4种SLD药敏试验,经过国家结核病参比室统一下发的10株质控株(重复试验3次)质控。
2.质控结果:质控试验结果符合率:Cm 90.0%(27/30),Km 93.3% (28/30),Ofx 100.0% (30/30),Eto 100.0% (30/30),符合率>90%。
3.室内质控:每批次试验均做质控。以H37Rv(ATCC27294)株为阳性质控;大肠埃希菌株为阴性质控。
五、实验方法
(一)阳性株筛查
对纳入的435例患者痰液同一标本分别进行涂片抗酸染色(萋-尼法)镜检,改良罗氏固体培养和MGIT960系统液体培养进行阳性菌株的筛查及菌群(菌种)鉴定。
1.抗酸染色镜检:(1)涂片:应用折断的竹签茬端分若干批次分别挑取上述痰标本的脓样、干酪样部分约0.05~0.1ml均匀涂抹玻片中央处约成10mm×20mm椭圆形痰膜,自然干燥。(2)染色:萋-尼法染色,100×油镜镜检查找呈红色的抗酸杆菌(AFB)。(3)结果判定:①连续观察300个不同视野未发现AFB者为阴性。②发现AFB/300个视野者为阳性。分级报告以萋-尼染色镜检结果分级报告标准[4]加以表述(记录)。
2.改良罗氏固体培养(L-J):(1)前处理:取上述涂片后的痰标本采用N-乙酰-L-半胱氨酸(NALC)-NaOH法进行前处理。(2)接种培养:取前处理后的标本分别接种至L-J和PNB培养基(含500mg/ml PNB的L-J培养基)各0.1ml,无菌操作接种于培养基斜面上,置37℃培养箱中培养。(3)结果判定及菌群鉴定:①L-J培养:接种并孵育后3d和7d各观察1次菌落生长情况,4周内发现菌落生长并经抗酸染色镜检证实可报告阳性。此后每周观察1次,记录菌落生长及污染情况,阴性结果在8周后未见菌落生长者方可报告;②PNB培养基:基于结核分枝杆菌复合群(Mycobacterium tuberculosiscomplex,MTBC)在PNB培养基中受抑制而不生长的特性,4周未见生长的菌株可判定为MTBC。(4)菌种鉴定:经菌群鉴定为MTBC的菌株进一步TGH生长试验。①将 MTBC菌株(约含10-3MTBC)分别接种至 TCH 培养基(含5mg/ml TCH L-J培养基),置37℃培养箱中培养;②基于TCH对牛结核分枝杆菌有抑制作用,而对大多数Mtb无抑制作用的特性,4周未见生长的菌株可判定为牛结核分枝杆菌。
3.MGIT960系统液体培养:①添加剂加入:严格地为每个MGIT960培养管添加0.8ml MGIT生长添加剂和PANTA;②接种培养:在MGIT培养管中加入0.5ml混合均匀的经过前处理的痰液样本置入MGIT960仪器中37℃培养;③结果报告:孵育至仪器报阳,最多培养6周,如未能生长仪器将标记为阴性。
(二)一线药物耐药株筛查
将上述MGIT960和L-J阳性菌株分别进行一线药物INH、RFP、S和EMB的 MGIT 960系统和L-J培养法药敏试验,进行耐药菌株的筛查。筛查出的耐药株作为本次SLD药敏试验的实验菌株。
(三)二线药物药敏试验
分别将一线药敏耐药菌株接种至含有适宜浓度(表1)的Cm、Km、Ofx和Eto SLD的 MGIT 960系统液体和L-J(比例法)固体培养基,同步进行药物敏感性试验。MGIT 960液体培养仪器自动报告结果,L-J固体培养4周后报告结果[4]。
(四)结果判定
仪器提示MGIT960培养试验完成并打印每种药敏的药敏试验结果,定性为耐药(R)、敏感(S)或不确定(×);L-J培养药敏依据 WHO推荐的耐药百分比=(含药培养基菌落数/对照不含药培养基菌落数)×100%。>1为耐药(R),≤1为敏感(S),Cm、Km、Ofx和Eto采用同一标准[6]。
六、统计方法
MGIT960和L-J两种培养方法的符合率(%)采用两方法共同S和R例数之和与实验标本总例数之比进行计算,其计算公式为:(S(ab)+R(ab))/n×100%(S(ab):MGIT 和 L-J两 方 法 共 同 敏 感 数;R(ab):MGIT和L-J两方法共同耐药数;n:实验标本总例数)。两方法的差异性采用配对设计的卡方检验,P<0.05为差异有统计学意义。两种方法检测结果的一致性的Kappa值计算应用统计学软件SPSS 16.0进行判别,Kappa值≥0.75,说明两种方法具有相当满意的一致性,0.75>Kappa值≥0.4说明两种方法的一致性一般满意,Kappa值<0.4说明两种方法的一致性不理想。
结 果
一、痰涂片和L-J固体培养法与MGIT960系统培养结果
1.痰涂片、L-J和MGIT960培养法的阳性检出率:435例标本中痰涂片阳性206例,阴性229例,阳性检出为47.4%(206/435);MGIT960阳性245例,阴性168例,阳性检出率为56.3%(245/435);L-J培养阳性234例,阴性181例,阳性检出率为53.8%(234/435)(表2)。
2.MGIT 960与L-J法阳性检出率:上述435例标本中去除单双污染例数,实际有效标本(样本总例数减去单双污染例数)为400例(435-35=400),即实际纳入两者比对的标本为400例,其中L-J和MGIT960培养法共同阳性219例,共同阴性156例(表3)。
二、阳性菌株筛查结果
MGIT960和L-J共同阳性标本219例,经PNB和TCH药敏菌群(菌种)鉴定筛出结核分枝杆菌212例,去除2例生长不良株,210例结核分枝杆菌阳性株作为一线抗结核药敏试验株。

表2 痰涂片与MGIT960系统培养法和L-J固体培养法阳性检出率比较
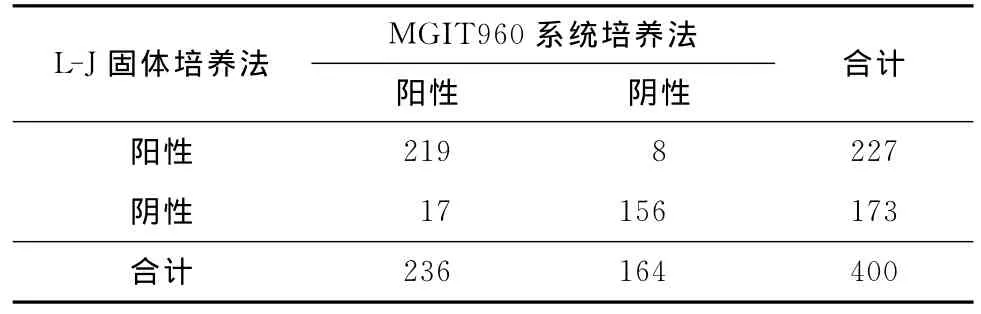
表3 MGIT 960与L-J法阳性检出率比较(例)
三、一线药物药敏耐药菌株筛查结果
210例阳性株经一线药敏试验共筛出耐药菌株118例。其中耐INH 102例,耐 RFP 85例,耐S 42例,耐 EMB 85例。
四、二线药物药敏试验
MGIT 960系统培养法与L-J培养法SLD药敏试验,SLD Cm、Km、Ofx和Eto敏感(S)及耐药(R)符合率分别为,Cm 88.1%(104/118),χ2=2.57,P>0.05;Km 95.8% (113/118),χ2=0.80,P>0.05;Ofx 91.5%(108/118),χ2=0.10,P>0.05;Eto 71.2%(84/118),χ2=28.26,P<0.01(表4)。
五、培养时间
MGIT960系统培养法SLD药敏试验所需时间平均10.0d(1183/118),L-J培养法SLD药敏试验所需 时 间 平 均 28.5d(3 360/118),两 者 相 差18.5d。
讨 论
液体培养SLD敏感性试验的应用推广一直受到人们的极大关注。自1996年BACTEC MGITTM960TB系统诞生以来,由于该系统的检测功能与BACTEC 460系统相似,且无放射性污染,所以国内外对MGIT 960系统在结核分枝杆菌的培养和药敏试验的实用性以及优越性研究的较多[7-9]。
本研究结果显示,现代MGIT960系统培养法与传统L-J固体培养法二线抗结核药物Km和Ofx结果的符合率较高(95.8%和91.5%,P值均>0.05),经一致性检验 Kappa值均>0.75(0.815和0.824)其一致性为相当满意;Cm 的符合率为88.1%,P>0.05,经一致性检验0.75<Kappa值>0.4(0.520)其一致性为一般满意。Eto符合率为71.2%,P<0.01,经一致性检验 Kappa值<0.4(0.375),其一致性不理想。该结果与国内相关报道存在一定差异[8],其原因可能与培养基药物终浓度的不同有关:Eto在L-J固体培养基中的药物终浓度为40μg/ml[5],而在 MGIT960系统培养基中的药物终浓度则为 5.0μg/ml[9],可能是导 致 Eto MGIT 960系统培养法耐药比率高于L-J固体培养法的主要原因之一,此点有待进一步研究加以验证。从MGIT 960系统培养与L-J固体培养法药敏试验检测时间(培养周期)比较来看,MGIT 960培养的时间范围为6~14d(平均10.0d),而L-J固体培养法为28.5d,前者比后者平均缩短了18.5d,突出体现了MGIT 960系统培养的快速特点。另外,需要说明的是,虽然本研究比对的是临床上较为常用的4种SLD,但该4种药物仅是多种SLD中的部分药物,所以这一实验结果不能代表其他SLD。

表4 MGIT 960系统培养法与L-J固体培养法结果与4种SLD药敏试验的符合率
结核分枝杆菌的培养鉴定及药敏试验从固体培养到液体培养的过度,对于结核分枝杆菌检测的快速报告和临床治疗方案的尽早制定具有十分重要意义。传统的L-J固体培养虽然准确率很高,但培养的时间过长,很大程度上制约了患者的及时诊断和科学治疗。特别是痰检阴性的结核患者,临床上的治疗往往由于缺乏诊断依据而带来困难。经验用药不仅会给患者带来盲目的药物负担,而且极易引发MDR和(或)XDR的发生,给日后的治疗增加难度。MGIT 960液体培养鉴定加药敏试验一般2~3周即可报告结果,大大缩短了临床和患者获取结果的等待时间,为临床及时治疗提供了便利,具有很强的实用性[10],可作为结核分枝杆菌快速培养和药敏试验的新方法。随着SLD敏感性试验工作的逐步开展和实验方法的不断完善,MGIT 960系统的优势作用将会更多的显现。
[1]唐神结,高文.临床结核病学.北京:人民卫生出版社,2011:580-587.
[2]全国结核病耐药性基线调查报告.北京:人民卫生出版社,2010:49-52.
[3]胡远莲,何广学,刘志敏,等.我国二线抗结核药物使用现状调查研究.中国防痨杂志,2010,22(3):123-128.
[4]中华人民共和国卫生行业标准.WS288-2008肺结核诊断标准.北京:人民卫生出版社,2008.
[5]中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:54,56-57.
[6]World Health Organization.Policy guidance on drug-susceptibility testing(DOS)of second-line antituberculosis drugs.WHO/HTM/TB/2008.392.Geneva :World Health Organization,2008.
[7]中华医学会结核病学分会.全国耐药结核病学术研讨会纪要.中华结核和呼吸杂志,2000,23(1):78-81.
[8]赵丽丽,夏强,刘志广,等.MGIT960和比例法对结核分枝杆菌药物敏感性试验的对比研究.医学研究杂志,2011,40(5):40-43.
[9]Alcaide F,Benítez MA,EscribàJM,et al.Evaluation of the BACEEC MGIT 960and the MB/BacT systems for recovery of mycobacteria from clinical specimens and for speciea identification by DNA Accuprobe.J Clin Microbiol.2000,38(1):398-401.
[10]张娟,蒋俊,张红,等.MGIT960与罗氏培养法在结核分枝杆菌培养及药敏试验中的比对分析.中国防痨杂志,2011,33(6):361-364.
