结核分枝杆菌抗体检测试剂生产质量控制与临床研究概述
2012-09-02陈保文都伟欣杨蕾王国治
陈保文 都伟欣 杨蕾 王国治
Mtb抗体检测试剂主要用于检测人血清或血浆中是否含有Mtb抗体,是结核病的一种临床辅助诊断方法。目前,我国Mtb抗体检测试剂的检测技术多数采用胶体金法和酶联免疫法,笔者主要针对这两种检测技术就Mtb抗体检测试剂的主要原材料、生产工艺、产品质量控制,以及临床研究的技术要求进行概述,为Mtb抗体检测试剂的生产、研制单位及临床评价单位提供参考。其他检测技术(如发光免疫法、蛋白芯片法等)的Mtb抗体检测试剂可加以借鉴。
原材料
一、主要生物原料
主要生物原料包括各种Mtb天然抗原、Mtb重组抗原、单克隆抗体、多克隆抗体等。这类原料主要用于标记胶体金、包被硝酸纤维膜、制备质控线等或用于包被酶标反应板、标记相关酶(如辣根过氧化物酶、碱性磷酸酶等)、中和反应用抗原或抗体、制备校准品(标准品)等。
主要生物原料若为企业自己生产,应简述其制备程序,其中Mtb重组抗原应提供工程菌的构建、工作种子批的制备,生产工艺条件优化参数的建立等各项资料,以确保工艺相对稳定;若购买,其供应商要求相对固定,不能随意变更供应商。如生产工艺或供应商等有变更,应依据国家相关法规的要求进行变更申请。
主要生物原料的常规检验项目一般包括:外观、纯度和相对分子质量(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法和高效液相法等)、蛋白质浓度(Lowry法、280nm光吸收法和双缩脲法等)、效价(一般根据蛋白质浓度通过倍比稀释法进行)和功能性实验(至少应有阳性参考品符合率、阴性参考品符合率和最低检出限),应符合企业生产规定的要求。
二、生物辅料
生物辅料一般指在生产过程中作为蛋白保护剂用途的一类生物原料,主要包括小牛血清、山羊血清、牛血清白蛋白(bovine serum albumin,BSA)和酪蛋白等。其中牛血清或羊血清的检定项目至少应包括:外观、无菌试验、总蛋白含量和球蛋白含量等,BSA的检定项目至少应包括:外观、溶解性、总蛋白含量、总蛋白中的BSA含量、BSA的净含量等,质量标准应符合2000年版的《中国生物制品主要原辅材料质控标准》[1]规定的标准要求。此外,这些生物辅料还应进行功能性实验,即以其为原料配制一定浓度的稀释液作为样品进行测定,均不能出现非特异性反应。
标记用酶若为辣根过氧化物酶,酶的纯度RZ值(德文Reinheit Zahl)应不低于3.0[2]。
三、化学原材料
化学原材料的质量标准参照文献[1]分析纯级别进行检验,主要的检测指标包括:外观、一般盐类检测、溶液pH值、溶解情况、干燥失重、炽灼残渣等。在购入时,生产商必须提供该批次化学原材料的质量保证材料和质量检验报告。
四、其他物料
(一)针对酶联免疫法Mtb抗体检测试剂
应对酶标板进行外观、吸附能力和精密性等的检测。吸附能力和精密性应采用合适的方法进行检验,一般用一定浓度的正常人IgG包被板条,再用一定浓度的抗人IgG酶结合物吸附,通过显色反应,使用酶标仪读数,计算变异系数(coefficient of variation,CV),一般规定CV应 不 高 于10%。
各液体试剂应有相应的装量瓶,并建立相应的质量控制标准,如装量瓶的规格、装量瓶的颜色、瓶盖的颜色等。一般规定装量应不低于标示量。
(二)针对胶体金法Mtb抗体检测试剂
硝酸纤维素膜应具有外观、尺寸、厚度、孔径大小、毛细迁移速度等要求;玻璃纤维或聚酯纤维膜应具有外观、厚度、毛细迁移速度、重量等要求;滤纸应具有外观、厚度、吸水速度、重量、尺寸等要求;塑料垫片应具有厚度、硬度、尺寸、黏性等要求。其偏差范围应达到企业生产规定的要求。
(三)其他材料
包括试剂瓶标签、粘胶纸、铝箔袋、衬垫、可密封塑料袋、说明书、干燥剂和包装外盒等,应参照国家食品药品监督管理局颁布的《体外诊断试剂说明书编写指导原则》[3]和《医疗器械说明书、标签和包装标识管理规定》[4]建立相应质量控制。
生产工艺
一、酶联免疫法Mtb抗体检测试剂半成品的制备程序
主要包括酶标记抗体的制备(采用常规过碘酸钠-乙二醇法或其他适宜方法进行酶标记);包被抗原浓度和酶标记抗体工作浓度的选定(通常采用方阵滴定法);包被抗原板的制备(采用最佳包被浓度包被微孔板孔,经封闭、干燥和密封等处理后,于2~8℃保存);阴性阳性对照(若选用人或动物的血清或血浆,一般经60℃、1h进行处理后,除菌过滤,于2~8℃保存)、样品稀释液、洗涤液、酶结合物或酶稀释液、底物或底物缓冲液、终止液等各种工作液的配制。特别应注意的是,若阴性、阳性对照或其他液体组分涉及生物安全性问题,制备时应在相应的生物安全实验室完成。
应对包被抗原板按半成品质量控制的标准进行抽样检定,并应符合相应项的规定要求。各种工作液应有明确的配方及严格的配制程序,其质量控制主要包括酶结合物的功能性实验及稳定性;各种溶液的外观、pH值等;酶作用底物应测定在无相应酶的情况下自身显色的情况,并制定合理的限定指标;终止液应对其终止酶促反应的能力进行测定;检测过程中加入样本后的反应时间、加入酶结合物后的反应时间,以及加入显色液后的显色时间应进行优化,并制定合理的限定指标。对于定量检测试剂,其标准品(或校准品)溶液应具有量值溯源性。
二、胶体金法Mtb抗体检测试剂半成品的制备程序
主要包括胶体金及胶体金标志物的制备(采用枸橼酸三钠还原法或其他方法制备胶体金和胶体金标志物);胶体金标志物、包被抗原或抗体工作浓度的选定(通常采用方阵滴定法);胶体金标志物的包被;在硝酸纤维素膜上制备检测线和质控线;贴膜、切割及组装;阴性、阳性对照(若选用人或动物的血清或血浆,一般经60℃、1h进行处理后,除菌过滤,于2~8℃保存)及样品稀释液、洗涤液、封闭液等各种工作液的配制。特别应注意的是,若阴性、阳性对照或其他液体组分涉及生物安全性问题,制备时应在相应的生物安全实验室完成。
应对胶体金及胶体金标志物进行外观、pH值、胶体金颗粒大小、粒径的均一性,以及最大吸收波长等的检测;检测线和质控线应具有间隔距离要求;切割的膜条应有宽度要求。
三、成品的分批、分装和包装
按照文献[2]中“生物制品分批规程”“生物制品分装和冻干规程”及“生物制品包装规程”进行分批、分装与冻干和包装。
质量控制
一、半成品质量控制
以国家参考品或企业参考品进行半成品质量控制。检定项目至少应包括阴性参考品符合率、阳性参考品符合率、精密性(或重复性)和最低检出限。
(一)阴性参考品
至少采用5份来自非结核病志愿者(包括健康人和至少1份非结核病的其他肺部疾病患者)的血清或血浆。规定:检测结果应全部呈阴性或允许1份呈假阳性。
(二)阳性参考品
至少采用5份来自结核病患者的血清或血浆,应选择抗体效价分别呈强阳性、中阳性、弱阳性和临界的样本。规定:检测结果应全部呈阳性或允许1份呈假阴性。
(三)精密性(或重复性)参考品
至少采用1份来自结核病患者的血清或血浆,尽可能选择抗体效价呈弱阳性的样本。对于酶联免疫检测试剂,规定CV(%)应不高于15%(n=10);对于胶体金检测试剂,规定检测结果应全部呈阳性,且显色一致(n≥5)。
(四)最低检出限参考品
采用1份来自结核病患者的血清或血浆,尽可能选择检测结果呈强阳性的样本,然后用适宜的稀释液进行倍比系列稀释,至少含3个稀释度。规定:某一稀释度的样品应呈阳性,某一稀释度的样品可阴可阳,某一稀释度的样品应呈阴性。
二、成品质量控制
每一批酶联免疫检测试剂报批批量至少为10 000人份,每一批胶体金检测试剂报批批量至少为3000人份。一般使用国家参考品或经国家参考品标化的企业参考品进行检验。若使用企业参考品进行质量控制,应提供企业参考品制备和标化的技术资料,其中制备部分应提供各份样品来源的详细材料,阳性样品应有涂片和培养的检测结果,应提供分装规格和分装数量的数据;标化部分应提供候选样品的效价测定方法和测定结果等。
成品质量控制技术指标的要求应包括以下几点:
(一)物理检查
1.酶联检测试剂:应对试剂盒外观、试剂盒中各液体组分(如阴阳性对照、样品稀释液、洗涤液、酶结合物或酶稀释液、底物液、终止液等)及酶标板外观等进行检查,应符合相应的质量标准。
2.胶体金检测试剂:应对试剂盒外观、检测板、试剂盒中各液体组分(如阴阳性对照、样品稀释液、洗涤液、封闭液等)、液体移行速度及膜条宽度等进行检查,应符合相应的质量标准。
(二)功能性检测
1.阴性参考品:采用10~20份来自非结核病志愿者(包括健康人和至少1份非结核病的其他肺部疾病患者)的血清或血浆。规定:检测结果应全部呈阴性或允许1份呈假阳性。
2.阳性参考品:采用10~20份来自结核病患者的血清或血浆,应选择抗体效价分别呈强阳性、中阳性、弱阳性和临界的样本,还需考虑选择来自菌阴和菌阳、不同病程、肺内和肺外结核等患者的样本。规定:检测结果应全部呈阳性或允许1份呈假阴性。
3.精密性(或重复性)参考品:至少采用1份来自结核病患者的血清或血浆,尽可能选择抗体效价呈弱阳性的样本。对于酶联免疫检测试剂,规定CV(%)应不高于15%(n=10);对于胶体金检测试剂,规定检测结果应全部呈阳性,且显色一致(n≥5)。
4.最低检出限参考品:采用1份来自结核病患者的血清或血浆,尽可能选择检测结果呈强阳性的样本,然后用适宜的稀释液进行倍比系列稀释,至少含3个稀释度。规定:某一稀释度的样品应呈阳性,某一稀释度的样品可阴可阳,某一稀释度的样品应呈阴性。
(三)稳定性试验
可以用热稳定性试验来替代,温度一般选 (37±1)℃,放置时间可根据试剂盒的有效期而定,一般有效期6个月的产品37℃加热至少3d。有效期更长的产品应根据企业加速试验研究结果视情况而定。
临床研究
一、基本原则
(一)基本要求
Mtb抗体检测试剂一般采用血清、血浆、脑脊液、胸腔、腹腔积液等为研究样本,需征求受试者的同意,并签署知情同意书。
(二)临床研究单位及人员的要求
应为从事人类健康或疾病预防、诊断、治疗以及流行病学调查等活动的法人单位,而且进行研究的产品应该在其所从事的专业范围以内。必须具有相应专业的技术人员以及与研究试剂相适应的仪器设备。临床研究一般应在至少2家以上(含2家)省级医疗卫生单位完成。注册申请人应根据产品特点及其临床使用目的,综合不同地区人种、流行病学背景、病原微生物的特性等因素选择研究单位。在临床研究全过程中,注册申请人应考虑吸收流行病学、统计学、临床医学、检验医学等方面专业人员(或知识),以保证研究方法科学、合理[5]。
二、临床研究设计原则
(一)结核病诊断标准
依据 WS288-2008《肺结核诊断标准》[6]进行肺结核的诊断及鉴别。
(二)研究对象的选择
研究对象包括2组:(1)随机选用就诊怀疑结核病的患者,按文献[6]进行诊断;(2)正常人群。临床评价结束后,将(1)中入组人员分为以下两类人群进行数据处理:①结核病患者,包括菌阴和菌阳、不同病程、肺外结核等患者;② 非结核病患者,包括易与结核病相混淆的患者(如肺癌、细菌性肺炎、肺真菌病等)以及其他患者(如哮喘、气管炎等)。最终数据统计分析时,将 ②和(2)中人群合并作为非结核病的对照组,而①则作为结核病患者组。
(三)样本量
依据《体外诊断试剂注册管理办法(试行)》[7]第十二条规定,Mtb抗体检测试剂属第三类产品。《体外诊断试剂临床研究技术指导原则》[5]中规定一般情况下第三类产品的临床研究的总样本数至少为1000例,在符合指导原则有关最低样本量要求的前提下,还应符合统计学要求。
(四)对比试剂
应选择已批准上市且临床普遍认为质量较好的产品,同时应充分了解所选择产品的技术信息,包括方法学,临床使用目的和范围,主要性能指标、标准品或校准品的溯源情况、推荐的参考值(参考范围)等,以便对试验结果能够进行科学的分析。
(五)实验方法
1.痰涂片:参照文献[6]和[8],以临床研究单位常规的痰涂片方法进行操作。
2.痰培养:参照文献[6]和[8],将收集的痰标本采用临床研究单位常用的痰标本“前处理”方法进行液化,然后接种改良罗氏培养基或者也可联合采用快速培养法。
3.抗体检测:严格按Mtb抗体检测试剂中所附的说明书进行操作。
4.临床诊断:依据文献[6]进行确诊。
(六)实验结果确认
1.实验结果分类:具体见表1。
2.实验结果判定:(1)A类:细菌学及抗体检查均为阳性,临床确诊为结核病,抗体检测结果判定为真阳性。(2)B类:细菌学检查为阳性,抗体检查为阴性,临床确诊为结核病,抗体检测结果判定为假阴性。(3)C类:细菌学检查为阴性,抗体检查为阳性,临床确诊为结核病,抗体检测结果判定为真阳性。(4)D类:细菌学检查为阴性,抗体检查为阴性,临床确诊为结核病,抗体检测结果判定为假阴性。(5)E类:细菌学检查为阴性,抗体检查为阳性,临床确诊为非结核病,抗体检测结果判定为假阳性。(6)F类:细菌学检查为阴性,抗体检查为阴性,临床确诊为非结核病,抗体检测结果判定为真阴性。
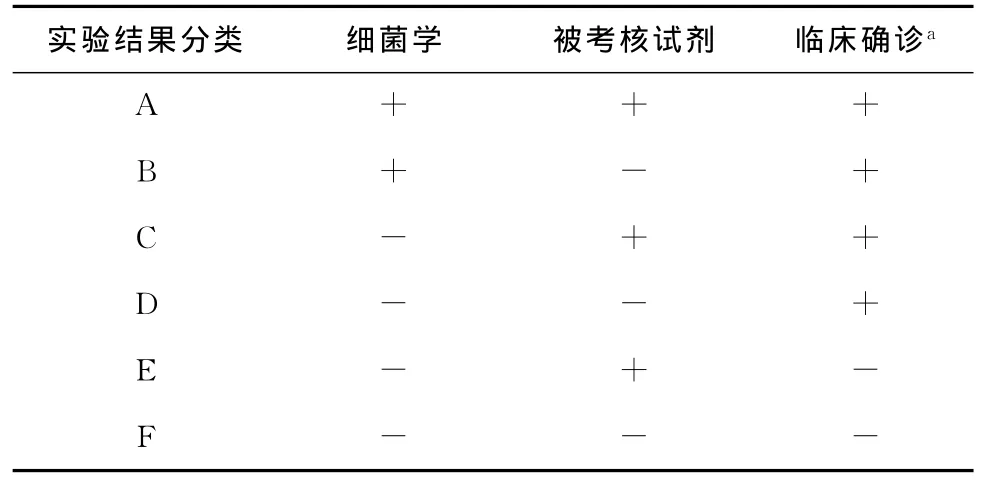
表1 实验结果分类
3.特异度和灵敏度的计算:被考核的 Mtb抗体检测试剂的特异度(%)为F/(E+F),灵敏度(%)为(A+C)/(A+B+C+D)。
三、关于临床研究报告的撰写
临床研究报告的格式及内容应包括以下内容。
(一)首篇
首篇是每份临床研究报告的第一部分,所有单个的临床研究报告均应包含该部分内容。主要有封面标题、目录、研究摘要、试验主要研究人员的姓名、单位和在研究中的职责及其简历(列于附件中)、缩略语等。
(二)正文内容和报告格式
1.基本内容:应包括引言、研究目的、试验管理、试验设计、临床研究结果及分析、讨论和结论等。其中试验设计中应包括:样本量及样本量确定的依据;样本选择依据、入选标准、排除标准和剔除标准;样本采集、保存、运输方法等;金标准或对比试验产品的确立;临床研究用所有产品的名称、规格、来源、批号、有效期及保存条件,对比试验产品的注册情况;质量控制方法;临床研究数据的统计分析方法;研究过程中方案的修改。
2.有关临床研究中特别情况的说明。
3.附件:应包括临床研究中所采用的所有诊断试剂产品的使用说明书、临床研究中的所有试验数据,以及主要参考文献等。
讨 论
WHO于2011年7月20日公布的一项政策建议中指出,使用目前市面上商业性血液(血清学)检测手段诊断活动性结核病,常常导致误诊和不当治疗,进而损害公众健康。WHO敦促各国采用其推荐的准确的微生物或分子检测方法,禁止使用不准确的和未经批准的血液检测方法[9]。
针对WHO提出的这项建议,国家食品药品监督管理局于2012年4月16日发布了进一步加强结核病血液检测试剂有关事宜通知:(1)结核病血液检测试剂仅用于结核病临床辅助诊断。(2)按照《体外诊断试剂注册管理办法(试行)》(国食药监械[2007]229号)的规定,与Mtb检测相关的试剂属于第三类体外诊断试剂。参见文献[10]。
我国是结核病发病大国,位居世界第二。Mtb抗体检测试剂尽管特异度和灵敏度均存在一定局限,但因其具有简便、快速的特点而倍受青睐,尤其适用于我国条件较差的基层医疗机构。鉴于WHO提出的这项建议,已批准的和正在进行注册或研制结核病血液(血清学)检测试剂的单位均应严格把好质量关,临床研究单位应严谨、规范和科学地制定临床考核方案,以确保我国的结核病血液学检测试剂在结核病诊断上起到辅助诊断的良好作用。
[1]中国生物制品标准化委员会.中国生物制品主要原辅材料质控标准.北京:化学工业出版社,2000.
[2]国家药典委员会.中华人民共和国药典(三部).北京:中国医药科技出版社,2010:6-8,333.
[3]国家食品药品监督管理局.体外诊断试剂说明书编写指导原则.北京:国家食品药品监督管理局,2007.
[4]国家食品药品监督管理局.医疗器械说明书、标签和包装标识管理规定.2004-07-08.
[5]国家食品药品监督管理局.体外诊断试剂临床研究技术指导原则.北京:国家食品药品监督管理局,2007.
[6]中华人民共和国卫生部.WS288-2008肺结核诊断标准.北京:人民卫生出版社,2008.
[7]国家食品药品监督管理局.体外诊断试剂注册管理办法(试行).2007-04-19.
[8]中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:13-45.
[9]World Health Organization.WHO warns against the use of inaccurate blood tests for active tuberculosis[EB/OL].WHO,Geneva,2011[2011-07-20].http://www.who.int/mediacentre/news/releases/2011/tb_20110720/en/.
[10]国家食品药品监督管理局办公室.关于进一步加强结核病血液检测试剂监管有关事宜的通知.北京:国家食品药品监督管理局,2012.
