断奶应激对仔猪肠形态、肠黏膜屏障和p38丝裂原活化蛋白激酶信号通路的影响
2012-08-30栾兆双姚丽丽傅振宁胡彩虹
栾兆双 姚丽丽 傅振宁 宋 娟 胡彩虹
(浙江大学饲料科学研究所,动物分子营养学教育部重点实验室,杭州 310058)
早期断奶造成仔猪营养、环境和心理应激,增加断奶后仔猪对环境潜在病原微生物的敏感性,使仔猪食欲差、消化不良、腹泻、生长受阻、死亡等,给养猪业带来较大经济损失。肠道是机体十分重要的防御屏障,仔猪消化道组织和功能发育尚未成熟,断奶应激导致的生理、营养和环境状况的突然改变易造成其肠道功能紊乱[1]。大量研究表明,断奶应激状态下仔猪肠形态受损,消化吸收能力下降[2-3]。然而关于早期断奶引起仔猪肠黏膜屏障变化的报道还较少,对于断奶应激引起仔猪肠道损伤的信号转导机制尚不清楚[4]。
肠道损伤所涉及的缺血、炎症、凋亡等多个病理机制与丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号道路的调节有关。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)是 MAPKs家族成员之一,p38 MAPK属于应激活化蛋白激酶,可被促炎因子(如肿瘤坏死因子-α、白细胞介素-1)、应激刺激(如紫外线、H2O2、热休克、高渗、蛋白质合成抑制剂等)以及脂多糖激活。p38 MAPK信号通路参与介导细胞的增殖和分化、细胞的凋亡和死亡等生理病理过程,并与炎症调控反应机制密切相关[5-6]。p38 MAPK 是否参与断奶应激引起的仔猪肠道损伤的信号转导目前尚未见报道。本文研究了早期断奶对仔猪肠黏膜屏障的影响,同时检测结肠黏膜p38 MAPK磷酸化的活化情况,为预防仔猪早期断奶应激提供新的思路。
1 材料与方法
1.1 试验动物与试验设计
试验选取体况相似、胎次和预产期接近的同品种母猪12窝,产仔数为9~11头。仔猪均为“杜×长×大”三元杂交品种。仔猪从7日龄开始诱食并哺乳。在21日龄,每窝选取2~3头仔猪[平均体重为(5.8±0.4)kg]断奶后在保育舍饲养,为断奶组,每窝剩下的仔猪不断奶继续哺乳至35日龄,为哺乳组。仔猪自由采食和饮水,按常规程序进行免疫,试验期为14d。分别于仔猪22、24、28和35日龄屠宰取样,每次每组6头。哺乳组和断奶组在相同的间隔时间取样。
1.2 基础饲粮
基础饲粮参照美国NRC(1998)断奶仔猪的营养需要配制成颗粒饲料。基础饲粮组成及营养水平见表1。
1.3 样品采集与测定
分别于22、24、28和35日龄,仔猪前腔静脉取血,肝素抗凝,制备血浆,-80℃保存。然后屠宰仔猪取样,剖开腹腔,取长度约1 cm的空肠肠段,用生理盐水将其轻轻冲洗干净,而后平铺在滤纸上将液体吸干,浸入10%的福尔马林中,置4℃冰箱保存,待做组织切片,光镜分析其形态结构的变化。另取10 cm左右结肠肠段用剪刀剖开,生理盐水轻轻冲洗肠内容物,滤纸吸干水分,再用手术刀钝面轻轻刮取肠黏膜,分装在5 mL无菌冻存管中,液氮速冻,-80℃保存。
1.3.1 肠形态分析
用一系列浓度梯度的乙醇脱水,二甲苯透明,石蜡包埋、切片,苏木精-伊红(HE)染色,中性树胶封片。Leica Qwin图像分析仪对空肠绒毛高度和隐窝深度作定量分析。
1.3.2 血浆D-乳酸含量、二胺氧化酶活性测定
血浆D-乳酸含量测定参照Brandt等[7]建立的分光光度法。血浆二胺氧化酶活性分析参照胡泉舟等[8]的方法,用分光光度法测定。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basaldiet(DM basis) %
1.3.3 结肠黏膜p38 MAPK的活化情况测定
参考Costantini等[5]的方法。全细胞裂解液提取结肠黏膜蛋白,BCA法定量蛋白浓度。取100 μg样品加样后进行聚丙烯酰胺凝胶电泳,将蛋白转至聚偏氟乙烯(PVDF)膜上,用含5%脱脂乳粉的0.06%Tween-20的三羟甲基氨基甲烷溶液(TBST)封闭40 min后洗膜,加入相应抗体(1∶1 000)4℃过夜孵育,将膜漂洗后加入兔抗小鼠免疫球蛋白G(IgG)抗体(1∶1 000)于室温孵育1 h,最后加入化学发光(ECL)试剂暗室曝光底片。底片扫描后进行蛋白条带的光密度值分析。BCA蛋白定量试剂盒为Thermo公司产品;全细胞裂解液、兔抗小鼠磷酸化p38 MAPK(p-p38 MAPK)和p38 MAPK单克隆抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记β-肌动蛋白(β-actin)的兔抗小鼠IgG抗体购自美国Sigma公司;辣根过氧化物酶标记的山羊抗兔IgG抗体、ECL试剂盒为美国Santa Cruz公司产品。p38 MAPK信号通路的激活状况以其磷酸化水平与总水平的比值(p-p38 MAPK/p38 MAPK)来表示,结果以哺乳组22日龄仔猪p-p38 MAPK/p38 MAPK为参照,断奶各组p-p38 MAPK/p38 MAPK为相对于哺乳组22日龄仔猪比值的倍数。
1.4 数据统计
数据以平均值±标准差表示,采用SAS 6.12中的一般线性模式(GLM)进行统计分析,Duncan氏法进行多重比较检验,以P<0.05作为差异显著性判断标准。
(2)80和100℃条件下和磺化钻井液相比较,HTHP失水相差不大,但在120℃高温条件下HTHP失水相对偏高,高温能力不如磺化处理剂;
2 结果
2.1 断奶应激对仔猪空肠形态的影响
由表2可见,与哺乳组相比,断奶组空肠绒毛高度和绒毛高度/隐窝深度在22、24和28日龄均显著降低(P<0.05),隐窝深度均显著提高(P<0.05),35日龄上述指标断奶组与哺乳组差异不显著(P>0.05)。断奶组在断奶后的不同时间肠形态也发生了变化,断奶仔猪24和28日龄空肠绒毛高度/隐窝深度显著低于22日龄(P<0.05),隐窝深度显著高于22日龄(P<0.05);35日龄断奶仔猪空肠绒毛高度和绒毛高度/隐窝深度显著高于22、24和28日龄(P <0.05)。结果表明,21日龄断奶使仔猪的肠形态发生了较大的变化,断奶后24 h就引起了仔猪肠绒毛萎缩、隐窝增深,28日龄后逐渐恢复,至35日龄肠形态基本恢复。
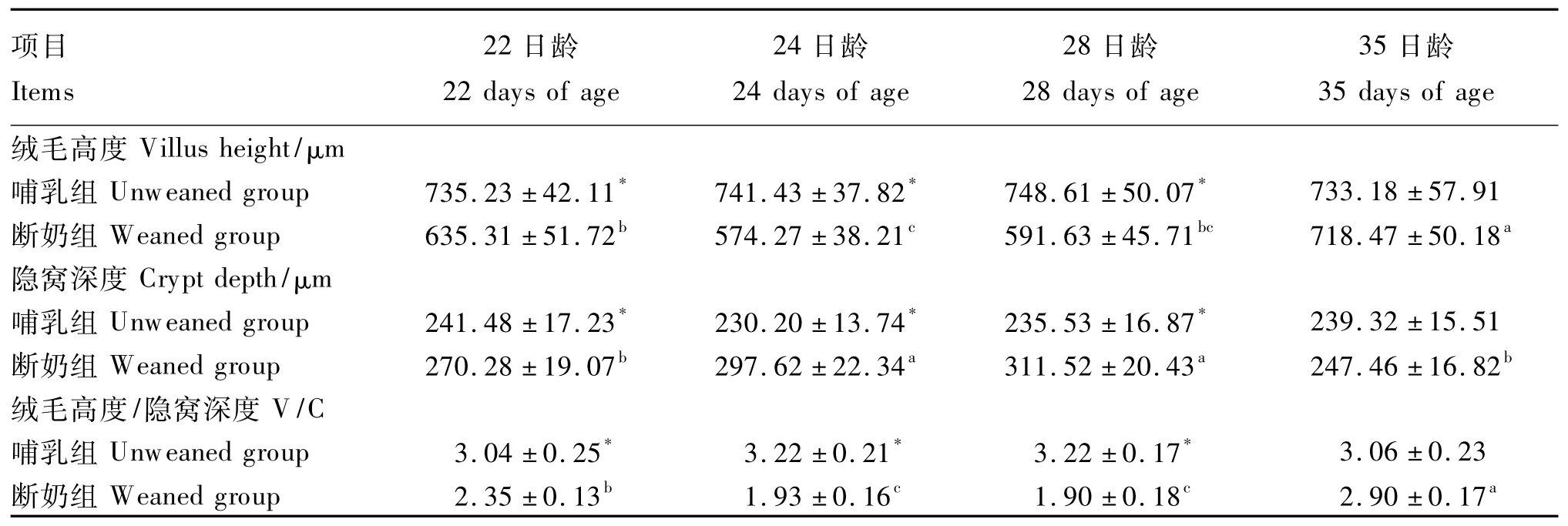
表2 断奶应激对仔猪空肠形态的影响Table 2 Effects of weaning stress on jejunal morphology of piglets
2.2 断奶应激对仔猪肠黏膜通透性的影响
由表3可见,与哺乳组相比,断奶组血浆D-乳酸含量和二胺氧化酶活性在断奶后不同时间均显著提高(P<0.05)。断奶组在断奶后的不同时间肠黏膜通透性也发生了变化,断奶仔猪22、24和28日龄血浆D-乳酸含量和二胺氧化酶活性依次提高(P<0.05),至35日龄血浆D-乳酸含量和二胺氧化酶活性虽不再提高,但是仍显著高于哺乳组(P <0.05)。
2.3 断奶应激对仔猪p38 MAPK信号通路的激活
由表4可见,与22日龄断奶仔猪相比,24日龄p-p38 MAPK/p38 MAPK显著增加(P<0.05),并达到高峰,随后此比值随着日龄的延长逐渐降低。

表3 断奶应激对仔猪血浆D-乳酸含量和二胺氧化酶活性的影响Table 3 Effects of weaning stress on plasma D-lactate content anddiamine oxidase activity of piglets
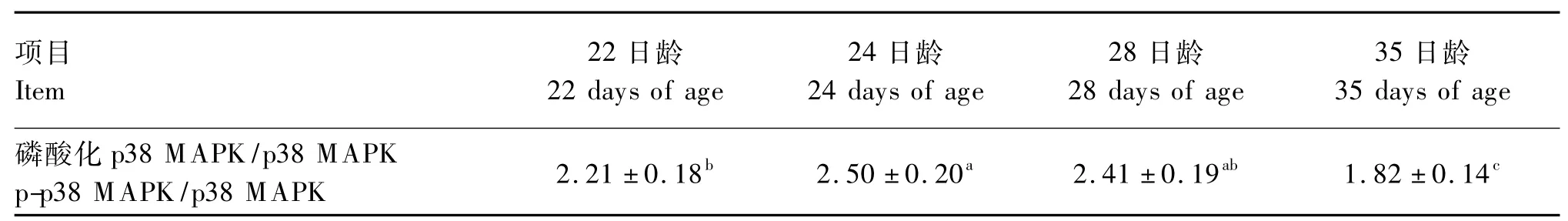
表4 断奶应激对p38 MAPK信号通路的影响Table 4 Effects of weaning stress on p38 MAPK signal pathway of piglets
3 讨论
胃肠道是养分消化吸收的主要场所。小肠是消化道内营养物质吸收和转运的主要部位,吸收是小肠绒毛的主要功能,隐窝则具有分泌能力,仔猪小肠黏膜结构的良好状态是养分消化吸收和正常生长的生理学基础。常用小肠肠绒毛高度降低与升高、隐窝深度增加与减少、绒毛高度与隐窝深度比值大小作为评价仔猪发育和营养水平等的重要指标[9]。已有研究报道,断奶后仔猪肠绒毛萎缩、脱落,隐窝增生,肠道通透性增加[2-3,10]。本试验证实了前人结果。断奶后仔猪空肠形态结构的变化可造成仔猪肠道消化吸收面积减少,消化能力下降,大量未消化物质堆积极易引起异常发酵,造成腹泻,最终影响仔猪的生长。本试验还发现,21日龄断奶后仔猪肠形态在1周后逐渐恢复,至35日龄肠形态基本恢复。
二胺氧化酶是哺乳动物肠绒毛上皮细胞的标记酶,其活性与绒毛高度和黏膜细胞的核酸和蛋白合成密切相关。生理情况下血浆中二胺氧化酶活性很低,在肠黏膜受损时,由肠黏膜释放入血的二胺氧化酶使血中含量上升,因此,外周血中二胺氧化酶活性能反映肠上皮细胞的完整性,可作为反映肠黏膜屏障功能损伤的理想指标[8,11]。D-乳酸是胃肠道固有细菌的代谢终产物,哺乳动物体内不具备将其快速代谢分解的酶系统,当肠黏膜生物屏障被破坏时,肠道中细菌产生的大量D-乳酸透过受损的肠黏膜进入血液循环,故血浆D-乳酸水平可及时反映肠黏膜损伤的程度和通透性变化[7]。本试验结果表明,与哺乳组相比,断奶组血浆D-乳酸含量和二胺氧化酶活性在断奶后不同时间均显著提高,说明断奶应激引起仔猪肠黏膜屏障受损,肠道通透性增加。本试验还发现,断奶仔猪35日龄血浆D-乳酸含量和二胺氧化酶活性仍显著高于哺乳组,而仔猪断奶后造成的肠形态损伤在35日龄基本恢复,说明肠道形态学上的恢复并未使肠上皮的内在结构和功能得到恢复,肠屏障功能的恢复滞后于肠形态的重建。常建星等[12]用大鼠失血性休克模型,研究了休克复苏后肠通透性与形态学改变的相关性,也发现应激状态下肠屏障严重受损,其通透性的恢复明显滞后于形态学重建。Prasad等[13]认为,肠形态的恢复只是肠上皮细胞重新生长,覆盖了肠绒毛表面,但正常的功能并未建立,重建的上皮细胞并未达到完全成熟,重建后的黏膜表面细胞所具有物质转运属性和超微结构特点不同于未损伤的上皮组织。肠黏膜细胞最初开始修复阶段仅仅是其细胞结构的建立,或者只是恢复了肠上皮细胞的连续性,其功能尚未开始恢复,而最终的修复不但要求新增殖的细胞代替损伤的黏膜细胞,而且还需要细胞外基质的改造及深部细胞恢复正常结构和功能[14-15]。
从细胞表面信号到基因表达所引起的生物学效应过程由多条信号转导途径介导,对于断奶应激引起仔猪肠屏障损伤的信号转导机制尚不清楚[4]。在多种情况下,蛋白磷酸化是信号传递至终端的重要方式,转录因子或与其相互作用的上游蛋白常常是磷酸化修饰的直接作用靶点。研究发现,肠道损伤所涉及的缺血、炎症、凋亡等多个病理机制与MAPKs信号道路的调节有关。p38 MAPK是MAPKs的重要成员之一。已证实p38 MAPK通路在肠损伤时被激活,磷酸化水平增加。p38 MAPK通路被激活后,通过磷酸化其底物,直接或间接影响多种转录因子的活性,进一步调节多种炎性细胞因子的基因表达,调控炎症反应和细胞凋亡,还能激活细胞内一些蛋白激酶,介导细胞骨架重构以及促进肠损伤后上皮细胞存活、增殖和修复过程[5-6]。另有研究发现,p38 MAPK 通路是肠道上皮细胞分化的关键调控因素。Broom等报道[16],炎症性肠疾病引起胞外信号调节激酶1/2(ERK1/2)、p38 MAPK 被激活,MAPKs激活时间、程度与肠损伤时间、程度一致。本研究发现,断奶应激显著增加了p-p38 MAPK/p38 MAPK,激活了p38 MAPK信号通路。
4 结论
①21日龄仔猪断奶后肠形态和肠黏膜屏障受损,虽然仔猪在35日龄肠形态基本恢复,但是肠道通透性仍未恢复,说明仔猪断奶后肠道通透性的恢复滞后于形态学重建。
②断奶应激激活了p38 MAPK信号通路。
感谢美国North Carolina State University兽医学院Moeser博士对本研究选题、构思和论文撰写给予的指导。
[1] KIM J C,HANSEN C F,MULLANA B P,et al.Nutrition and pathology of weaner pigs:nutritional strategies to support barrier function in the gastrointestinal tract[J].Animal Feed Science and Technology,2011,173(1/2):3 -16.
[2] BOUDRY G,PERON V,LE H L,et al.Weaning induces both transient and long-lasting modifications of absorptive,secretory and barrier properties of piglet intestine[J].The Journal of Nutrition,2004,134(9):2256-2262.
[3] HU C H,SONG J,YOU Z T,et al.Zinc oxide-montmorillonite hybrid influencesdiarrhea,intestinal mucosal integrity anddigestive enzyme activity in weaned pigs[J/OL].Biological Trace Element Research,2012,doi:10.1007/s12011-012-9422-9.
[4] MOESER A J,VANDER K C,RYAN K A,et al.Stress signaling pathways activated by weaning mediate intestinaldysfunction in the pig[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,292(1):G173 - G181.
[5] COSTANTINI T W,PETERSON C Y,KROLL L,et al.Role of p38 MAPK in burn-induced intestinal barrier breakdown[J].Journal of Surgical Research,2009,156(1):64-69.
[6] 郑曙云,付小兵,徐建国.MAPK信号传导通路与肠损伤后黏膜上皮修复[J].中国危重病急救医学,2004,16(1):59 -62.
[7] BRANDT R B,SIEGEL S A,WATERS M G,et al.Spectrophotometric assay for D-lactate in plasma[J].Analytical Biochemistry,1980,102(1):39 -46.
[8] 胡泉舟,侯永清,王猛.血中二胺氧化酶活性与仔猪腹泻程度的相关性分析[J].猪业科学,2007(12):73-74.
[9] LALLÈS J P,BOUDRY G,FAVIER C.Gut function anddysfunction in young pigs:physiology[J].Animal Research,2004,53:301 -316.
[10] 刘海萍,胡彩虹,徐勇.早期断奶对仔猪肠通透性和肠上皮紧密连接蛋白Occludin mRNA表达的影响[J].动物营养学报,2008,20(4):442 -446.
[11] WOLVEKAMP M C J,DE BRUIN R W F.Diamine oxidase:an overview of historical,biochemical and functional aspects[J].Digestive Diseases,1994,12(1):2-14.
[12] 常建星,黄子通,蒋龙元,等.肠屏障损伤后通透性与形态学改变的相关性研究[J].中国急救医学,2004,24:806 -807.
[13] PRASAD M,ITO S,SILEN W.Functional studies of in vitro ratdistal colon before and after restitution[J].Surgery,1997,121(4):430 -439.
[14] ITOH H,YAGI M,FUSHIDA S,et a1.Activation of immediate gene,c-fos and c-jun in the rat small intestine after ischemia-reperfusion injury[J].Transplantation,2000,69(4):598 -604.
[15] ITOH H,YAGI M,HASEBE K,et a1.Regeneration of small intestinal mucosa after acute ischemia-reperfusion injury[J].Digestive Diseases and Sciences,2002,47(12):2704 -2710.
[16] BROOM O J,WIDJAYA B,TROELSEN J,et a1.Mitogen activated protein kinases:a role in inflammatory boweldisease? [J].Clinical& Experimental Immunology,2009,158(3):272-280.
