饲粮中添加山梨酸对断奶仔猪生长性能、血清生化指标及相关基因mRNA表达的影响
2012-08-30王海峰方心灵朱晓彤王松波王丽娜江青艳
高 萍 王海峰 方心灵 束 刚 朱晓彤 王松波 王丽娜 江青艳
(华南农业大学动物科学学院,广州 510642)
仔猪断奶应激是长期困扰养猪生产的一个难题。为此,营养学家试图通过在断奶仔猪饲粮中添加外源性物质以缓解断奶应激,促进仔猪的生长。近年研究发现,游离脂肪酸对预防和治疗代谢综合征、胰岛素抵抗和癌症有显著的效果[1]。一些短链脂肪酸对改善肠道环境、调节肠道紊乱、治疗和预防肠道疾病有重要作用[2]。在动物生产中,脂肪酸作为功能性饲料添加剂目前研究较多的是共轭亚油酸,它在促进动物生长发育、降低腹脂沉积和改善肉质方面均具有重要的调节作用[3-5]。
山梨酸(sorbic acid,SA),学名为 2,4- 己二烯酸(CH3CH=CHCH=CHCOOH),是一种不饱和直链脂肪酸。在饲料工业上,SA作为酸化剂和防霉剂,具有调节仔猪胃肠道微生物种群平衡、降低腹泻率、促进营养物质消化吸收、抑制饲料霉菌生长等作用[1]。另外,SA可通过β氧化的代谢途径为机体提供能量,且对动物机体无毒副作用[2-3]。鉴于SA具有与共轭亚油酸相似的结构,其是否也具有与共轭亚油酸相似的促进仔猪生长发育以及调控脂代谢方面的作用均无相关报道。本试验以纯种大约克断奶仔猪为研究对象,参照共轭亚油酸和普通酸化剂的使用剂量,在基础饲粮中添加0.050%、0.125%和0.200%的 SA,研究其对断奶仔猪生长性能、血清生化指标及相关基因mRNA表达量的影响,旨在为SA在养猪生产中的合理应用提供试验依据。
1 材料与方法
1.1 试验材料
试验所用的SA均购自宁波王龙科技股份有限公司(食品级,纯度为99.0%)。
1.2 试验设计
试验选用28日龄纯种大约克断奶仔猪180头,按组间体重、性别比例一致的原则,将仔猪分成4组,每组3个重复,每个重复15头猪(8阉公、7母)。对照组饲喂基础饲粮,试验组分别在每千克基础饲粮中添加 0.500(0.050%SA 组)、1.250(0.125%SA 组)和 2.000 g(0.200%SA 组)的SA。预试期为7d,35日龄称仔猪初始重,试验期为42d。
基础饲粮组成及营养水平见表1。
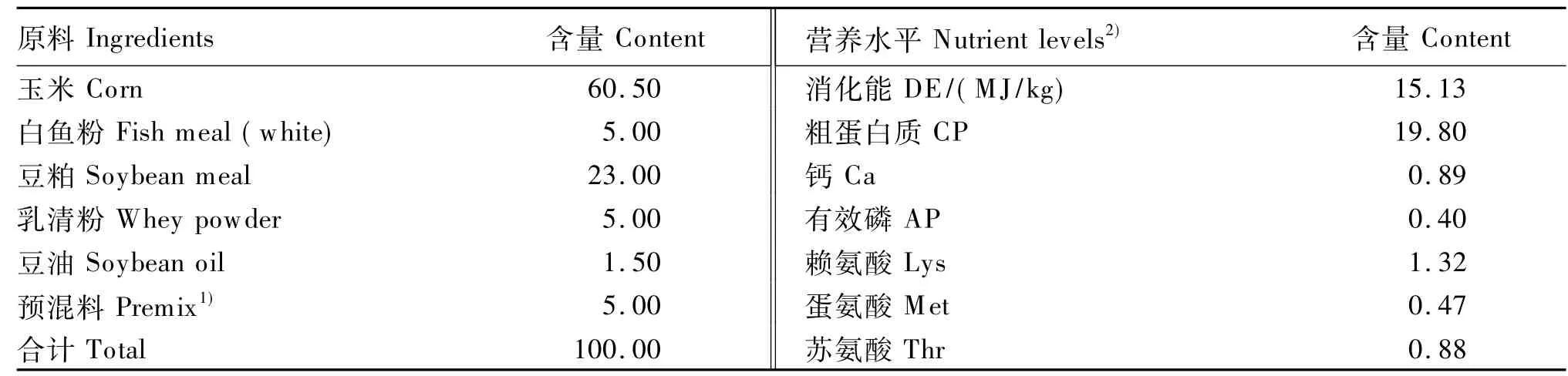
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basaldiet(air-dry basis) %
1.3 饲养管理
试验在湖北托佩克种猪有限公司保育舍内进行,饲养栏舍为封闭、漏缝地板式猪舍。猪只自由采食及饮水,按照常规免疫程序进行免疫接种。
1.4 测定指标及方法
1.4.1 生长性能测定
试验仔猪分别于35、56和77日龄称重(上午,空腹),计算各阶段及全期平均日增重;试验期记录喂料量和余料量;计算各阶段及全期平均日采食量和料重比。
1.4.2 血清生化相关指标测定
在35和77日龄时,每个重复随机选取6头仔猪(阉公和母各占1/2)于前腔静脉采血10 mL,制备血清,-20℃保存,测定血清中总蛋白(TP)、白蛋白(ALB)、尿素氮(UN)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量(由广州达安临床检验中心测定)。在77日龄时,用放射免疫分析法测定血清中胰岛素样生长因子-Ⅰ(IGF-Ⅰ)的含量,试剂盒购自天津九鼎医学生物工程有限公司。
1.4.3 小肠绒毛形态测定
在饲养试验结束当天,每个组随机选取5头仔猪(阉割小公猪)进行屠宰。取出十二指肠、空肠和回肠组织各2 cm,经PBS冲洗后,用10%甲醛溶液固定后制成肠道组织切片,在肠道组织切片上选取5~10个典型视野(绒毛平整、走向平直),观察肠绒毛和隐窝形态变化,运用肠道形态学分析软件测量肠绒毛高度和隐窝深度,取其平均值作为测定数据。对绒毛高度和隐窝深度进行统计,比较绒毛高度、隐窝深度和绒毛高度/隐窝深度的变化。
1.4.4 器官指数测定
在饲养试验结束当天,每个组随机选取5头仔猪(阉割小公猪)进行屠宰。分别对脾脏、心脏、肝脏和肾脏器官进行称重,计算器官指数。
器官指数(%)=(器官重/体重)×100。
1.4.5 相关基因表达量测定
在饲养试验结束当天,每个组随机选取5头仔猪(阉割小公猪)进行屠宰。采集背最长肌和肝脏样品,置液氮速冻,-80℃保存,采用TRIZOL一步法提取猪背最长肌和肝脏样品中的总RNA,总RNA样品用核酸蛋白测定仪测定其浓度及A260/A280,取0.5 μg 总 RNA 进行 1%琼脂糖凝胶电泳,检测其完整性。
取2 μg总 RNA立即用随机引物和MMLV(Promega公司,USA)进行反转录,根据 NCBI中Genbank发表的基因序列,采用Primer Premier 5.0软件设计猪β-肌动蛋白(β-actin)、IGF-Ⅰ和过氧化物酶体增殖物激活受体(PPARs)基因的上、下游引物(表2)。引物由北京奥科生物技术有限责任公司合成。
使用标准SYBR GreenⅠ实时定量PCR检测试剂盒(TaKaRa公司,日本)。20 μL反应体系:cDNA 模版(RT 产物)1.0 μL,引物(5 μmol/L)0.8 μL,2 × Real-time PCR Master Mix 10.0 μL,DEPC水补至 20.0 μL。PCR反应条件:95℃预变性1 min;95 ℃ 15 s,退火30 s,72 ℃ 30 s,40 个循环。同时记录PCR产物解离曲线,检验产物的特异性。
以β-actin作为内参基因,对获得的信号、数据进行处理,根据以下公式计算出目的基因相对于内参基因的比值:2-ΔCt=2-(Ct目的基因-Ct内参基因),反应体系置Mx3005P型实时定量PCR仪进行,数据用相对定量结果显示,以对照组为1。
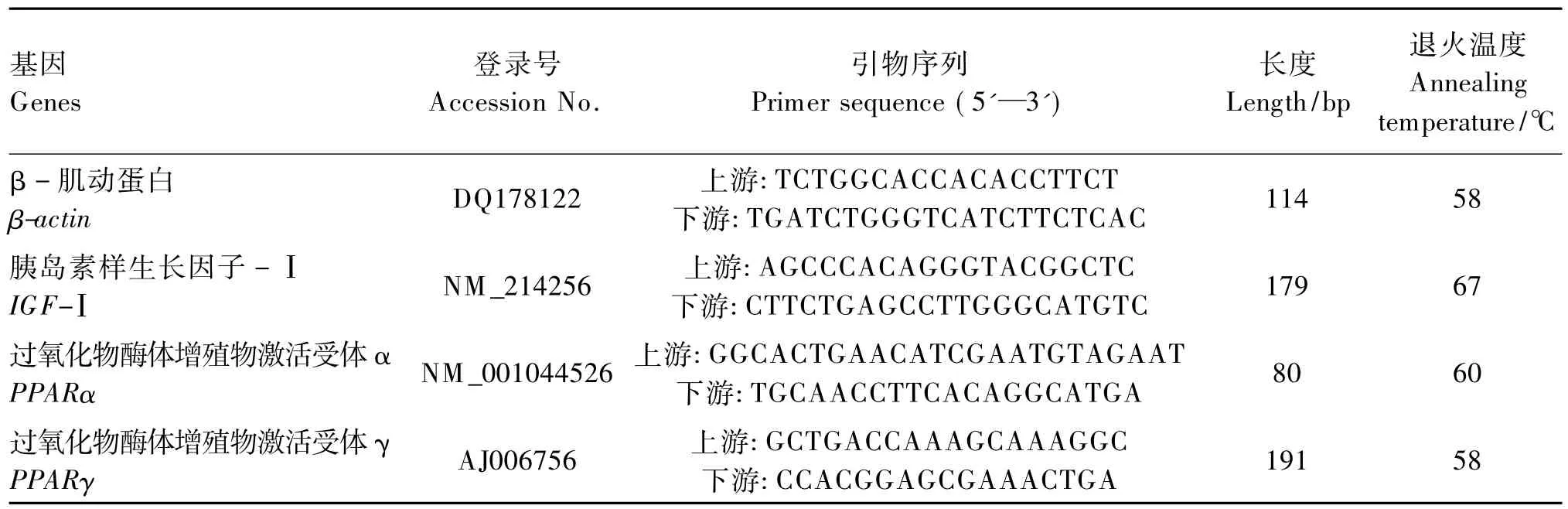
表2 猪基因引物序列及扩增参数Table 2 Gene primer sequences and amplification parameters of pig
1.5 数据处理
试验结果以平均值±标准误表示,用SAS 9.2统计软件进行统计,生长性能和血清生化指标采用单因素方差分析,并进行Tukey多重比较,小肠绒毛形态和基因表达采用独立样本t检验,P<0.05为差异显著。
2 结果
2.1 饲粮中添加SA对断奶仔猪生长性能的影响
由表3可知,0.200%SA组仔猪体重在56和77日龄时显著高于对照组(P<0.05);全期平均日增重也显著高于对照组(P<0.05);各组间平均日采食量和料重比无显著差异(P>0.05)。
2.2 饲粮中添加SA对断奶仔猪血清生化相关指标的影响
由表4可知,77日龄时,仔猪血清TP、LDL和IGF-Ⅰ的含量随SA添加剂量的加大而增加,其中0.200%SA 组显著高于对照组(P<0.05);而且在该日龄,血清 ALB、TG和 HDL的含量是0.125%SA组最高,而血清 UN含量是0.050%SA组最低,其中饲粮中添加0.050%和0.125%的SA和对照组相比均能显著提高血清ALB和HDL 的含量(P <0.05)。
2.3 饲粮中添加SA对断奶仔猪小肠绒毛形态的影响
由表5可知,十二指肠、空肠和回肠的绒毛高度、隐窝深度和绒毛高度/隐窝深度在0.200%SA组与对照组之间差异均不显著(P>0.05)。
2.4 饲粮中添加SA对断奶仔猪器官指数的影响
由表6可知,与对照组相比,饲粮中添加0.200%的SA对断奶仔猪心脏、脾脏、肝脏以及肾脏指数无显著性影响(P>0.05)。
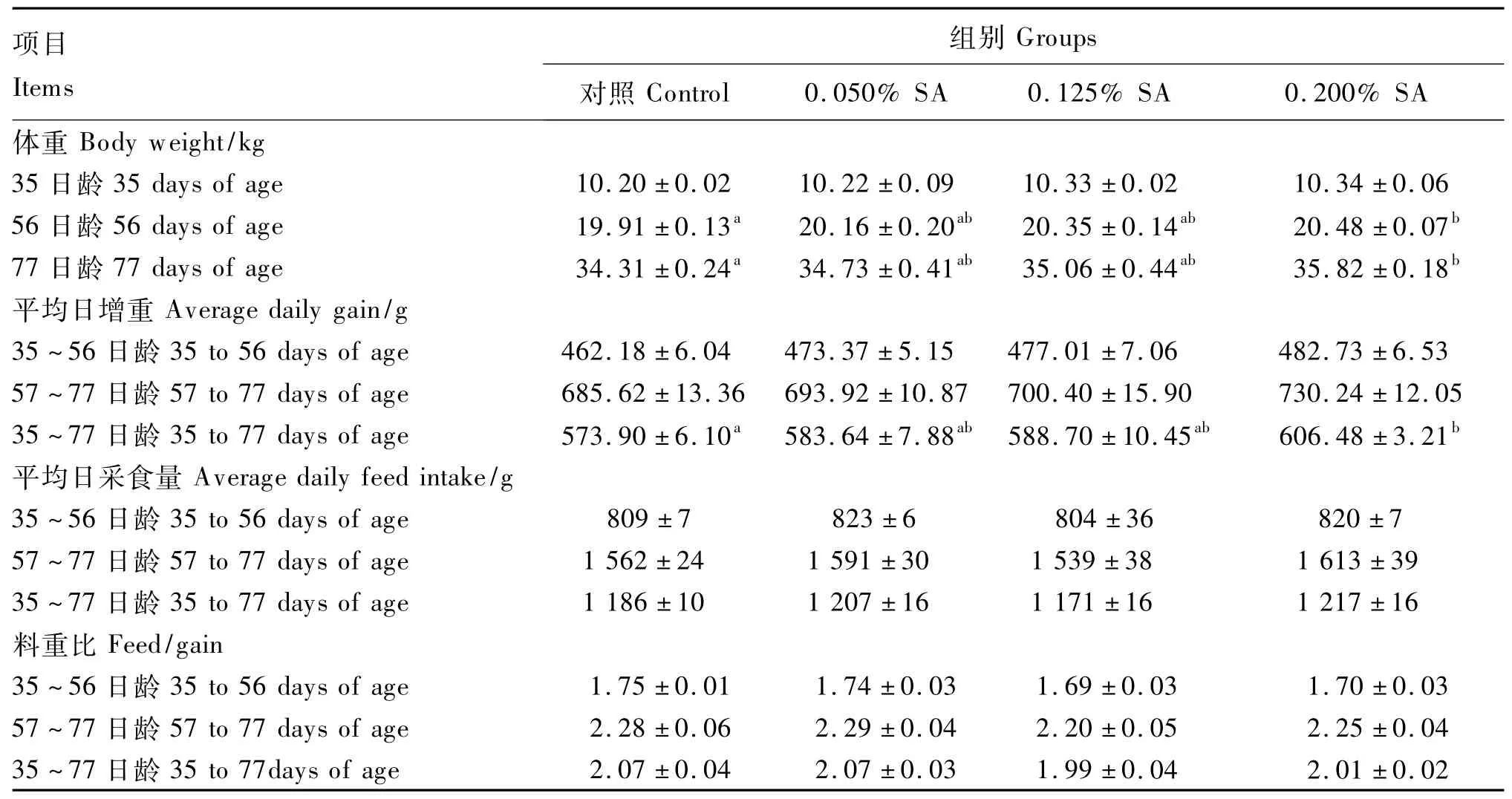
表3 饲粮中添加SA对断奶仔猪生长性能的影响Table 3 Effects ofdietary SA on growth performance of weaner piglets
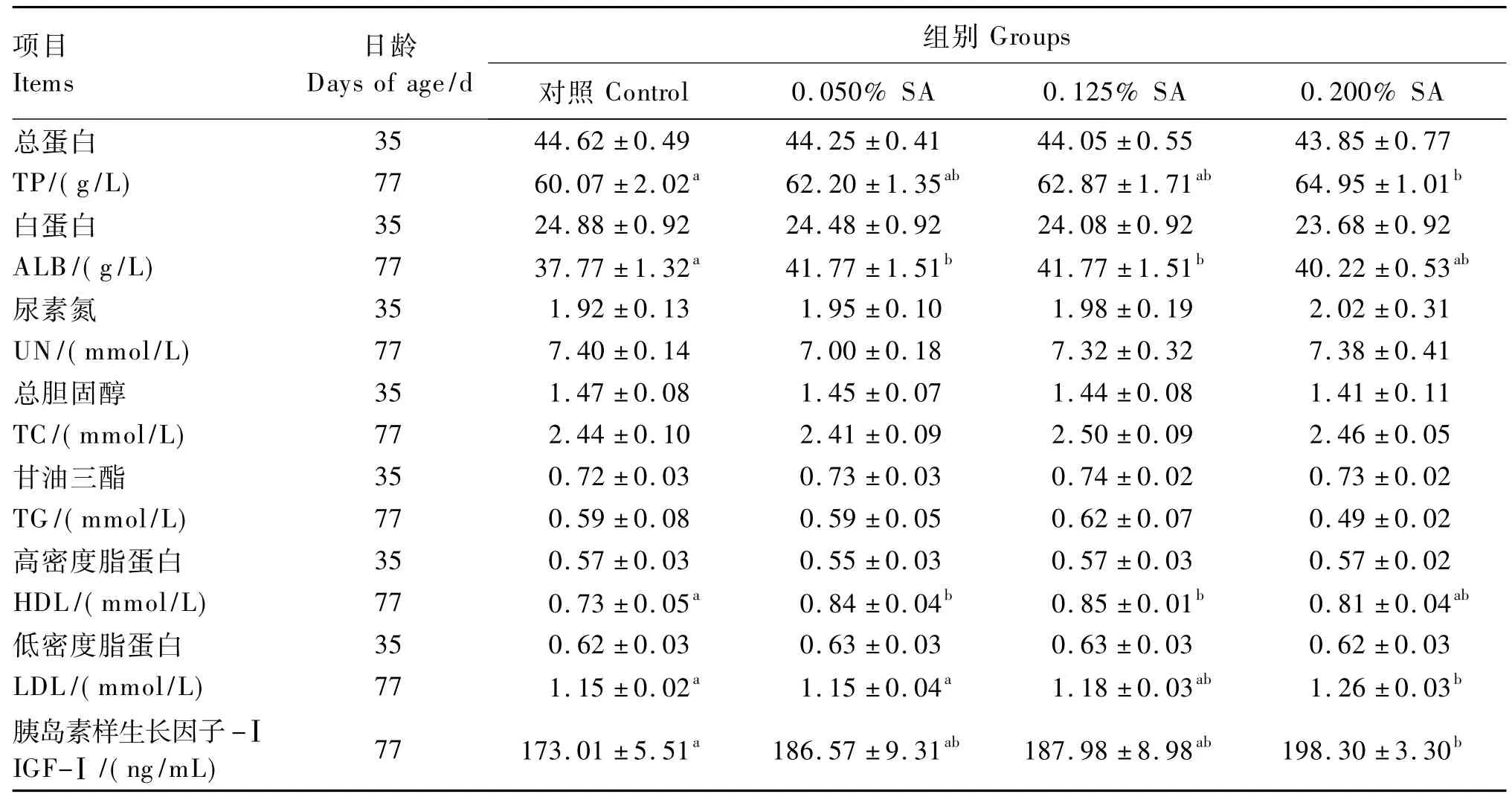
表4 饲粮中添加SA对断奶仔猪血清生化指标的影响Table 4 Effects ofdietary SA on serum biochemical indexes of weaner piglets
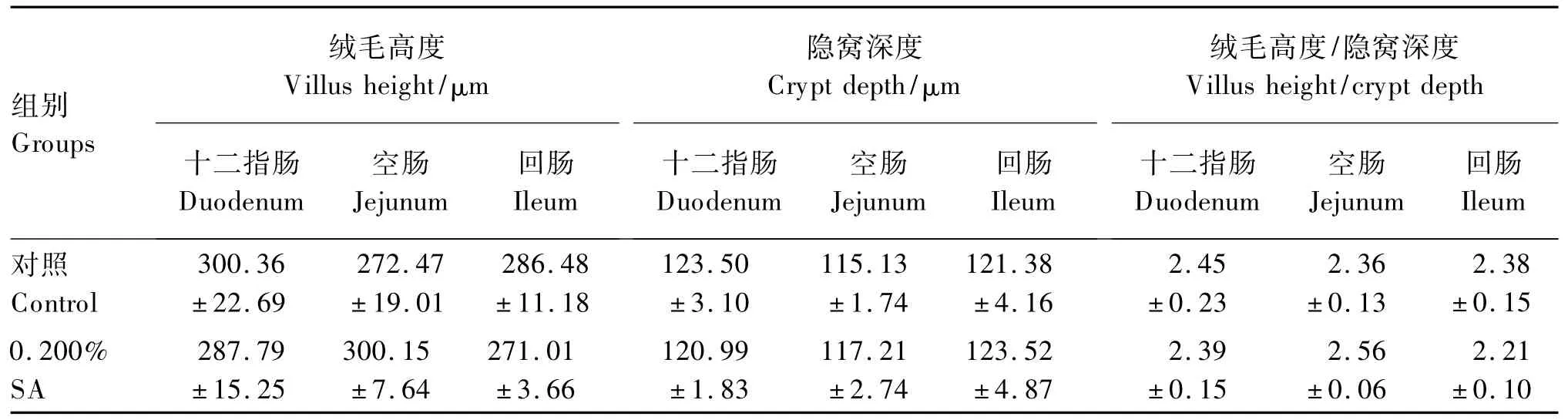
表5 饲粮中添加SA对断奶仔猪小肠绒毛形态的影响Table 5 Effects ofdietary SA on villus morphology of small intestine of weaner piglets

表6 饲粮中添加SA对断奶仔猪器官指数的影响Table 6 Effects ofdietary SA on organ indexes of weaner piglets %
2.5 饲粮中添加SA对断奶仔猪组织基因表达量的影响
由图1可知,与对照组相比,0.200%SA能降低肌肉PPARγ的mRNA表达量(P<0.05),具有促进肝脏IGF-ⅠmRNA表达的趋势(P=0.058),但对肝脏中PPARα及肌肉中IGF-Ⅰ mRNA表达量无显著影响(P>0.05)。

图1 饲粮中添加SA对断奶仔猪组织IGF-Ⅰ和PPARs mRNA表达的影响Fig.1 Effects ofdietary SA on IGF-Ⅰ and PPARs mRNA expression of weaner piglets
3 讨论
多不饱和脂肪酸不仅是动物的必需脂肪酸,而且在维持细胞膜的完整性、合成体内脂肪酸衍生物类激素、调节机体免疫机能、稳定糖脂代谢水平和改善肠道发育方面均具有重要的生物学功能。有研究表明,给断奶仔猪连续饲喂7周添加共轭亚油酸的饲粮,仔猪的平均日增重随共轭亚油酸的添加量增加而呈线性或二次曲线提高[6]。饲粮中添加富含n-3系列多不饱和脂肪酸的鱼油和富含n-6系列多不饱和脂肪酸的共轭亚油酸同样能使断奶仔猪日增重和饲料转化效率得到明显提高[6-7]。本研究结果同样发现,在试验各阶段饲粮中添加不同剂量的SA均有提高仔猪平均日增重的趋势,其中0.200%SA组能显著提高仔猪平均日增重。而从料重比的结果分析看,0.125%SA组仔猪对饲粮的利用效率最高,随着剂量增加至0.200%反而有所下降。因此,在生产实践中SA合理添加剂量可以介于0.125% ~0.200%。上述结果说明SA与其他具有相同共轭结构的直链脂肪酸一样,能调节动物的生长发育。
SA提高仔猪的生长性能的具体作用机制还存在争议。从有机酸制剂的角度来看,饲粮中添加酸制剂主要是通过降低动物肠道里消化物pH、改善消化酶的活性、抑制肠道微生物增殖、减少氨气和生物胺的产量等多种途径发挥作用。王杰等[8]研究表明,饲粮中添加0.2%的复合酸化剂还可以提高断奶仔猪对粗蛋白质的表观消化率。另有研究显示,饲粮中添加0.5%苯甲酸后可以显著提高断奶仔猪氮的消化率[9]。Pirgozliev 等[10]研究也发现,饲粮中添加SA可以降低氮的内源损失,提高氮的表观代谢能,这可能是由于添加SA提高了蛋白质和氨基酸的消化率,进而改善动物生长性能。但本研究结果表明,在77日龄时,饲粮中添加SA能够剂量依赖性地提高断奶仔猪血清TP含量,同时各组ALB含量也较对照组有不同程度地提高,而UN含量有降低的趋势。该结果说明SA能促进正氮平衡,提高营养素的利用效率。进一步检测肝脏和肌肉IGF-Ⅰ基因表达水平和血清中含量,结果发现添加SA均能提高77日龄血清IGF-Ⅰ含量。血液IGF-Ⅰ含量是全身各组织器官分泌IGF-Ⅰ的总体反映,其中以肝脏分泌为主,而肌肉组织亦可表达IGF-Ⅰ,主要以自分泌方式调节肌肉生长发育。本研究发现,饲粮添加SA对肌肉IGF-Ⅰ mRNA表达无显著影响,但对肝脏IGF-Ⅰ mRNA表达具有明显的促进趋势。上述结果提示SA可能通过促进肝脏IGF-Ⅰ的分泌,从而促进动物的生长。
血液IGF-Ⅰ含量是反映动物机体生长发育的重要激素,既受生长轴的精细调控,同时又受到各种营养物质含量的影响。其中脂肪酸,尤其是不饱和长链脂肪酸,可以通过其内源性PPARs直接调节肝脏IGF-Ⅰ的分泌。Lecka-czernik等[11]研究显示,饲粮中添加罗格列酮(PPARγ的人工合成激动剂)能够显著影响大鼠血清IGF-Ⅰ的含量,并且证实是通过PPARγ途径介导的。本实验室前期研究发现,肝脏PPARα的活性对IGF-Ⅰ分泌也有调节作用,其中 GW7647(PPARα激动剂)促进IGF-Ⅰ分泌,而GW9622(PPARγ阻断剂)则抑制其分泌[12]。本研究结果表明,饲粮中添加0.200%SA有上调肝脏IGF-Ⅰ mRNA表达的趋势,而对肌肉中IGF-Ⅰ mRNA表达丰度则无显著影响,提示SA的促IGF-Ⅰ分泌作用很可能与肝脏PPARs系统有关。通常PPARs配体在激活或阻断PPARs以外,还能够调节该受体的基因表达水平。Kang等[13]研究发现顺-10,反-12共轭亚油酸能抑制脂肪组织PPARγ的表达水平,从而降低小鼠脂肪沉积。本文研究结果也发现,SA也可以显著降低肌肉组织PPARγ mRNA的表达水平,提示SA可能在减少脂肪沉积,改善胴体品质方面同样具有重要的应用潜能。
另一方面,由于饲粮形态、饲粮抗原及仔猪本身营养供给的不足,仔猪断奶过程中肠道形态和结构往往发生绒毛萎缩、隐窝加深等退行性变化。有研究表明,某些脂肪酸也可以通过促进胃肠道发育,改善肠道健康,从而提高仔猪生长性能。Bosi等[14]研究表明,饲粮中添加包被的甲酸钙显著提高了仔猪小肠绒毛高度和平均日增重。Jurkowska等[15]报道,饲粮中添加短链脂肪酸可以显著增加远段空肠及回肠的隐窝深度、绒毛高度和黏膜厚度,显著降低十二指肠的黏膜厚度。Claus等[16]研究发现,在饲粮中添加包被的丁酸盐可增加猪空肠中段皱襞面积。晏家友等[17]研究也表明,二元杂交(大×长)仔猪饲粮中添加以延胡索酸、乳酸、柠檬酸和苹果酸为主要成分的复合酸化剂,极显著降低试验第5周时仔猪的空肠隐窝深度和提高绒毛高度/隐窝深度。但本研究结果并未发现饲粮中添加0.200%SA对仔猪各肠段的隐窝深度和绒毛高度/隐窝深度有显著影响,说明SA对断奶仔猪的促生长作用可能并非通过促进肠道发育而实现。
4 结论
①饲粮中添加SA有剂量依赖性提高断奶仔猪的体重和平均日增重的趋势,其中以0.125% ~0.200%剂量的效果较好。
②在本试验条件下,饲粮中添加适宜的SA可提高仔猪血清 TP、LDL、ALB、HDL 和 IGF-Ⅰ的含量,但对小肠黏膜形态以及脾脏、心脏、肝脏、肾脏器官指数均无显著影响。
③饲粮中添加0.200%SA能够促进断奶仔猪生长,其作用可能是通过PPARs系统提高血清IGF-Ⅰ的含量而实现的。
[1] HSU I R,KIM S P,KABIR M,et al.Metabolic syndrome,hyperinsulinemia,and cancer[J].American Journal of Clinical Nutrition,2007,86(3):867-871.
[2] HIJOVA E,CHMELAROVA A.Short chain fatty acids and colonic health[J].Bratislavské Lekárske Listy,2007,108(8):354-358.
[3] SWIERCZYNSKI J,WOLYNIEC W,CHMIELEWSKI M,et al.Molecular mechanism of fatty acids impact on plasma lipid profile(part I)[J].Przeglad Lekarski,2007,64(1):37-41.
[4] PENG Y,REN F,YIN J D,et al.Transfer of conjugated linoleic acid from sows to their offspring and its impact on the fatty acid profiles of plasma,muscle,and subcutaneous fat in piglets[J].Journal of Animal Science,2010,88(5):1741-1751.
[5] 肖成林,田春庄,彭健.饲粮中添加鱼油对母猪繁殖性能和仔猪生长性能的影响[J].养猪,2007(3):4-7.
[6] LIU Y,GONG L,LI D,et al.Effects of fish oil on lymphocyte proliferation,cytokine production and intracellular signalling in weanling pigs[J].Archiv für Tierernährung,2003,57(3):151-165.
[7] LAI C,YIN J,LI D,et al.Effects ofdietary conjugated linoleic acid supplementation on performance and immune function of weaned pigs[J].Archives of Animal Nutrition,2005,59(1):41-51.
[8] 王杰,陈玉林.复合酸化剂对断奶仔猪生产性能和饲料表观消化率的影响[J].黑龙江畜牧兽医,2010(13):77-79.
[9] WANG J P,YOO J S,LEE J H,et al.Effects of phenyllactic acid on growth performance,nutrientdigestibility,microbial shedding,and blood profile in pigs[J].Journal of Animal Science,2009,87(10):3235-3243.
[10] PIRGOZLIEV V,MURPHY T C,OWENS B,et al.Fumaric and sorbic acid as additives in broiler feed[J].Research in Veterinary Science,2008,84(3):387-394.
[11] LECKA-CZERNIK B,ACKERT-BICKNELL C,ADAMO M L,et al.Activation of peroxisome proliferator-activated receptor gamma(PPAR gamma)by rosiglitazone suppresses components of the insulin-like growth factor regulatory system in vitro and in vivo[J].Endocrinology,2007,148(2):903-911.
[12] FANG X L,SHU G,ZHANG Z Q,et al.Roles of αlinolenic acid on IGF-I secretion and GH/IGF system gene expression in porcine primary hepatocytes[J/OL]Molecular Biology Reports,2012,doi:10.1007/s11033-012-2000-6.
[13] KANG K,LIU W,ALBRIGHT K J,et al.Trans-10,cis-12 CLA inhibitsdifferentiation of 3T3-L1 adipocytes anddecreases PPAR gamma expression[J].Biochemical and BiophysicalResearch Communications,2003,303(3):795-799.
[14] BOSI P,SARLI G,CASINI L,et al.The influence of fat protection of calcium formate on growth and intestinaldefence in escherichia coli k88-challenged weanling pigs[J].Animal Feed Science and Technology,2007,139(3/4):170-185.
[15] JURKOWSKA M,WOLINSKI J,NIZIO A.Effects of sodium butyrate on small intestinal tunica mucosa histology in neonatal piglets[J].Folia Universitatis Agriculturae Stetinensis Zootechnica,2003,45:21-24.
[16] CLAUS R,GUNTHNER D,LETZGUSS H.Effects of feeding fat-coated butyrate on mucosal morphology and function in the small intestine of the pig[J].Journal of Animal Physiologyand Animal Nutrition,2007,91(7/8):312-318.
[17] 晏家友,贾刚,王康宁.缓释复合酸化剂与抗生素联合使用对断奶仔猪肠道微生物及肠黏膜抗体的影响[J].猪业科学,2009(9):88-91.
