MiR-29c在大鼠肾间质成纤维细胞中的抗纤维化作用
2012-08-21黄慧雅苏震薛向阳谢媚媚余业成
黄慧雅,苏震,薛向阳,谢媚媚,余业成
(温州医学院,浙江 温州 325000,1.附属第一医院 肾内科;2.微生物学与免疫学教研室;3.仁济学院 临床医学系)
肾间质纤维化是各种肾脏疾病发展到终末期肾衰的公共通路。肾脏纤维化牵涉到细胞外基质(extracellular matrixc,ECM)的过度沉积和上皮间质细胞转分化(epithelial-mesenchymal transition,EMT)过程。
microRNA(简称miRNA)是近年来新发现的长22个核苷酸的内源性非编码单链小RNA分子,主要作用是抑制基因表达,在转录水平上保证基因表达的准确性。研究表明miRNAs能抑制三分之一以上的人类基因[1]。miRNAs在心脏[2-3]、肺[4]、肝脏[5]、皮肤[6-7]中作为组织纤维化的调节因子,在肾脏纤维化中,miRNAs通过转化生长因子(transforming growth factor-β,TGF-β)信号通路来调节肾小管上皮细胞转分化[8-9]。目前已有研究报道在肝脏、心脏、肺、皮肤纤维化过程中,miR-29c表达均下调[2,5-6,10-11]。我们的前期研究通过建立单侧输尿管梗阻(UUO)大鼠模型及5/6大鼠肾大部切除模型,发现随肾组织纤维化的进展,miR-29c表达逐渐下调。
本研究中我们采用TGF-β1诱导肾间质成纤维细胞转分化,观察miR-29c及胶原I(Col I)表达变化,通过脂质体转染的方式使miR-29c过表达,检测转染的miR-29c对ECM的影响。
1 材料和方法
1.1 材料 大鼠肾间质成纤维细胞株(NRK-49F,美国模式培养物集存库),含10%胎牛血清(FBS)的DMEM/F12培养基(GIBICO公司,美国),转染试剂LipofectamineTM2000 Reagent(Invitrogen公司,美国),TGF-β1(R&D公司,美国),小鼠抗大鼠α-SMA单克隆抗体(Abcam公司,美国),兔抗大鼠Col I单克隆抗体(Merk公司,德国),小鼠抗大鼠β-actin单克隆抗体(Santa Cruz公司,美国),山羊抗小鼠IgG(Abcam公司,美国),山羊抗兔IgG(Santa Cruz公司,美国),Trizol reagent(Invitrogen公司,美国)。
1.2 方法
1.2.1 细胞培养及TGF-β1诱导转分化:大鼠NRK-49F细胞用含10% FBS的DMEM/F12培养液,置于5%CO2、37 ℃培养箱内培养,以1:3传代。待细胞80%融合时,0.1% BSA培养16 h后,用TGF-β1刺激细胞转分化:①用不同浓度(0.1、1、2、5、10 ng/mL)TGF-β1对NRK-49F进行刺激,并且设空白对照组,各组细胞分别培养24 h;②用TGF-β12 ng/mL对NRK-49F进行刺激,分别在培养0、6、12、24 h后收集细胞。
1.2.2 化学合成的miR-29c mimics转染细胞:miRNA mimics是化学合成的miRNA,通过LipofectminTM2000脂质体转染的方式将其转染进入细胞。转染前1 d细胞传代铺板,待细胞生长至60%~80%,将LipofectminTM2000加入培养液中静置5 min,再与miR-29c mimics/inhibitor(1:1)混匀后静置15 min,将混合液加入细胞中8 h,换用0.1% BSA的DMEM/F12培养液饥饿8 h后收取细胞。分组如下:空白对照组、转染miR-29c mimics 25 nmol/L组、mimics 50 nmol/L组、mimics 75 nmol/L组、miR-29c mimics阴性对照组、miR-29c inhibitor组、miR-29c inhibitor阴性对照组。
1.2.3 转染miR-29c mimics后TGF-β1刺激NRK-49F细胞株:按1.2.2转染步骤将miR-29c mimics转染入NRK-49F细胞中,8 h后换用0.1% BSA的DMEM/F12培养液再饥饿8 h,加入2 ng/mL TGF-β1刺激24 h后收集各组细胞。分:空白对照组、TGF-β1组、miR-29c mimics组、miR-29c mimics+TGF-β1组、miR-29c mimics阴性对照组、miR-29c mimics阴性对照+TGF-β1组、miR-29c inhibitor组、miR-29c inhibitor+TGF-β1组、miR-29c inhibitor阴性对照+TGF-β1组。miR-29c mimics及inhibitor浓度均为50 nmol/L。
1.2.4 Realtime PCR法检测各组细胞miRNA、Col I和胶原III(ColIII)、纤连蛋白(FN)、α-平滑肌肌动蛋白(α-SMA)mRNA的表达:采用Trizole一步法抽提总RNA。取1μL RNA溶液,紫外分光光度计分别测波长260 nm和280 nm的光密度(OD)值,并计算RNA的浓度。
cDNA反应条件:70 ℃ 10 min 预变性,42 ℃60 min,70 ℃ 15 min,逆转录成cDNA,反应产物用DEPC水稀释2.5倍,于-20 ℃保存。以cDNA为模板,进行Realtime PCR扩增。PCR反应条件:预变性95 ℃ 2 min,变性95 ℃ 30 s,退火60 ℃30 s,40个循环。至少重复6次。
Realtime PCR数据分析采用定量PCR中的相对定量法,记录各样本荧光动力曲线图和溶解曲线图,记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数即Ct值,目的基因的相对量=2-△△Ct,在该公式中,△△Ct=[Ct目的基因(待测样品)-Ct内参(待测样品)]-Ct目的基因(校正样品)-Ct内参(校正样品)]。
1.2.5 Western blot法检测细胞α-SMA、Col I的表达:收获细胞,裂解后抽提总蛋白,BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳,上样量50μg,转膜后加入单抗[α-SMA单克隆抗体(1:250)、Col I单克隆抗体(1:1000)、β-actin单克隆抗体(1:1000)]4 ℃孵育过夜,洗涤,加入HRP标记的二抗[辣根过氧化酶标记的IgG(1:2000)]孵育2 h,化学发光法曝光。各组实验至少重复3次。
1.3 统计学处理方法 采用SPSS16.0软件进行统计学分析。组间比较采用单因素方差分析,两组均数之间采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1对NRK-49F细胞中Col I、Col III、α-SMA、FN mRNA和α-SMA蛋白的影响 不同浓度(0.1、1、2、5、10 ng/mL)TGF-β1刺激NRK-49F 24 h后,Realtime PCR分析Col I、ColIII、α-SMA、FN mRNA表达,结果显示,与空白对照组比较,2、5、10 ng/mL TGF-β1浓度组其ColI、ColIII、α-SMA mRNA表达明显上调,并呈浓度依赖性(P<0.05)。10 ng/mL TGF-β1浓度组FN表达上调(P<0.05),见表1。Western blot法检测结果提示随着TGF-β1刺激NRK-49F的浓度增加,α-SMA蛋白表达逐渐上调,呈浓度依赖性增高(见图1A)。TGF-β1在2 ng/mL浓度下,Col I及α-SMA蛋白表达均明显升高(P<0.05,见图2A-B)。2 ng/mL浓度TGF-β1刺激NRK-49F细胞0、6、12、24 h,ColI、ColIII、α-SMA、FN mRNA表达上调(P<0.05,见表2);且α-SMA蛋白表达上调,呈时间依赖性(见图1B)。在TGF-β1刺激24 h时,ColI、ColIII、FN及α-SMA蛋白上调最为显著。
表1 Realtime PCR检测不同浓度TGF-β1刺激细胞24 h后ColI、ColIII、FN、α-SMA mRNA及miR-29c表达变化(n=4±s)

表1 Realtime PCR检测不同浓度TGF-β1刺激细胞24 h后ColI、ColIII、FN、α-SMA mRNA及miR-29c表达变化(n=4±s)
与0 ng/mL组比:aP<0.05,bP<0.01
TGF-β1浓度(ng/mL)10 1.43±0.40b 3.08±0.94b 2.55±0.81a 1.51±0.32a 0.14±0.20b 0 0.1 1.13±0.17 1.61±0.67 1.04±0.06 0.98±0.12 1.05±0.25 1 2 5 ColI ColIII α-SMA FN miR-29c 1±0 1±0 1±0 1±0 1±0 1.21±0.24a 2.15±0.41 1.35±0.26a 1.21±0.18 0.59±0.30 1.58±0.75a 2.04±0.59b 1.8±0.51a 1.7±0.56 0.53±0.24b 1.53±0.39b 2.39±0.61b 1.82±0.27b 1.64±0.71 0.32±0.12b
表2 Realtime PCR检测2 ng/mL TGF-β1刺激细胞不同时间后ColI、ColIII、FN、α-SMA mRNA及miR-29c表达变化(n=4±s)
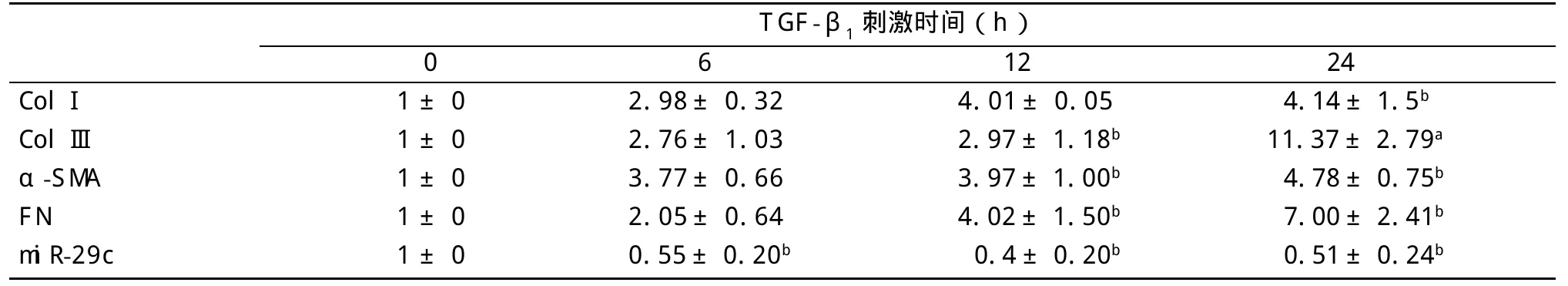
表2 Realtime PCR检测2 ng/mL TGF-β1刺激细胞不同时间后ColI、ColIII、FN、α-SMA mRNA及miR-29c表达变化(n=4±s)
与0 h组比:aP<0.05,bP<0.01
TGF-β1刺激时间(h)0 6 ColI ColIII α-SMA FN miR-29c 1±0 1±0 1±0 1±0 1±0 2.98±0.32 2.76±1.03 3.77±0.66 2.05±0.64 0.55±0.20b 12 4.01±0.05 2.97±1.18b 3.97±1.00b 4.02±1.50b 0.4±0.20b 24 4.14±1.5b 11.37±2.79a 4.78±0.75b 7.00±2.41b 0.51±0.24b

图1 TGF-β1刺激NRK-49F后α-SMA表达变化
结果显示,2 ng/mL TGF-β1刺激NRK-49F细胞24 h后,促进NRK-49F转分化为肌成纤维细胞,促进ECM合成及α-SMA表达上调。
2.2 TGF-β1对NRK-49F细胞中miR-29c的影响 不同浓度 TGF-β1(0、0.1、1、2、5、10 ng/mL)刺激NRK-49F细胞24 h,Realtime PCR分析结果显示,随着TGF-β1浓度增加,细胞内miR-29c表达逐渐下降。TGF-β1浓度为2 ng/mL开始,同对照组相比差异具有统计学意义(P<0.05,见表1)。
2 ng/mL TGF-β1刺激NRK-49F细胞0、6、12、24 h后,Realtime PCR分析结果显示,随着TGF-β1作用时间的延长,细胞内miR-29c表达下调,在TGF-β1作用6 h开始,同对照组相比差异具有统计学意义(P<0.05,见表2)。
2.3 过表达miR-29c后ColI表达下降 运用化学合成的miR-29c mimics(使miR-29c过表达),用脂质体转染的方法,转染入NRK-49F细胞株。Realtime PCR分析显示,在转染入miR-29c mimics 8 h后,与空白对照组相比,NRK-49F细胞株中miR-29c的表达水平至少增加了243倍。在NRK-49F细胞株中过表达miR-29c导致了ColI、ColIII mRNA表达下调,与miR-29c mimics呈明显的浓度依赖性(P<0.05,见表3)。50 nmol/L miR-29c mimics转染NRK-49F细胞株后,ColI蛋白表达较空白对照组下调,提示了在miR-29c mimics作用下,ColI转录减少(见图2A)。但是抑制miR-29c(miR-29c inhibitor 50 nmol/L)后,NRK-49F细胞株中,ColI的mRNA表达无明显变化(P>0.05,见表3),而其蛋白表达升高(见图2B)。
2.4 在NRK-49F中miR-29c与TGF-β1联合作用对ColI、α-SMA表达的作用 TGF-β1能刺激NRK-49F细胞株表达ColI、α-SMA(P<0.05,见表1-2、图2)。而在转染miR-29c mimics 50 nmol/L后,用2 ng/mL TGF-β1刺激NRK-49F细胞株24 h,发现ColI及α-SMA mRNA及蛋白表达(与对照组相比)不升高(P>0.05,见表4、图2A)。
表3 转染不同浓度miR-29c mimics/inhibitor对ColI及ColIII mRNA的影响(n=4±s)

表3 转染不同浓度miR-29c mimics/inhibitor对ColI及ColIII mRNA的影响(n=4±s)
(A:空白对照组;B:25nmol/L mimics组;C:50nmol/L mimics组;D:75nmol/L mimics组;E:mimics阴性对照组;F:50 nmol/L inhibitor组;G:inhibitor阴性对照组)与A组比:aP<0.05,bP<0.01
?
表4 转染不同浓度miR-29c mimics/inhibitor后加入2 ng/mL TGF-β1刺激24 h对ColI及ColIII mRNA的影响(n=4±s)

表4 转染不同浓度miR-29c mimics/inhibitor后加入2 ng/mL TGF-β1刺激24 h对ColI及ColIII mRNA的影响(n=4±s)
(A:空白对照组;B:25nmol/L mimics+TGF-β1组;C:50nmol/L mimics+TGF-β1组;D:75nmol/L mimics+TGF-β1组;E:mimics阴性对照+TGF-β1组;F:50nmol/L inhibitor+TGF-β1组;G:inhibitor阴性对照+TGF-β1组)与A组比:aP<0.05,bP<0.01
?

图2 转染 miR-29c mimics/inhibitor对TGF-β1促转分化的作用
3 讨论
肾间质纤维化是以肾小管基底膜的增厚和间质成分如I型、III型、IV胶原和FN的增多、基质的堆积为特征。表达α-SMA的肌成纤维细胞不仅是ECM的主要来源,也是肾脏疾病进展过程中的重要标志[12]。TGF-β1促进肾脏胶原蛋白的产生和沉积,促使肾小管上皮细胞和肾间质成纤维细胞向肌成纤维细胞转分化,是肾脏纤维化启动及进展的主要细胞因子。肌成纤维细胞是导致肾脏纤维化的关键细胞,它具有很强的合成ECM能力,在肾脏纤维化中起主要作用。TGF-β1促使NRK-49F细胞株中ColI、ColIII、FN及α-SMA表达升高,并具有促进NRK-49F细胞株增殖的作用,具有剂量依赖及时间依赖效应[13-14]。
miR-29家族成员包括miR-29a、miR-29b-1、miR-29b-2和miR-29c[15]。在大鼠心、肝、脾、肺、脑、肾组织中均发现miR-29家族成员(miR-29a/b/c)表达,尤其在大脑、肺、心及肾脏中miR-29c表达很高[2]。miR-29涉及到肺间质上皮转分化、骨骼肌细胞分化,抑制心肌纤维化及系统性硬化[2,6,15-18]。在鼻咽癌及心肌梗死导致的心脏纤维化中,miR-29的下调同胶原增加呈负相关[2,16]。miR-29家族能够抑制ECM的产生[10,16,19-22]。miR-29家族可在肝脏星形细胞及心脏成纤维细胞中表达,且均在TGF-β1的刺激下表达下降[22-23]。但是,目前尚鲜有关于miR-29家族(miR-29a/b/c)在肾间质成纤维细胞内作用的研究报道。
本课题组前期用茎环Realtime PCR检测5/6大鼠肾大部切除模型及UUO模型的肾组织中的miRNAs表达变化,用高通量测序技术(Solexa测序)检测在术后1 d和术后3 d处死的UUO大鼠手术侧与非手术侧肾脏组织中miRNAs的表达,均发现随着肾间质纤维化的进展,miR-29c表达明显下降,而miR-29a/b在肾间质纤维化中变化不显著,因此,我们在本研究中选用miR-29c作为研究对象。
查阅肾脏纤维化过程中与ECM产生积聚相关的一系列基因,它们均包含有多个miR-29c的种子序列相对应的碱基(见图3),说明miR-29c的下调同肾脏纤维化相关。本研究提示在TGF-β1诱导NRK-49F细胞纤维化过程中miR-29c表达下调,miR-29c mimics通过有效抑制TGF-β1刺激NRK-49F细胞株ColI表达起到抗纤维化作用,表明miR-29c为抑制纤维化的基因;人工合成的miR-29c mimics转染NRK-49F细胞株能有效提高miR-29c表达量从而抑制ColI表达。

图3 miR-29与其靶基因相对应的种子序列
van Rooij等[2]人在心肌纤维化模型中发现miR-29家族表达下调,构建荧光素酶报告基因载体证实编码ColI、ColIII及FN等多种ECM成分的mRNAs是miR-29家族的靶基因。Ogaw等将miR-29b的前体转染到未激活的肝星状细胞中,能够显著抑制ColI的表达[23]。可见,ColI为miR-29c的靶基因,miR-29c能抑制其表达。在肾间质纤维化发生时或发生前,维持细胞的miR-29表达可抑制或延缓纤维化进展。因此,化学合成的miRNA mimics通过维持miR-29c的表达从而延缓或抑制纤维化过程;miR-29c对靶基因的转录及翻译均有抑制作用,化学合成的单链RNA分子miR-29c inhibitor转染至细胞后结合到成熟的miRNA上,特异性抑制miR-29c功能,使胶原蛋白翻译增加,而不影响其转录。
总之,本研究发现miR-29c能作用于肾间质成纤维细胞,使得ColI表达下调。显示了miR-29c在肾间质成纤维细胞中有抗纤维化作用:miR-29c mimics通过有效抑制TGF-β1刺激NRK-49F细胞株ColI表达起到抗纤维化作用,为治疗肾间质纤维化提供了一个新的靶点。
[1] Hornstein E, Mansfield JH, Yekta S, et al. The microRNA miR-196 acts upstream of Hoxb8 and Shh in limb development[J]. Nature,2005,438(7068):671-674.
[2] van Rooij E, Sutherland LB, Thatcher JE,et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proc Natl Acad Sci USA,2008,105(35):13027-13032.
[3] Patrick DM, Montgomery RL, Qi X, et al. Stress-dependent cardiac remodeling occurs in the absence of microRNA-21 in mice[J]. J Clin Invest,2010,120(11):3912-3916.
[4] Pandit KV, Milosevic J, Kaminski N. MicroRNAs in idiopathic pulmonary fibrosis[J].Transl Res,2011,157(4):191-199.
[5] Li J, Zhang Y, Kuruba R, et al. Roles of microRNA-29a in the antifibrotic effect of farnesoid X receptor in hepatic stellate cells[J]. Mol Pharmacol,2011,80(1):191-200.
[6] Maurer B, Stanczyk J, Jungel A, et al. MicroRNA-29, a key regulator of collagen expression in systemic sclerosis[J].Arthritis Rheum,2010,62(6):1733-1743.
[7] Cheng J, Yu H, Deng S,et al. MicroRNA profiling in mid- and late-gestational fetal skin: implication for scarless wound healing[J]. Tohoku J Exp Med,2010,221(3):203-209.
[8] Gregory PA, Bracken CP, Smith E, et al. An autocrine TGF-beta/ZEB/miR-200 signaling network regulates establishment and maintenance of epithelial-mesenchymal transition[J].Mol Biol Cell,2011,22(10):1686-1698.
[9] Wang B, Herman-Edelstein M, Koh P,et al. E-cadherin expression is regulated by miR-192/215 by a mechanism that is independent of the profibrotic effects of transforming growth factor-beta[J]. Diabetes,2010,59(7):1794-1802.
[10] Ogawa T, Iizuka M, Sekiya Y, et al. Suppression of type I collagen production by microRNA-29b in cultured human stellate cells[J]. Biochem Biophys Res Commun,2010,391(1):316-321.
[11] Cushing L, Kuang PP, Qian J, et al.miR-29 is a major regulator of genes associated with pulmonary fibrosis[J]. Am J Respir Cell Mol Biol,2011,45(2):287-294.
[12] 王海燕. 肾脏病学[M].3版.北京:人民卫生出版社,2009:801.
[13] 刘峰, 王伟铭, 陈楠. 过氧化物酶体增殖物激活受体γ激动剂对TGFβ1诱导肾成纤维细胞细胞外基质表达的影响[J].肾脏病与透析肾移植杂志,2006,15(2):30-34.
[14] 尤冠巧, 付平, 谢席胜, 等.阿魏酸哌嗪对 TGF-β1诱导肾成纤维细胞表型活化的影响[J].四川大学学报,2008,39(5):736-739.
[15] Mott JL, Kurita S, Cazanave SC, et al. Transcriptional suppression of mir-29b-1/mir-29a promoter by c-Myc,hedgehog, and NF-kappaB[J]. J Cell Biochem,2010,110(5):1155-1164.
[16] Kapinas K, Kessler CB, Delany AM. miR-29 suppression of osteonectin in osteoblasts: regulation during differentiation and by canonical Wnt signaling[J]. J Cell Biochem,2009,108(1):216-224.
[17]Wang H, Garzon R, Sun H, et al. NF-kappaB-YY1-miR-29 regulatory circuitry in skeletal myogenesis andrhabdomyosarcoma[J]. Cancer Cell,2008,14(5):369-381.
[18] Gebeshuber CA, Zatloukal K, Martinez J. miR-29a suppresses tristetraprolin, which is a regulator of epithelial polarity and metastasis[J].EMBO Rep,2009,10(4):400-405.
[19] Sengupta S, den Boon JA, Chen IH,et al. MicroRNA 29c is down-regulated in nasopharyngeal carcinomas, up-regulating mRNAs encoding extracellular matrix proteins[J]. Proc Natl Acad Sci USA,2008,105(15):5874-5878.
[20] Li Z, Hassan MQ, Jafferji M,et al. Biological functions of miR-29b contribute to positive regulation of osteoblast differentiation[J]. J Biol Chem,2009,284(23):15676-15684.
[21] Du B, Ma LM, Huang MB, et al. High glucose down-regulates miR-29a to increase collagen IV production in HK-2 cells[J]. FEBS Lett,2010,584(4):811-816.
[22] Luna C, Li G, Qiu J, et al. Role of miR-29b on the regulation of the extracellular matrix in human trabecular meshwork cells under chronic oxidative stress[J]. Mol Vis,2009,15:2488-2497.
[23] Roderburg C, Urban GW, Bettermann K, et al. Micro-RNA profiling reveals a role for miR-29 in human and murine liver fibrosis[J]. Hepatology,2011,53(1):209-218.
