大鼠全脑照射后早期海马水通道蛋白4 mRNA水平的变化
2012-08-21丁维军梁晓东于长辉朱敏
丁维军,梁晓东,于长辉,朱敏
(台州医院 放疗科,浙江 台州 317000)
水通道蛋白是近年来发现的一组与水通透性有关的细胞膜转运蛋白,影响水跨膜转运和细胞内外环境平衡调节,在脑组织中主要为水通道蛋白4(AQP4),参与多种中枢神经系统疾病中脑水肿的形成[1]。急性期脑放射损伤表现为头痛、昏睡、呕吐等症状,一般认为其与脑水肿和血脑屏障破坏有关[2]。笔者在成功建立放射性脑损伤模型基础上,观察早期放射性脑损伤大鼠海马区AQP4 mRNA表达的变化,探讨AQP4在其中的作用。
1 材料和方法
1.1 雌性SD大鼠分组与全脑照射 健康雌性Sprague-Dawley(SD)大鼠36只,体质量180~220 g,平均(200±10)g,由浙江医学科学院实验动物中心提供(SCXK浙2008-0033)。随机分为20 Gy单次全脑照射后1 d、1周、2周、4周和8周及对照6个组别,每组各6只。X线照射方法[3]:大鼠经3.6%水合氯醛麻醉(1 mL/100 g腹腔注射)后,俯卧于西门子加速器床板(西门子KD2型),应用加速器产生的6MV-X线(剂量率200~210 cGy/min),源皮距SSD 100 cm,单次全脑照射,照射野3 cm×2 cm,光野上界位于双眼后眦连线,下界位于双耳后连线,左右露空。用1 cm厚的组织补偿物覆盖照射野。铅块屏蔽双眼、颈部、胸腹部,参考深度为1.5 cm,照射总剂量20 Gy。
1.2 标本制作及海马区AQP4 mRNA测定 大鼠全脑照射后1 d、1周、2周、4周和8周,大鼠3.6%水合氯醛麻醉(1 mL/100 g腹腔注射)后开胸,0.9%氯化钠溶液250 mL灌注后,取海马区脑组织液氮速冻研磨成粉后,Trizol抽提总RNA。RT-PCR检测AQP4 mRNA的表达:提取的总RNA,加入随机引物及M-MuLV逆转录酶合成cDNA链。取cDNA 0.1μg,加入10×Buffer 2.5μL,25 mmol/L MgCl21μL,10 mmol/L dNTP0.5μL,20 pmol/μL的上下游引物各0.5 μL,TaqDNA聚合酶0.5μL,灭菌双蒸水将反应体系补足至25μL。Thermo PX2型PCR仪进行扩增,以β-actin作为内参照。AQP4反应条件为:预变性95℃ 2 min;94 ℃变性45 s,61 ℃复性1 min,72℃延伸1 min,35个循环。引物序列:AQP4引物:上游引物5’-TCCTCTACCTGGTCACACCC-3’,下游引物5’-GTCTTCTGTCTCCACTTGGCT-3’,扩增片段长458 bp。最后延伸10 min。扩增产物行1.7%琼脂糖凝胶电泳,于BIO-RAD Gel 2000凝胶成像仪上成像,Quantity One软件作半定量分析。
1.3 脑含水量测定 于各时间点在各组大鼠海马区取厚度大约相同的脑组织,放在电子天平称重,然后用铝箔包裹放入恒温电烤箱中100 ℃烘烤>24 h,电子天平称脑组织干重,按Elliot公式计算脑组织含水量[4]。脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.4 统计学处理方法 用SPSS11.5统计软件对资料进行分析,计量资料以±s表示,组间比较采用单因素方差分析。
2 结果
2.1 大鼠海马区脑组织AQP4 mRNA的表达 图1示各组大鼠不同时间点海马区AQP4 mRNA的表达水平,与对照组比较,大鼠20 Gy全脑照射后1 d下降,照射后1周达最低点(P<0.01),2周时仍低于对照(P<0.01),4周时高于对照组(P<0.01),8周时仍高于对照组(P<0.05)。
2.2 各组大鼠海马区脑含水量的比较 各组大鼠不同时间点海马区含水量,与对照组比较,大鼠20 Gy全脑照射后1 d无明显变化,照射后1周增加(P<0.05),2周明显增加(P<0.01),4周时达高峰(P<0.01),8周时仍明显高于对照组(P<0.01),具体见表1。
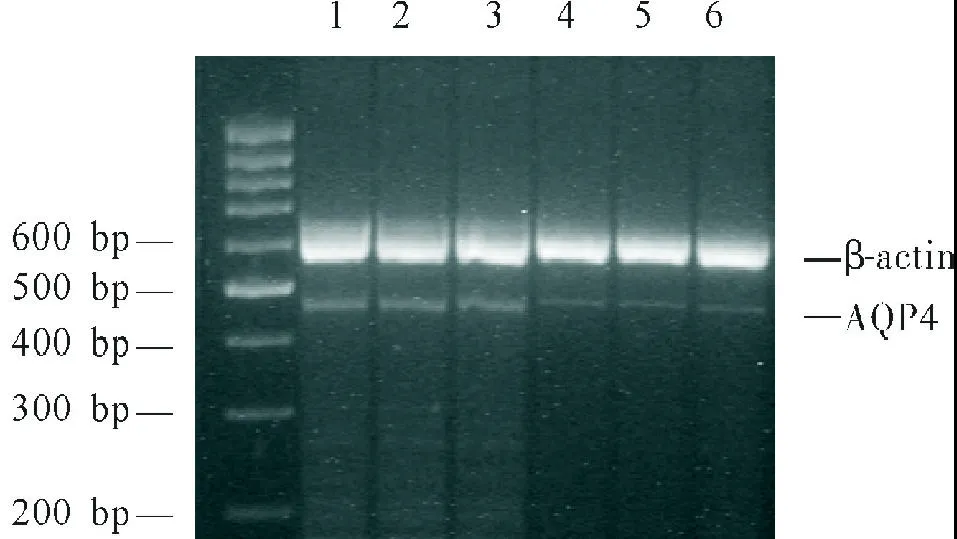
图1 大鼠海马区脑组织AQP4 mRNA的表达
表1 各组大鼠不同时间点海马区脑含水量(n=6±s)

表1 各组大鼠不同时间点海马区脑含水量(n=6±s)
与对照组比:aP<0.05,bP<0.01
组别 AQP4 mRNA 脑含水量(%)对照组 4.69±0.32 77.62±1.41 1d 4.24±0.39 78.99±1.34 1周 3.04±0.50b 79.64±0.90a 2周 3.71±0.32b 81.24±0.67b 4周 5.55±0.33b 83.96±0.81b 8周 5.45±0.27a 82.48±0.68b
2.3 各组大鼠脑含水量与AQP4 mRNA表达的相关性各组大鼠不同时间点脑含水量与AQP4 mRNA表达呈正相关(r=0.435,P<0.01)。
3 讨论
水通道蛋白是一组对水有高度选择性的细胞膜转运蛋白。脑组织中的水通道蛋白主要是AQP4,主要分布于毛细血管周围星形胶质细胞和脑室室管膜细胞,海马、视上核、室旁核和下丘脑等核团内也有分布,促进细胞间、血管与脑室间水分子运动。有研究结果表明,AQP4的诱导表达与血脑屏障的破坏有关[5]。AQP4在缺血性脑卒中、全脑缺血后脑水肿中具有重要作用[6]。创伤性皮层损伤脑出血模型大鼠AQP4 mRNA在损伤位点的表达明显增高,且同期MRI检查显示AQP4表达水平与水肿程度明显相关[7]。而在敲除AQP4的转基因小鼠脑缺血卒中模型中,则具有减轻脑水肿作用[8]。而在低O2高CO2小鼠脑损伤模型早期,小鼠脑组织AQP4表达明显增高,脑细胞水肿[9]AQP4在脑水肿病理机制中的确切作用尚不明确,可能参与脑水肿的形成和消退。在6个月高血压大鼠模型的额叶皮质、纹状体、海马星形细胞足突AQP4表达上调,可能促使血脑屏障破坏,导致脑损伤[10]。缺血后早期AQP4可能通过移除组织中水分而限制脑水肿形成,而并不能阻止血脑屏障的破坏[11]。
本实验结果显示,大鼠20 Gy单次全脑照射后1 d、1周海马区AQP4 mRNA表达下调,2周、4周和8周海马区AQP4 mRNA上调,而此时海马区表现为脑水肿。放射性脑损伤早期,由于血管内皮细胞凋亡,内皮细胞数量下降,血脑屏障破坏,水和大分子物质进入细胞外间隙。脑照射后1个月,血管内皮细胞增殖,血脑屏障通透性逐渐恢复。脑照射1个月后,血脑屏障再次破坏,导致脑组织乏氧和反应性氧化物释放。AQP4具有跨细胞膜双向水流通调节功能,既可促进细胞内水摄入,也可促进细胞外液水清除[12]。AQP4具有促进血管性脑水肿细胞外间隙内水肿液清除的作用,提示大鼠脑照射后AQP4水平增强,可能是一种保护性反应,以减轻脑水肿的形成。陈应柱等[13]报道全脑照射后早期大鼠脑皮质AQP4的蛋白表达下降,认为AQP4在脑水肿形成过程中表达增强或降低的时间取决于血脑屏障破坏的早晚。而本研究认为,放射性脑损伤时AQP4变化与血脑屏障间的关系尚需进一步研究。通过建立AQP4基因敲除大鼠放射性脑损伤模型,深入研究AQP4在放射性脑损伤发生发展中的病理生理作用,以便为放射性脑损伤提供新的治疗策略。
[1] Lo AC,Chen AY,Hung VK,et al. Endothelin-1 overexpression leads to further water accumulation and brain edema after middle cerebral artery occlusion via aquaporin 4 expression in astrocytic end-feet[J]. J Cereb Blood Flow Metab, 2005,25(8):998-1011.
[2] Wong CS, Van der Kogel AJ. Mechanisms of radiation injury to the central nervous system: implications for neuroprotection[J]. Mol Interv,2004,4(5):273-284.
[3] 丁维军,俞秋兴,田野. 大鼠全脑照射后脑内炎性细胞因子含量的变化[J]. 温州医学院学报,2004, 34(3):173-175.
[4] 田野,包仕尧,殷蔚伯. 大鼠半脑照射后早期脑内血流量和含水量变化的研究[J]. 中华放射肿瘤学杂志,1999,8(1):43-46.
[5] Papadopoulos MC, Verkman AS. Aquaporin-4 and brain edema[J]. Pediatr Nephrol,2007,22(6):778-784.
[6] Aoki K,Uchihara T,Tsuchiya K, et al. Enhanced expression of aquaporin 4 in human brain with infarction[J]. Acta Neuropathol,2003,106(2):121-124.
[7] Griesdale DE, Honey CR. Aquaporins and brain edema[J].Surg Neurol,2004,61(5):418-421.
[8] Manley GT, Fujimura M, Ma T, et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J]. Nat Med,2000,6(2):159-163.
[9] 房春燕,代允义,宋兴伟,等. 低O2高CO2对小鼠血脑屏障及水通道蛋白-4表达的影响[J]. 温州医学院学报,2009,39(2):104-107.
[10] Tomassoni D,Bramanti V,Amenta F. Expression of aquaporins 1 and 4 in the brain of spontaneously hypertensive rats[J]. Brain Res,2010,1325:155-163.
[11] Hirt L,Ternon B,Price M,et al. Protective role of early aquaporin 4 induction against postischemic edema formation[J].J Cereb Blood Flow Metab,2009,29(2):423-433.
[12] Saadoun S, Papadopoulos MC. Aquaporin-4 in brain and spinal cord oedema[J]. Neuroscince,2010,168(4):1036-1046.
[13] 陈应柱,鲍欢,田野,等. 大鼠全脑照射后早期大脑皮质水通道蛋白4表达变化的研究[J]. 中华放射肿瘤学杂志,2007,16(2):140-142.
