Pax-8基因抑制后心肌细胞中UCP2的表达
2012-08-21戴晓春黄晓燕周希高瞻王本极张艳丽杨德业
戴晓春,黄晓燕,周希,高瞻,王本极,张艳丽,杨德业
(温州医学院附属第一医院 心内科,温州医学院心血管生物和基因研究所,浙江 温州 325000)
室间隔缺损(ventricular septum defect,VSD)是常见的先天性心脏病,杨德业教授的研究组已证实Pax-8与下游基因NR4A1是和VSD生长发育相关的基因,Pax-8基因被系统敲除后,显示左心室肌和室间隔心肌细胞凋亡程度严重,同时伴有线粒体体积减少,数量增多[1-2]。大多数的研究显示,线粒体在凋亡信号转导过程中起了重要作用,特别是线粒体内膜上的解偶联蛋白 2(uncoupling protein 2,UCP2)。UCP2具有质子的转运活性,引起线粒体质子漏,使氧化磷酸化解偶联,调控线粒体合成ATP,抑制线粒体内活性氧族(ROS)[3]。ROS参与了凋亡信号转导通路的不同阶段[4]。上述研究提示UCP2是一个重要的凋亡调节基因。本实验观察Pax-8基因抑制后心肌细胞中UCP2的变化,探讨UCP2在心肌细胞凋亡中的作用。
1 材料和方法
1.1 材料
1.1.1 动物:Pax-8基因敲除的纯合子小鼠(Pax-8 KO-/-)、Pax-8基因敲除的杂合子小鼠(Pax-8 KO+/-)和野生型小鼠(Pax-8 KO+/+)各10只。(Pax-8 KO+/-)小鼠由德国Peter Gruss和Ahmed Mansouri教授惠赠。
1.1.2 细胞:H9C2(2-1)大鼠胚胎心肌细胞株购自中科院上海细胞库,置于含10%胎牛血清DMEM培养基中,在37 ℃,5% CO2孵箱中培养。
1.1.3 试剂:Lipofectamine 2000转染试剂盒1、Trizol试剂购自美国Invitrogen公司,小鼠抗大鼠Pax-8抗体、小鼠抗大鼠UCP2抗体、兔抗小鼠IgG抗体购自英国Abcam公司,小鼠抗GAPDH抗体购自上海康成生物工程有限公司,ECL化学发光显色试剂盒购自美国Cell Signal 公司,RT试剂盒购自加拿大MBI Fermentas公司,PCR试剂盒购自美国Promega公司,PMSF RIPA BCA蛋白浓度测定试剂盒购自江苏海门碧云天试剂公司,线粒体提取试剂盒购自美国Pierce公司,其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 PCR鉴定小鼠基因型:剪取小鼠尾尖0.5~1 cm,消化小鼠尾巴,提取DNA,进行PCR扩增反应。引物为5’-GGATGTGGAATGTGTGCGAGG-3’,5’-GC TAAGAGAA-GGTGGATGAGAG-3’,5’-GATGCTGCCAGTCTC GTAG-3’,目的基因片断长度分别为370 bp和390 bp。PCR采用20μL体系,其中含有DNA 0.8μL,10×缓冲液2μL,特异性引物各0.8μL,Taq DNA聚合酶0.15μL,dd H2O 11.45μL;反应条件:94 ℃5 min,94 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,94℃ 15 s,57 ℃ 15 s,72 ℃ 30 s,25个循环,72℃ 5 min,每组取6μL PCR产物用含Gold View的15%琼脂糖凝胶电泳,凝胶成像分析系统(Quantity One)摄像分析。
1.2.2 Pax-8 siRNA的表达效率:转染后48 h,Trizol试剂裂解细胞并提取细胞总RNA。Pax-8 siRNA组、NC siRNA组和空白对照组均各取3μL总RNA进行反转录反应。取各组反转录产物分别行PCR,扩增Pax-8和GAPDH片段。Pax-8上游引物为5’-CGGCAA CGCATTGTGGA-3’,下游引物为5’-GTCCTGGGCTCA GAGATTTGG-3’,产物210 bp。以GAPDH作为内参照,GAPDH上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为5’-TGTAGACCATGTAGTTGAGGTCA-3’,产物123 bp。Pax-8反应条件:94 ℃ 5 min后,94℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环,72 ℃ 10 min。GAPDH反应条件:94 ℃ 5 min后,94 ℃ 30 s,54.6 ℃ 30 s,72 ℃ 1 min,35个循环,72 ℃ 10 min每组取10μL PCR产物用于1.5%琼脂糖凝胶电泳,Quantity One凝胶成像分析系统进行半定量分析。Western blot法检测Pax-8蛋白表达水平,转染后24 h,裂解细胞提取蛋白质,BCA法测定蛋白浓度,各组上样50μg,行10% SDSPAGE电泳,转膜,7.5%脱脂牛奶封闭2.5 h。小鼠抗大鼠Pax-8抗体(1:100)4 ℃孵育过夜,TBST溶液洗膜3次,每次10 min。室温下加入兔抗小鼠IgG抗体(1:2000)孵育1.5 h,洗膜3次。用增强化学发光法显色,X线片曝光显影。以GAPDH作为内参照标化Pax-8蛋白质表达。用Quantity One凝胶成像分析系统进行半定量分析。
1.2.3 UCP2在Pax-8抑制后心肌细胞中的表达:RTPCR法检测UCP2表达水平。提取总RNA,反转录成cDNA后,进行PCR扩增,UCP2上游引物为5’-CGACAAC CACCCAATGAAT-3’,下游引物为5’-GAGTGCCCTCAG CGAAGTC-3’,产物大小为324 bp;GAPDH上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为5-TGTAGACCATGTAGTTGAGGTCA-3’,产物大小为123 bp。管家基因GAPDH作为内参照标化UCP2 mRNA表达。UCP2反应条件如下:94 ℃ 5 min后,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min。GAPDH反应条件如下:94 ℃变性5 min后, 94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,28个循环后72 ℃ 10 min,每组取6μL PCR产物用含Gold View的15%琼脂糖凝胶电泳,凝胶成像分析系统(Quantity One)摄像分析。Western blot法检测UCP2蛋白表达水平。取小鼠心脏组织(或心肌细胞),线粒体试剂盒提取线粒体,裂解线粒体提取线粒体的蛋白,BCA法测定蛋白浓度,各组上样100μg,进行10% SDS-PAGE电泳,转膜,5%脱脂牛奶室温封闭2.5 h。小鼠抗大鼠UCP2 抗体(1:400)孵育过夜,TBST溶液洗膜3次,每次10 min。室温下加入兔抗小鼠IgG抗体(1:5000)孵育1.5 h,洗膜3次,10 min。用增强化学发光法显色,X线片曝光显影。以GAPDH作为内参照标化UCP2蛋白质表达,Quantity One凝胶成像分析系统进行半定量分析。
1.3 统计学处理方法 采用SPSS 16.0软件完成统计分析。计量资料以±s表示,多组间均数比较采用单因素方差分析,独立的两组间比较用SNK-q检验和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PCR鉴定小鼠基因型 雌的(Pax-8 KO+/-)和雄的(Pax-8 KO+/-)交配可获得Pax-8 KO-/-(纯合子)和Pax-8 KO+/-(杂合子),小鼠出现一条370 bp左右条带为Pax-8基因敲除小鼠纯合子(Pax-8 KO-/-),370 bp和390 bp左右条带为Pax-8基因敲除小鼠杂合子(Pax-8 KO+/-),390 bp左右条带为野生型(Pax-8 KO+/+),如图1。

图1 小鼠基因型鉴定
2.2 RT-PCR检测Pax-8 siRNA的表达效率 与NC siRNA组(mRNA为0.69±0.15,蛋白为0.75±0.10)相比,Pax-8 siRNA组Pax-8 mRNA(0.26±0.11)表达下调62.31%(P<0.05),蛋白(0.34±0.06)表达下调54.67%(P<0.05)。与空白对照组(mRNA为0.72±0.23,蛋白为0.84±0.19)比较,Pax-8siRNA组Pax-8的mRNA表达下调63.89%(P<0.05),蛋白表达下调59.52%(P<0.05)。NC siRNA组与空白对照组的Pax-8 mRNA表达差异无统计学意义,如图2。
2.3 Pax-8敲除小鼠UCP2 mRNA和蛋白的表达上调与Pax-8基因敲除小鼠杂合子(Pax-8 KO+/-)组(mRNA为0.85±0.23,蛋白为0.86±0.14)相比,Pax-8基因敲除小鼠纯合子(Pax-8 KO-/-)组UCP2的mRNA(1.29±0.25)的表达上调34.11%(P<0.05),蛋白(1.26±0.13)的表达上调31.75%(P<0.05),与野生型(Pax-8 KO+/+)组UCP2(mRNA为0.84±0.23,蛋白为0.80±0.17)相比,实验组Pax-8基因敲除小鼠纯合子(Pax-8 KO-/-)组UCP2的mRNA表达上调34.88%(P<0.05),蛋白表达上调36.50%(P<0.05),而对照组之间,Pax-8基因敲除小鼠杂合(Pax-8 KO+/-)组和野生型(Pax-8 KO+/+)组间差异无统计学意义,如图3。
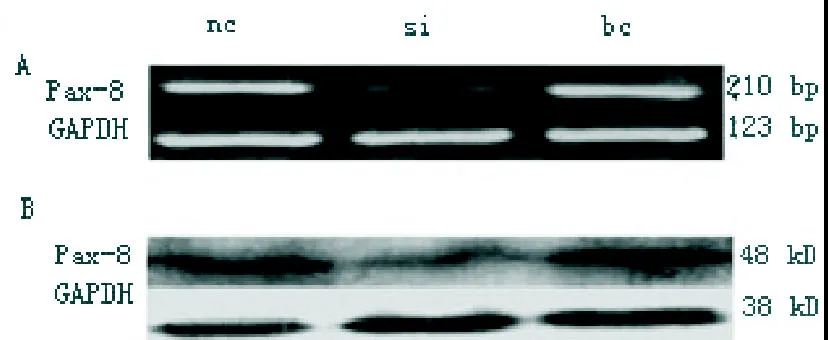
图2 Pax-8 siRNA的表达效率检测
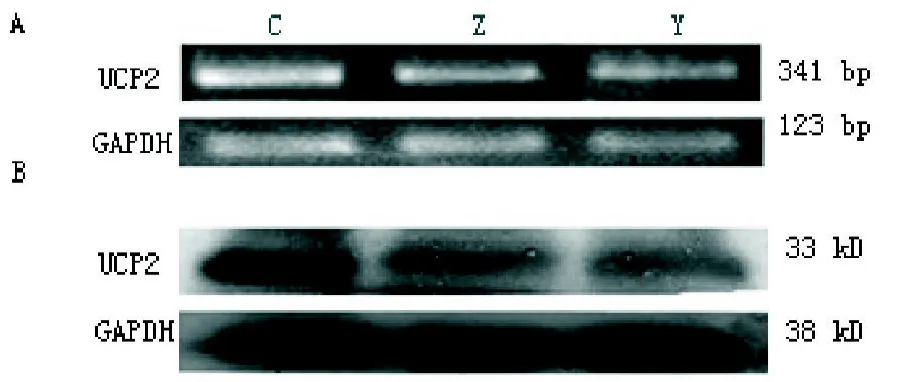
图3 Pax-8敲除小鼠UCP2 mRNA和蛋白的表达
2.4 Pax-8 siRNA组的UCP2表达上调 与NC siRNA组的UCP2(mRNA为0.78±14,蛋白为0.77±0.19)相比,Pax-8 siRNA组UCP2(mRNA为1.07±0.08)的表达上调27.10%(P<0.05),蛋白表达(1.02±0.20)上调24.50%(P<0.05)。与空白对照组的UCP2(mRNA为0.77±0.1,蛋白为0.75±0.13)比较,Pax-8 siRNA组UCP2的mRNA表达上调28.03%(P<0.05),蛋白质上调26.47%(P<0.05)。NC siRNA组与空白对照组的UCP2 mRNA和蛋白质表达差异均无统计学意义,如图4。
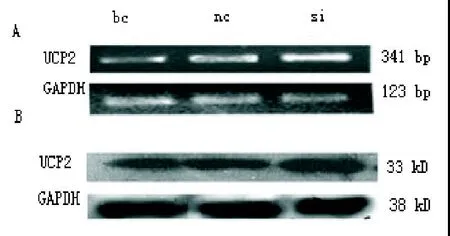
图4 Pax-8基因干扰后UCP2在大鼠心肌中的表达
3 讨论
解偶联蛋白2(uncoupling protein,UCP2)属于线粒体阴离子载体家族成员,基因位于小鼠的第7条染色体、人的第11条染色体上[5]。它是一种介导线粒体质子漏的蛋白,降低线粒体在呼吸时形成的H+梯度,使氧化磷酸化解偶联,ATP合成降低,以及膜电位下降[6]。UCP2 mRNA广泛存在于骨骼肌、心肌、胎盘、肝脏、脾脏、胰腺、肾脏、肺、胃、和小肠等组织及中枢神经系统内[7],然而UCP2蛋白仅在少数组织中表达,包括胰腺、胃、脾、心、脑和肺中[8]。目前研究表明UCP2可以调节胰岛素的分泌[9]、Ca2+超载、ROS[10]的生成,以及调节ATP的合成[11]。然而,关于UCP2蛋白的生理功能仍然存在许多争论,越来越多的研究表明UCP2在不同组织中可能发挥不同的生理功能。在不同类型细胞中,UCP2过表达可能导致不同继发效应,如在成纤维细胞中,UCP2过表达对细胞的生长及存活无影响,但在HeLa细胞中UCP2过表达却能够降低线粒体跨膜电压并促进细胞死亡[12]。本实验的研究结果显示,与Pax-8基因敲除杂合子和野生型小鼠心肌细胞相比,Pax-8基因敲除纯合子小鼠心肌细胞中UCP2 mRNA和蛋白质的表达明显上调;同时,与NC siRNA组和空白对照组相比,Pax-8 siRNA组UCP2的基因和蛋白质表达明显上调,而Pax-8基因抑制后的心肌细胞凋亡明显增加[2,13]。Pax-8基因敲除的纯合子小鼠心脏研究结果显示心脏成球形,左心室壁肥厚,室间隔增厚,左心室乳头肌肥大。病理学显示左心室肌和室间隔心肌细胞凋亡程度严重, 同时伴有线粒体体积减少,数量增多。Pax-8基因敲除的纯合子小鼠在出生后即表现出心室重构[2]。左室重构时,心肌单位横截面上毛细血管密度降低,导致心肌相对供血不足,处于相对能量缺乏和低氧状态,心肌细胞ROS增多,导致线粒体溶解,甚至心肌细胞凋亡[14-15]。Maron等[16]指出,心肌肥大早期,线粒体体积代偿性增加,但是在晚期,其体积则缩小,此为肥大心肌趋于衰竭的形态特征, 心肌细胞中线粒体的机能主要和有氧代谢产生化学能有关,故其所占心肌细胞的容积与能量利用有关。我们认为可能的机制为:Pax-8基因抑制后,心室进行重构,在室间隔心室重构中,心肌细胞的肥大和纤维化增加,使单位横截面上的心肌细胞数量减少,而单位横截面上的UCP2仍然保持较高水平,说明单个心肌细胞中UCP2含量上升。心室重构导致心肌细胞产生ROS增多[17],此时,UCP2增加虽然能拮抗ROS的增长[18],延缓纤维化、室间隔心室重构的进程,减少细胞的凋亡,但同时使心肌细胞ATP产生的障碍加重,使细胞凋亡。
综上所述,我们推测Pax-8基因抑制后,UCP2基因的表达上调,室间隔心肌细胞凋亡程度严重。然而UCP2是一个双向因素,如果能在保证心脏能量供给充足的情况下,同时对UCP2基因进行干预,可能会减少室间隔细胞的凋亡,但是其具体机制还未明确,有待进一步研究。
[1] 黄晓燕,高瞻,周希,等.Pax-8基因敲除小鼠心脏中NR4A1基因表达上调[J].温州医学院学报,2011,41(3):205-208.
[2] 章佳颖,来丹丹,杨德业,等.Pax-8基因在胚胎心脏发育中的角色研究[J].中国病理生理杂志,2009, 25(7):1292 -1297.
[3] Ricquier D, Bouillaud F.The uncoupling protein homologues:UCP1,UCP2,UCP3,StUCP and AtUCP[J].Biochem J,2000,345(Pt2):161-179.
[4] Le Bras M,Clement MV,Pervaiz S,et a1.Beaetive oxygen species and the mitochondrial signaling pathway of cell death[J].Histol Histopathol,2005,20(1):205-219.
[5] Fleury C, Neverova M, Collins S, et al.Uncoupling protein-2: a novel gene linked to besity and hyperinsulinemia[J].Nat Genet,1997,15(3):269-272.
[6] Gable DR, Stephens JW, Cooper JA, et al. Variation in the UCP2-UCP3 gene cluster predicts the development of type 2 diabetes in healthy middle-aged men[J]. Diabetes,2006,55(5):1504-1511.
[7] Kim-Han JS,Dugan LL.Mitochondrial uncoupling proteins in the central nervous system[J].Antioxid Redox Signal,2005,7(9-10):1173-1181.
[8] Chan CB,Harper ME.Uncoupling proteins:role in insulin resistance and insulin insufficiency[J].Curr Diabetes Rev,2006,2(3):271-283.
[9] Chan CB,Kashemsant N. Regulation of insulin secretion by uncoupling protein [J]. Biochem Soc Trans,2006,34(Pt5):802-805.
[10] Teshima Y,Akao M,Jones SP,et al. Uncoupling protein-2 overexpression inhibits mitochondrial death pathway in cardiomyocytes[J].Circ Res,2003,93(3):192-200.
[11] Boss O,Hagen T,Lowell BB.Uncoupling proteins 2 and 3:potential regulators of mitochondrial energy metabolism[J].Diabetes,2000,49(2):143-156.
[12] Mills EM,Xu D,Fergusson MM,et a1.Regulation of cellular oncosis by uncoupling protein 2[J].J Biol Chem,2002,277(30):27385-27392.
[13] 高瞻,来丹丹,张敏,等.Pax-8基因在大鼠心肌细胞凋亡中的作用[J].解放军医学杂志,2009,34(9):1082-1084.
[14] Eghbali M.Cellular origin and distribution of transforming growth factor-beta in the normal rat myocardium[J].Cell Tissue Res,l989,256(3):553-558.
[15] Tan LB,Jalil JE,Pick R et al.Cardiac myocyte necrosis induced by angiotensin II [J].Circ Res,1991,69(5):l185-1195.
[16] Maron BJ,Mcintosh CL, Klues HG, et al. Morphologic basis for obstruction to right ventricular outflow in hypertrophic cardiomyopathy [J]. Am J Cardiol, 1993,71(12):1089-1094.
[17] Van Der Lee KA,Willemsen PH,Van Der Vusse GJ,et a1.Effects of fatty acids on uncoupling protein-2 expression in the rat heart[J].FASEB J,2000,14(3):495-502.
[18] Negre-Salvayre A,Hirtz C,Carrera G,et a1.A role for uncoupling protein -2 as a regulator of mitochondrial hydrogen peroxide generation[J].FASEB J,1997,1l(10):809-815.
