细胞重编程改写细胞命运:细胞的返老还童——2012年诺贝尔生理学或医学奖简介
2012-08-21王昱凯
王昱凯 周 琪②
①博士,②研究员,中国科学院动物研究所计划生育生殖生物学国家重点实验室,北京100101
细胞重编程改写细胞命运:细胞的返老还童
——2012年诺贝尔生理学或医学奖简介
王昱凯①周 琪②
①博士,②研究员,中国科学院动物研究所计划生育生殖生物学国家重点实验室,北京100101
胚胎干细胞 诱导性多能干细胞 细胞重编程 诺贝尔生理学或医学奖
科学家们对细胞重编程的研究已经持续了数十年。所谓细胞重编程是指“已分化的特定细胞可以被重新编程为多功能的干细胞”。1962年,约翰·戈登(John Gurdon)在他的实验室里证明,已分化的动物体细胞在蛙卵中可以被重编程,从而具有发育成完整个体的能力,证明了细胞的分化是可逆的。2006年,山中伸弥(Shinya Yamanaka)将戈登的这一成果推进了一大步,实现了细胞在体外的重编程,诱导出了具有多能性的细胞(即诱导性多能干细胞,induced pluripotent stem cell,iPS细胞),证明了细胞命运是有选择性地打开或关闭某些基因的结果。与胚胎干细胞相比,iPS细胞的优势在于它避开了使用人体胚胎提取干细胞的伦理道德制约,使干细胞研究能被所有人接受。同时,由于这些细胞来自于病人自身,在临床应用时有希望避免免疫系统对外来组织的排斥。iPS技术的创立开创了一个全新的研究领域。
2012年10月8日,瑞典诺贝尔奖评审团宣布,日本京都大学生物系教授山中伸弥和英国发育生物学家约翰·戈登因在细胞重编程研究领域的杰出贡献,而共同分享2012年诺贝尔生理学或医学奖(图1)。这一消息公布之后,从事发育生物学和疾病机制研究的人无不为之振奋,因为现在已有无数的实验室的工作建立在这两位先驱者已取得的这些基础性突破上。
我们的生命是由一个受精卵开始的,当它发育到一定时期时,其中的一团细胞具有多能性,可以分化为身体内的各种功能的细胞,这就是胚胎干细胞(embryonic stem cell,ES细胞)。过去人们认为细胞的分化过程是不可逆的,当细胞进入不同的发育途径后便获得了一种稳定的状态,这些细胞的命运是无法改变的。山中伸弥和戈登两位科学家的突破性研究改变了人类对自身发育和细胞分化的认识,使人们清楚地了解到,细胞不一定仅局限于其专门的状态,其命运是可以改变的。通过对人体细胞的重新编程,科学家开辟出了疾病研究的新途径,并为疾病治疗找到了新突破口。
1 研究历程

图1 2012年诺贝尔生理学或医学奖得主约翰·戈登(上)和山中伸弥(下)
山中伸弥大学时就读于神户大学医学院,在学习过程中,他的兴趣逐渐从临床转移到基础医学研究,于是大学毕业后进入实验室开始研究血压调节的分子机理[1]。就在他的大学期间,转基因和基因敲除技术取得了突破性的发展。1987年,Thompson带领的研究小组首次利用小鼠胚胎干细胞建立了完整基因敲除的小鼠模型[2]。山中伸弥对这项技术感到十分震撼,于是博士毕业后,他申请到了美国格拉德斯研究所一个研究转基因的实验室做博士后,从此与胚胎干细胞打上了交道。当时胚胎干细胞研究的主要方向是将其分化为不同组织的细胞,然后取代受损的或有疾病缺陷的组织细胞。山中伸弥另辟蹊径提出了一个大胆的设想:把分化的细胞逆转为多能干细胞,也就是我们所说的细胞重编程。
如果说山中伸弥是细胞重编程研究中的转折人物,那么戈登则是开创者。早在1962年,戈登就证明了“细胞的特化是可逆的”这一颠覆性的结论,巧的是这一年恰好山中伸弥出生。戈登用爪蛙成熟细胞的细胞核替换掉了爪蛙卵细胞的细胞核,修改后的卵细胞仍可以发育成一只正常的蝌蚪,最后得到了克隆爪蛙[3]。在那之前,科学界普遍认为动物胚胎发育过程中的细胞分化是单向的,是不可逆转的。戈登的核移植实验证明这个过程是可逆的,体细胞核可以在卵中被重编程为多能性细胞。在这一工作的基础上,1996年,英国爱丁堡大学罗斯林学院(Edinburgh’s Roslin Institute)的伊恩·威尔穆特(Ian Wilmut)领导的团队基于同样的原理,把羊的乳腺细胞核移植到去核的羊卵中,成功地培育出了第一个由成年动物体细胞来源的哺乳动物——克隆羊多利(Dolly)[4]。多利的诞生具有划时代的意义,它首次证实了在哺乳动物中,已分化的细胞也可通过核移植技术被重新编程为具有多能性的细胞。这些工作为山中伸弥的iPS研究奠定了基础。
山中伸弥的假设是存在维持干细胞多能状态的转录因子(转录因子是指生物体内可以调控某些基因表达的一类蛋白质),如果把这些转录因子过表达,可能会实现细胞分化的逆转(图2)。他的这一设想不是没有科学依据的,在1987年,Davis等[5]就发现过表达与肌肉发育相关的成肌分化抗原因子MyoD,可以将成纤维细胞转化为肌细胞,证明了通过过表达特定的转录因子将体细胞重编程是可行的。山中伸弥经过不懈的努力,找到了24个在干细胞中高表达,而在分化细胞中低表达的蛋白质。他先用逆转录病毒感染的方法将这些因子一一导入小鼠成纤维细胞中,结果一无所获;无奈之下他把所有的24个因子一股脑儿全加到了成纤维细胞,没想到奇迹发生了,成纤维细胞逐步被诱导成胚胎干细胞样的克隆(图3)。为了鉴定哪些是诱导干细胞所必需的,每次实验去掉一个因子,最后发现了四个关键因子:Oct3/4,Sox2,Klf4和c-Myc。
过表达这四个转录因子,可以将成纤维细胞重编程为多能干细胞,被称为诱导性多能干细胞(iPS细胞)。那么iPS细胞就是多能干细胞吗?它们之间是否存在差异?山中伸弥带领他的团队通过比较iPS细胞与ES细胞的基因表达谱、表观遗传信息、分化能力等一系列的指标,发现两者在相当大的程度上是一致的[7]。2007年,山中伸弥和Thomson研究组又分别建立了人的iPS细胞系[8-9]。
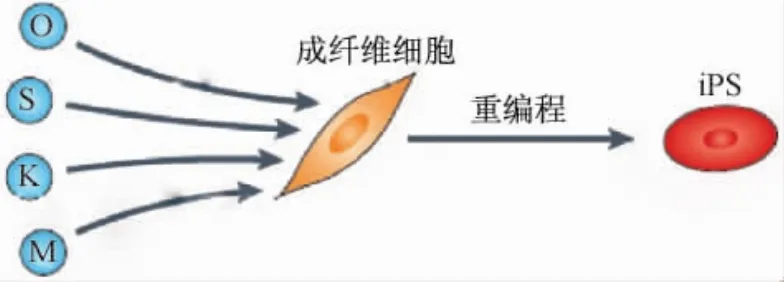
图2 iPS细胞的产生过程。4个转录因子Oct3/4(O),Sox2(S),Klf4(K)和c-Myc(M)借助病毒导入成纤维细胞中,使成纤维细胞重编程为iPS细胞。此图源自文献[6]

图3 小鼠ES细胞(左)、iPS细胞(中)和胚胎成纤维细胞(MEF,右)。此图源自文献[7]。标尺=200 mm
2 细胞重编程的应用价值
要想了解这一发现的重要意义,还要从干细胞说起。“干细胞”这一名词最早是1909年由俄罗斯著名血液学家马克西莫夫(Maximow)提出的,源于包括他在内的许多发育生物学家的一个设想:机体内一些看似差异很大的细胞在发育过程中可能有一个共同的来源细胞[10]。1981年,英国的生物学家马丁·埃文斯(Martin Evans)和马修·考夫曼(Matthew Kaufman)首次从小鼠早期胚胎内侧分离出小鼠胚胎干细胞,这些细胞不仅能够无限增殖,还具有发育的全能性,能够分化成除胎盘之外的任意一种小鼠细胞[11](图4)。从那以后,人们对于干细胞有了确定的认识,全球就掀起了胚胎干细胞研究的热潮。在1998年,美国威斯康星大学的詹姆斯·汤姆森(James Thomson)又成功地获得了人的胚胎干细胞[12]。
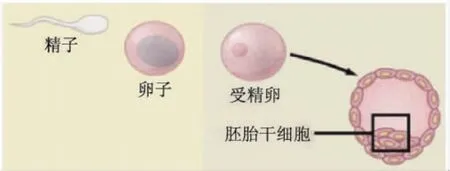
图4 胚胎干细胞来源示意图
有了这种细胞,从理论上说,就有可能按照需要培育出人体内任何组织和器官,这样就可用于修复病变或破损的组织和器官,或直接在坏死的部位培养出新的器官组织。对于某些靠现有药物或外科手术的手段无法得到有效治疗的疾病,尤其是器官损毁型疾病和神经退行性疾病,如帕金森病(Parkinson’s disease,PD)等,干细胞治疗的研究和应用具有重大的现实意义。可以想象,如果这种强大的技术能用于临床治疗,将会给人类健康带来巨大福音。
然而,看似无限美好的胚胎干细胞事业,从它诞生之日起就注定要遭受磨难。因为,它的来源是胚胎,这就意味着本来可以在子宫内发育成人的胚胎,为了提取干细胞而被毁坏,不能再发育成一个健全的婴儿。这惹来了许多伦理上的反对和斥责,使得胚胎干细胞研究一直处于一个颇具争议的位置。支持者认为这项研究有助于根治很多疑难杂症,是一种挽救生命的慈善行为,是科学进步的表现。反对者则认为,无论以什么方式孕育的胚胎都是一条生命,而生命不容随意摧毁。为此,干细胞研究在美国遭遇了寒冬,2006年7月19日,美国总统布什上任5年来首次动用总统否决权,否决了国会通过的一项旨在支持干细胞研究的法案,此举引起了社会各界的广泛关注,道德层面的争议成为了制约干细胞研究的瓶颈,科学与伦理再次成为对立的双方。
2006年,iPS技术的出现挽救了整个干细胞事业。这一新的细胞重编程的方法绕过了胚胎干细胞的伦理困境,把病人的体细胞转化为干细胞供自身使用。开创了基因治疗的新方法。2007年,鲁道夫·詹尼士(Rudolf Jaenisch)研究组利用iPS重编程技术,成功治疗了小鼠的镰状红细胞贫血症。他们用患有镰刀型贫血症的小鼠体细胞建立了iPS细胞,并通过基因技术修正细胞中的疾病基因。将修复后的iPS细胞诱导分化为血液干细胞后移植回患病小鼠体内,可以改善小鼠的贫血症状[13]。2009年初,Xu等[14]用从iPS细胞诱导来的内皮前体细胞和内皮细胞成功治疗血友病。他们的研究虽然是在小鼠中进行的,然而,这些成果证实iPS细胞在基因治疗中的可行性,从实践上为人类基因遗传病的治疗奠定了基础。到目前为止,利用iPS细胞进行疾病研究已经在许多疾病上开展起来。2008年,约翰·迪莫斯(John Dimos)等率先从一名82岁的肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)患者皮肤提取的细胞建立了iPS细胞系,并证实这些iPS细胞可以定向分化为健康无病变的运动神经元细胞[15]。
此外,iPS技术在疾病模拟和药物筛选中也有广泛的应用(图5)。主要是针对遗传性病变,将病人的体细胞逆转为iPS细胞,或将致病因素(通常是基因突变)导入iPS细胞中,在体外使其定向分化成病变发生的细胞,观察在这个过程中出现的问题,就可以实现在培养皿里模拟疾病的发生,研究疾病发生的机制。目前,利用iPS细胞模拟疾病发生研究致病机制已经广泛地开展起来。帕克(Park)等利用iPS技术建立了一大批疾病细胞系,包括帕金森氏病、舞蹈症、II型糖尿病等。疾病特异的iPS细胞在体外培养和分化以后,同时还可以筛选治疗该疾病的药物[16]。
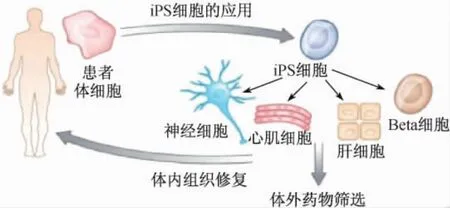
图5 iPS细胞的应用(图片来自诺贝尔奖网站)
3 iPS研究的问题和进展
iPS技术一发表,相关的新发现便迅速涌现,伴随的问题也随之而来。首先,诱导效率低。iPS细胞最初的诱导效率仅有0.067%[7],也就是说平均每一万个细胞中只有不到七个被改造成功。低诱导效率严重阻碍了iPS细胞的研究和应用。科学家们为了提高iPS细胞诱导效率,采取了各种方法对培养条件进行优化。比如阻断p53基因[17]、在低氧环境培养[18]、培养液中添加小分子等[19],这在一定程度上提高了iPS细胞的诱导效率。
iPS细胞的另一个缺陷是它的强致瘤性。山中伸弥小组在研究中发现,由iPS细胞培育成的小鼠后代,其中有20%的子代小鼠产生肿瘤[8,20],这严重阻碍了iPS细胞的研究进展和临床应用。一般认为,iPS细胞的强致瘤作用主要归咎于两方面:一是病毒的整合作用,用于过表达的逆转录病毒将它携带的转录因子随机插入细胞基因组中,使细胞的基因组产生突变,有可能激活原癌基因或灭活抑癌基因,从而引发肿瘤。进一步的研究发现单个转录因子在iPS细胞的基因组中有3~6个插入位点,因此4个因子最多可以产生20多个插入位点,这会极大增加肿瘤发生的几率[8]。第二,严格地说,所有的4个转录因子都可以视为原癌基因,随病毒转入细胞后大量表达而引发肿瘤[21]。为了避免插入型病毒的整合作用导致iPS细胞致瘤,许多实验室采用非整合诱导的方法建立iPS细胞系,比如腺病毒[22],然而,这使iPS细胞的诱导率变得更低。
再者,在整个重编程过程中,只有很少一部分细胞能够被完全重编程为多能性细胞,其他大多数iPS细胞由于重编程不完全而导致无法获得后代或后代具有生理缺陷,说明不同iPS的发育潜能存在巨大差异。对于人类胚胎干细胞系,由于伦理学的限制,不能通过发育能力进行鉴定,更加难以确定其多能性水平。因此,如何准确地判断干细胞的多能性状态并对其进行精确分型是干细胞的基础研究和转化应用过程中一个急需解决的问题。研究人员发现了一组在胚胎干细胞和具有完全多能性的iPS细胞中高表达,在仅具有部分多能性的iPS细胞中不表达或表达水平极低的一个关键基因组区域Dlk1-Dio3区。通过一系列实验证明,Dlk1-Dio3区的开启或关闭可以用来作为判断iPS细胞多能性水平的分子标记[23-24]。
最后,iPS细胞产生之后,一个最重要的问题始终困扰着大家,就是它是否不同于胚胎干细胞,虽然它们看起来很像,但毕竟来源不同,如果有不同,那么这些差别会不会产生功能上的差异?获得的iPS细胞是否拥有与胚胎干细胞一样的全能性呢?检验iPS细胞全能性有一个“黄金标准”,是看该细胞能否培育出四倍体补偿小鼠(哺乳动物是二倍体动物,在受精卵分裂成两个细胞时,可通过电融合使两个细胞融合为一个细胞,得到四倍体胚胎。四倍体胚胎无法正常发育,只能形成胎盘。将多能干细胞注入四倍体胚胎,如果能获得完整的动物个体,则该个体完全由干细胞发育而来,从而证明移进去的干细胞是全能性的)。2009年7月,中国科学院动物研究所周琪领导的小组获得了完全由iPS细胞来源的成体小鼠[25]。这只完全由iPS细胞制备的活体小鼠,有力地证明了iPS细胞具有与胚胎干细胞相同的发育能力。此项研究成果入选了《时代》周刊2009年度十大医学突破,成为中国科学家在这一国际热点研究领域所作出的一项重要贡献。
4 前景与展望
体细胞重编程技术产生的多能性iPS细胞,为人类的永葆健康带来了希望。虽然在短时间内取得了一系列的突破,但是这仅仅是一个新的开始,生命科学复杂而不可预测,要把这些美好的愿景变成现实,让iPS重编程技术真正造福人类,还需要克服重重的困难。其中有几个最重要的有待解决的问题。
(1)安全性问题
在iPS细胞治疗的安全性方面,我们必须对其潜在的风险,包括致瘤性、免疫排斥、毒副作用等有全面的理解。其中iPS细胞的强致瘤性成为其科学研究和临床应用的最大障碍。只有先解决致瘤性这一难题,才能使其安全地应用到临床上治疗人类疾病。在我们通过改进诱导方法使其免除致瘤性的同时,必须要了解iPS细胞产生及重编程的分子机制,才有可能从根本上解决其致瘤性这一世界性难题。
(2)机制问题
将细胞由分化状态逆转为多能性状态这一过程受到基因网络和表观遗传的复杂调控,那么,仅仅依靠导入的几个有限的转录因子是怎样完成这一复杂的任务,最后实现了细胞命运的转化?极低的诱导效率以及分化能力的不均一是否说明还有某些重要环节被我们忽视?这所有的问题都需要通过深入研究体细胞重编程的分子机制、调控机制,以及分化机制来解答。
(3)标准的建立
不同的iPS细胞之间,其细胞的生长速度、分化潜能都有较大不同,因此,建立一个统一的标准成为了迫切需要解决的重大实际问题。依据标准建立高效、安全、实用的临床级人iPS细胞,并充分评价iPS细胞临床应用的安全性是目前研究的重点。
总而言之,由于安全性问题,iPS等技术应用于人类临床治疗还为时尚早;但用干细胞重编程技术造福于人类,是我们科研人员的职责。可以预见,只要干细胞领域的科研工作者踏踏实实地去做,梦想终归有实现的一天。
(2012年11月20日收到)
[1]YAMANAKA S,MIURA K,YUKIMURA T,et al.Putative mechanism of hypotensive action of platelet-activating factor in dogs[J].Circ Res,1992,70:893-901.
[2]DOETSCHMAN T,GREGG R G,MAEDA N,et al.Targetted correction of a mutant HPRT gene in mouse embryonic stem cells[J].Nature,1987,330:576.
[3]GURDON J B.Adult frogs derived from the nuclei of single somatic cells[J].Dev Biol,1962,4:256-273.
[4]WILMUT I,SCHNIEKE A E,MCWHIR J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[5]DAVIS R L,WEINTRAUB H,LASSAR A B.Expression of a single transfected cDNA converts fibroblasts to myoblasts[J].Cell,1987,51:987-1000.
[6]PLATH K,LOWRY W E.Progress in understanding reprogramming to the induced pluripotent state[J].Nat Rev Genet,2011,12(4):253-265.
[7]TAKAHASHI K,YAMANAKA S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[8]TAKAHASHI K,TANABE K,OHNUKI M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131:861-872.
[9]YU J,VODYANIK M A,SMUGA-OTTO K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318:1917-1920.
[10]RAMALHO-SANTOS M,WILLENBRING H.On the origin of the term “stem cell”[J].Cell Stem Cell,2007,1:35-38.
[11]MARTIN G R.Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells[J].Proc Natl Acad Sci USA,1981,78:7634-7638.
[12]THOMSON J A,ITSKOVITZ-ELDOR J,SHAPIRO S S.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282:1145-1147.
[13]HANNA J,WERNIG M,MARKOULAKI S,et al.Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin [J].Science,2007,318(5858):1920-1923.
[14]XU D,ALIPIO Z,FINK LM,et al.Phenotypic correction of murine hemophilia A using an iPS cell-based therapy [J].Proc Natl Acad Sci USA,2009,106(3):808-813.
[15]DIMOS J T,RODOLFA K T,NIAKAN K K,et al.Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons[J].Science,2008,321(5893):1218-1221.
[16]PARK I H,ARORA N,HUO H,et al.Disease specific induced pluripotent stem cells[J].Cell,2008,134(5):877-886.
[17]HONG H J,TAKAHASHI K,ICHISAKA T,et al.Suppression of induced pluripotent stem cell generation by the p53-p21 pathway[J].Nature,2009,460(7259):1132-1135.
[18]YOSHIDA Y,TAKAHASHI K,OKITA K,et al.Hypoxia enhances the generation of induced pluripotent stem cells[J].Cell Stem Cell,2009,5(3):237-241.
[19]HUANGFU D W,MAEHR R,GUO W J,et al.Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J].Nat Biotechnol,2008,26(7):795-797.
[20]OKITA K,ICHISAKA T,YAMANAKA S.Generation of germline-competent induced pluripotent stem cells [J].Nature,2007,448(7151):313.
[21]LIU S V.iPS cells:a more critical review [J].Stem Cells and Development,2008,17(3):391-397.
[22]STADFELD M,NAGAYA M,UTIKAL J,et al.Induced plurpotent stem cells generated without viral integration [J].Science,2008,322(5903):945-949.
[23]STADTFELD M,APOSTOLOU E,AKUTSU H,et al.Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells[J].Nature,2010,465(7295):175-181.
[24]LIU L,LUO G Z,YANG W,et al.Activation of the imprinted Dlk1-Dio3 region correlates with pluripotency levels of mouse stem cells[J].J Biol Chem.2010,285(25):19483-19490.
[25]ZHAO X Y,LI W,LV Z,et al.iPS cells produce viable mice through tetraploid complementation[J].Nature,2009,461(7260):86-90.
Cell Fate Changed by Reprogramming:the Rejuvenation of Cells—A Brief Introduction to the Nobel Prize in Physiology or Medicine 2012
WANG Yu-kai①,ZHOU Qi②
①Ph.D.,②Professor,TheStateKeyLaboratoryofReproductive Biology,InstituteofZoology,ChineseAcademyofSciences,Beijing100101,China
The study of cell reprogramming has been carried out by many scientists for decades of years.The term cell reprogramming means“fully differentiated cells can be reprogrammed to multipotent stem cells”.In 1962,John Gurdon proved that somatic cells can be reprogrammed in an unfertilized enucleatedXenopusegg,demonstrating that nuclei from specialized cells still held the potential to be any cell type despite its specialization.Based on Gurdon’s achievement,in 2006,Shinya Yamanaka made great progress in the cell reprogramming field.He successfully performed cell reprogramming outside the body and obtained cells with multipotency,namely induced pluripotent stem cells(iPS cells),indicating that cell fate is determined by selectively opening or closing some certain genes.Compared with embryo stem cells(ES cells),iPS has great superiority in avoiding ethical troubles caused by collecting stem cells from human embryo.Moreover,the cells derived from patients’own tissues are most likely to eliminate immune rejection problems in clinical application.The establishment of iPS technique has triggered the beginning of a brand new research field.
embryo stem cell,induced pluripotent stem cell,cell reprogramming,Nobel Prize in Physiology or Medicine
10.3969/j.issn.0253-9608.2012.06.003
(编辑:段艳芳)
