苦参碱对儿茶酚胺致左心室流出道自律细胞电活动改变的干预作用
2012-08-21王雪芳刘艳明
王雪芳,刘艳明
(1.河北北方学院生理教研室,河北 张家口 075061;2.中国人民解放军251医院心二内科,河北 张家口 075000)
近年来,随着导管消融及起搏器植入技术的不断发展,临床医师发现一些心脏疾病如室性早搏、室性心动过速、心室扑动等恶性心律失常是导致心脏性猝死(sudden cardiac death SCD)的主要原因,并且这些心律失常的发生常与心室流出道组织解剖学结构及生理功能异常相偶联。我教研室早期研究证明,左心室流出道不仅仅是心脏血液的流经通路,其电生理特性表现为具有明显的自律性电活动,是一个潜在的起搏部位,这一部位也受到交感和副交感神经的双重支配,交感神经末梢释放 CA类物质。大多数室性心律失常的药物治疗前景并不乐观,临床研究表明,除β受体阻滞剂外,其他抗心律失常的药物均不能降低死亡率,也不能用于SCD的一级预防用药。研究表明,中药苦参是豆科槐属植物苦参的干燥根,其对多种原因导致的心律失常均有良好的防治效果,但其作用机制尚不明确。本实验应用常规细胞内玻璃微电极记录手段,观察苦参的主要有效成分苦参碱对儿茶酚胺类物质(E、NE、Iso)诱发豚鼠心律失常的电生理作用,对进一步寻找高效低毒中药治疗心律失常,体现中药治疗优势具有非常重要的临床意义和实用价值。
1 材料
1.1 试剂与药品
配制好的K-H灌流溶液(NaCl 0.12mol/L,KCl 0.47 × 10-2mol/L,CaCl20.25 × 10-2mol/L,MgCl20.12 × 10-2mol/L,NaHCO30.18 × 10-2mol/L,KH2PO40.12×10-2mol/L,葡萄糖 0.8 ×10-2mol/L,pH7.3~7.4)限当天使用。实验药物苦参碱购于北京双鹭药业股份有限公司(批准文号国药准字H20030734)。
1.2 动物
选用0.3kg~0.6kg适龄豚鼠,雌雄不拘,实验动物由中国医学科学院动物研究所提供。
1.3 主要仪器
RM-6280C型多道生理信号采集处理系统(成都仪器厂)、电刺激器(SEM-7203,日本光电)、微电极放大器(MEZ-8300,日本光电)、隔离器(SS-202J,日本光电)和记忆示波器(VC-11,日本光电)。
2 方法
2.1 动物标本
速击豚鼠颅致昏,开胸速取心脏,主动脉匀速冲洗,从主动脉瓣的后瓣与左瓣之间迅速剖开动脉壁,斜向右下将心室剖开,三瓣膜保留完整,向下切取长约5mm的心肌组织(含左心室流出道),制成动物标本。制好的流出道标本用钢针固定于橡胶灌流槽内,不过分牵拉标本,用K-H液以15ml/min进行恒速灌流,灌流液中充以纯氧,温度维持在 32℃ ±0.5℃。标本在K-H液中稳定20min后开始实验。
2.2 过程与分组
玻璃微电极内充以3mol/L KCL电极液,测得直流电阻为15Ω~20Ω,使微电极稳定于左心室流出道同一细胞内,记录动作电位图形。如能记录到自发电位则不进行电刺激,若记录不到自发电活动则将刺激电极置于远离瓣膜一端的心肌组织上,给以2倍于阈强度、波宽2ms、主周期300ms~500ms的方波刺激,刺激时间不等,待到诱发出稳定自发电位变化,停止电刺激,稳定20min进行实验。由玻璃电极引导出动作电位,经MEZ-8300微电极放大器放大,一条线路输送到 VC-11记忆示波器进行示波,另一线路经RM-6280C多道生理信号采集处理系统输入计算机观察,同步记录分析动作电位各项参数指标。实验整体分为正常灌流液组、CA组(E,80μmol/L、NE,80μmol/L、Iso,80μmol/L)和 CA+ 苦参碱(100μmol/L)3组。
2.3 观测指标
动作电位幅值(amplitude of action potential,APA),最大舒张电位(maximal diastolic potential,MDP),4相自动除极速率(velocity of diastolic depolarization,VDD),0相最大除极速率(maximal rate of depolarization,Vmax),复极 50%和 80%时间(50 ﹪ and 80 ﹪ of duration of action potential,APD50and APD80),自发放电频率(rate of pacemaker firing,RPF)。
2.4 统计学处理
应用Excel统计软件进行,动作电位各观察数据均用mean+SE表示,CA组和对照组相比;CA+苦参碱和CA组相比,各项指标采用自身配对t检验。
3 结果
表1 苦参碱对儿茶酚胺致左心室流出道自律细胞电活动影响 (±s,n=12)
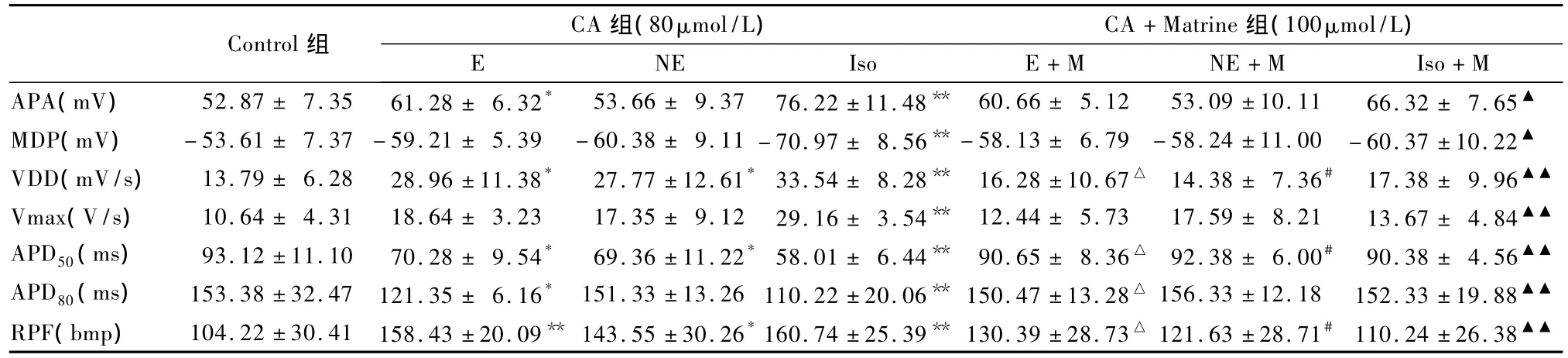
表1 苦参碱对儿茶酚胺致左心室流出道自律细胞电活动影响 (±s,n=12)
注:与对照组比较:*P <0.05,**P <0.01;与 E 比较:ΔP <0.05;与 NE比较:#P<0.05;与 Iso比较:▲▲P<0.01
Control组CA 组(80μmol/L) CA+Matrine组(100μmol/L)NE Iso E+M NE+M Iso+M APA(mV) 52.87 ± 7.35 61.28 ± 6.32* 53.66 ± 9.37 76.22 ±11.48** 60.66 ± 5.12 53.09 ±10.11 66.32 ± 7.65 E▲MDP(mV) -53.61 ± 7.37 -59.21 ± 5.39 -60.38 ± 9.11 -70.97 ± 8.56** -58.13 ± 6.79 -58.24 ±11.00 -60.37 ±10.22▲VDD(mV/s) 13.79 ± 6.28 28.96 ±11.38* 27.77 ±12.61*33.54 ± 8.28** 16.28 ±10.67△ 14.38 ± 7.36# 17.38 ± 9.96▲▲Vmax(V/s) 10.64 ± 4.31 18.64 ± 3.23 17.35 ± 9.12 29.16 ± 3.54** 12.44 ± 5.73 17.59 ± 8.21 13.67 ± 4.84▲▲APD50(ms) 93.12 ±11.10 70.28 ± 9.54* 69.36 ±11.22*58.01 ± 6.44** 90.65 ± 8.36△ 92.38 ± 6.00# 90.38 ± 4.56▲▲APD80(ms) 153.38 ±32.47 121.35 ± 6.16* 151.33 ±13.26 110.22 ±20.06** 150.47 ±13.28△ 156.33 ±12.18 152.33 ±19.88▲▲RPF(bmp) 104.22 ± 30.41 158.43 ±20.09** 143.55 ±30.26*160.74 ±25.39** 130.39 ± 28.73△ 121.63 ±28.71#110.24 ±26.38▲▲
4 讨论
苦参在《本草经百种录》中有这样的记载:“此以味治也,苦入心,寒除火,故苦参专治心经之火。”苦参碱是苦参最主要的有效成分,大量动物实验证实,苦参碱具有调节血脂、抗心律失常、抗肿瘤、抗病毒、抗炎、抗氧化及增强免疫力等功能[1~3]。苦参碱治疗心律失常的研究也越来越成为人们关注的焦点。近年来发现,临床上难以治疗的室性早搏、室性心动过速、心室扑动等恶性心律失常与心室流出道的结构、形态和功能异常有关。目前对心室流出道的生理学特性也越来为人们所越重视,左心室流出道慢反应自律细胞与窦房结起搏细胞离子流基础相似,对左心室流出道慢反应自律细胞离子流的实验分析表明,0期除极化离子流主要为Ca2+、少量Na+内流,复极化过程中 K+离子外流起主导作用;4期自动去极化主要由进行性衰减的K+外流和ICa-L参与;在起搏电流中,If电流也起发挥作用[4]。另研究发现,左心室流出道慢反应自律细胞动作电位呈现多种形态,即具有一定的电生理异质性[5]心肌细胞电生理异质性也受多种病理生理因素如缺血缺氧、再灌注损伤、以及药物等因素的影响,容易出现折返性心律失常,尤其是折返性期前收缩和室性心动过速等心律失常[6,7]。心脏活动受心交感神经和心迷走神经的紧张性调节,心交感神经节后纤维释放去甲肾上腺素(NE)属于儿茶酚胺类物质,作用于心肌细胞膜的 β1受体,通过 G蛋白-腺苷酸环化酶-cAMP途径,使细胞内cAMP水平升高,激活蛋白激酶A,使细胞内很多功能蛋白磷酸化,进而导致心肌细胞的离子流变化,引起心率加快、传导性增加、心肌收缩力增强效应。NE的这种作用与窦房结4期If离子流的激活加快、Ik的去极化衰减加速,和ICa-L增加,这些离子流的变化引起4期自动去极化速度加快,自律性提高有关[8]。这种效应可被 β受体拮抗剂普萘洛尔或选择性β1受体拮抗剂阿替洛尔所阻断。本实验结果显示,用肾上腺素(E)、去甲肾上腺素(NE)、异丙肾上腺素(Iso)这3种儿茶酚胺(CA)类物质灌流豚鼠左心室流出道组织后VDD和RPF明显加快,Iso对左心室流出道自律细胞动作电位的影响强于E、NE,结果证明了CA可以提高左心室流出道自律细胞的自律性。而这一部位又是临床心律失常的异位节律发生部位之一。实验中当给予苦参碱干预后发现20min后动作电位各项指标发生变化,VDD和RPF明显减慢,稳定20min后动作电位各项指标明显发生可逆性变化,VDD和RPF基本恢复正常,这种作用在 Iso组表现尤为明显,而 Iso主要作用于心肌细胞膜的β1受体,故推测苦参碱也是通过影响Iso与β1受体的结合能力来发挥其作用的。从细胞水平来讲,心律失常是心肌动作电位的失常;从分子水平来说,心律失常就是离子流活性的失常。研究发现,CA可以激活心肌细胞膜上的ICa-L使平台期Ca2+内流增加,内流的 Ca2+又激活连接肌质网(JSR)上得RyR受体,JSR释放Ca2+使胞质中的Ca2+浓度进一步升高,同时CA降低肌钙蛋白对Ca2+的亲和力,促使 Ca2+与肌钙蛋白解离,并能促使JSR对Ca2+的回收和心肌细胞膜的Na+-Ca2+交换,加快心肌舒张时胞质中 Ca2+的清除,加速心肌的舒张过程[9]。实验中苦参碱拮抗了这种作用,故认为苦参碱的这种作用可能与其能在平台期降低Ca2+的浓度,降低心肌细胞的兴奋性,延长有效不应期,降低异位节律发生率有关。在慢反应自律细胞,细胞的兴奋性取决于L型Ca2+通道的功能状态,而有效不应期与钾离子电流有关[8,9]。苦参碱拮抗CA导致的左心室流出道慢反应自律细胞MDP、APA、Vmax、VDD、RPF 增高,APD50、APD90减慢。故推测苦参碱是通过抑制左心室流出道慢反应自律细胞的ICa-L,阻碍了细胞复极化过程中的Ca2+内流,降低了IK,使得动作电位4相自动除极化速度变缓,RPF减慢来实现其作用的。
综上所述,本实验的目的是研究苦参碱对儿茶酚胺(CA)诱发豚鼠左心室流出道自律细胞电生理异常及苦参碱抗心律失常的干预作用。结果表明,用苦参碱灌流豚鼠左心室流出道慢反应自律细胞可以降低由CA诱发的RPF升高,可使细胞的兴奋性减弱。提示苦参碱对CA导致的左心室流出道慢反应自律细胞的异常电生理所致的心律失常有确定作用。同时本实验也可以为苦参碱药理机制研究和临床心律失常中医用药打下基础。
[1]黄海平,刘翠华.氧化苦参碱抗大鼠实验性心律失常的作用探讨[J].中国医药指南,2008,11:195-197.
[2]韩向东,陈长勋.苦参碱的心血管药理研究进展[J].中药新药与临床药理,2006,17(1):73-75.
[3]全红,王建明,程立华.苦参总碱贴片抗心律不齐的实验研究[J].中医药学报,2001,29(5):46.
[4]陈彦静,王有明,马建伟,等.心室流出道室性心动过速的电生理学基础[J].中国全科医学,2004,7(18):1303-1305.
[5]王雪芳,刘艳明.苦参碱对低钙诱发豚鼠心律失常的电生理影响[J].中国中医基础医学杂志,2011,17(6):33-234.
[6]张婉,潘振伟,冯铁明.苦参碱对缺血性心室肌细胞快速延迟整流钾电流的作用[J].中国药理学通报,2008,24(3):322-326.
[7]王雪芳,刘艳明,等.炙甘草汤对低钾诱发豚鼠心律失常的电生理影响[J].陕西中医,2007,8(2):233-234.
[8]姚泰.生理学[M].2版.北京:人民卫生出版社,2010:182-183.
[9]韩丹丹,张文杰,刘洁,等.氧化苦参碱对缺血再灌注致心律失常的影响及其机制[J].吉林大学学报,2007,33(6):1047-1049.
