基因芯片分析IFRD1表达沉默后肝癌细胞周期相关基因表达的变化
2012-08-21方肇勤管冬元吴中华
胡 卫,方肇勤,梁 超,管冬元,吴中华
(1.三峡大学医学院,湖北 宜昌 443002;2.上海中医药大学基础医学院,上海 201203)
IFRD1(interferon-related developmental regulator 1,干扰素相关发育调节因子1)基因位于人染色体7q22~q31,含12个外显子,核酸长度2604kb,该基因编码的蛋白质由453个氨基酸组成。已有资料表明,IFRD1在多种细胞中表达,尤其在组织增生或再生中显著表达,提示该基因可能具有促进组织增生的作用[1~3]。由于 IFRD1基因在上皮细胞、成肌细胞、造血细胞、神经细胞等多种组织和细胞分化中均扮演一定的角色[4~6],推测其可能是一个核蛋白,具有转录调控作用。我们前期研究发现,该基因在DEN诱发大鼠肝癌组织中表达升高,经 RNA干扰实验证实,该基因与肝癌细胞SMMC-7721的恶性增殖有关[7]。为进一步探讨其在肝癌发生发展中的作用及机制,我们采用基因芯片检测了该基因表达下调后人肝癌细胞基因表达谱的改变,本文重点关注细胞周期通路相关基因的变化。
1 材料
1.1 细胞株
人肝癌SMMC-7721细胞,购自中科院上海细胞生物所。
1.2 主要试剂和耗材
细胞培养耗材均为corning公司产品,主要试剂有 Trizol(GIBCO BRC)、RNeasy Mini Kit(QIAGEN)、脂质体lipo2000(Invitrogen);实时荧光定量PCR试剂盒(TAKARA,SYBR Premix Ex Taq:Perfect Real Time)、人类表达谱芯片(Affymetrix U133 Plus 2.0 array)、转染载体(pSilencerTm2.1-U6 neo质粒)和BamH I与Hind III限制性内切酶均为Ambion公司产品。
1.3 主要仪器
实时荧光定量PCR仪为GENE公司的Rotor-Gene 3000;酶标仪为 BIO-TEK公司的 ELX8001.3仪器。Agilent-bioanalizer 2100以及 Affymetrix的芯片杂交炉、芯片洗涤系统、芯片扫描仪等。
2 方法
2.1 人肝癌细胞SMMC-7721的培养及脂质体转染
肝癌细胞常规培养,转染前1d取生长对数期的细胞,消化后离心收集细胞并计数,重新用含血清不含抗生素的培养液稀释细胞并分别等量加入新的培养皿中。实验分为正常组(SMMC-7721细胞)、G418组(SMMC-7721细胞 +G418)、阴性组(SMMC-7721细胞+G418+阴性载体对照)、RNAi组(SMMC 7721细胞+G418+IFRD1基因 shRNA)。细胞铺皿后20h以内进行脂质体转染,10cm培养皿每皿需15ml培养液 +2×1.5ml转染培养液(含 24.0 μg质粒DNA+60 μL脂质体)。转染后第2天换成 G418培养液。-
2.2 实时荧光PCR检测干扰效率
脂质体转染后第6天,收集各组细胞 Trizol法提取总 RNA。各实验组取2μg总 RNA进行反转录,再以反转录产物为模板,以GAPDH为内参做相对表达量分析,实时荧光PCR检测干扰效率。IFRD1基因干扰效率的检测引物为:上游GCC CTG GAA TTG AAA GTG AA,下游 TGG GCA TAT GGT CAG CAG TA,扩增产物长度为299bp。GAPDH内参基因的引物分别为:上游 GAG TCA ACG GAT TTG GTC GT,下游 TTG ATT TTG GAG GGA TCT CG,扩增产物长度为238bp。
扩增反应体系(共计 25μL)为:消毒双蒸水9.5μL,SYBR Premix Ex Taq(2 × )12.5μL.上、下游引物(各 5μmol/L)2μL.RT产物 1μL扩增反应条件:95℃ ×30s;95℃ ×5s,60℃ ×30s,40 个循环。结果采用△△CT法加以分析。
2.3 基因芯片检测
Trizol法抽提总 RNA后,采用 RNeasy Mini Kit试剂盒纯化RNA,然后将纯化的RNA样品送至上海生物芯片有限公司进行 RNA质量鉴定(毛细管电泳)及其后续的人基因组表达谱检测(芯片型号U133 plus 2.0 array,合同号为 CB2009559)。
2.4 芯片数据分析
芯片数据分析方法,在参考Affymetrix genechip网站的技术手册基础上,充分利用上海生物芯片有限公司在线的SBC分析系统进行芯片数据处理与分析。
筛选芯片数据中细胞周期通路相关基因,找出表达量变化在1.1倍及以上的基因(上调1.1或下调0.91),并用GenMAPP软件分析对照组与干扰组各基因的比值,以不同颜色标示其上调和下调的倍数:比值 >=1.5(红色),>=1.2(粉红),>=1.1(玫瑰红);比值 <=0.67(蓝色),<=0.83(淡蓝色),< =0.91(灰色)。
3 结果
3.1 IFRD1基因的干扰效率
实时荧光PCR检测发现,IFRD1干扰组目的基因的表达量下降,相对表达量阴性组为3.97,RNAi组为 2.53(图1、图 2)。
3.2 各组细胞总RNA质检及转录特征

图1 IFRD1扩增曲线图

图2 RNAi后各组IFRD1表达量
由RNA质检结果(表1和图3~图7)可以看出,基准峰后18S和28S峰清楚,中间无杂带污染,说明各组细胞抽提的RNA没有出现降解现象。
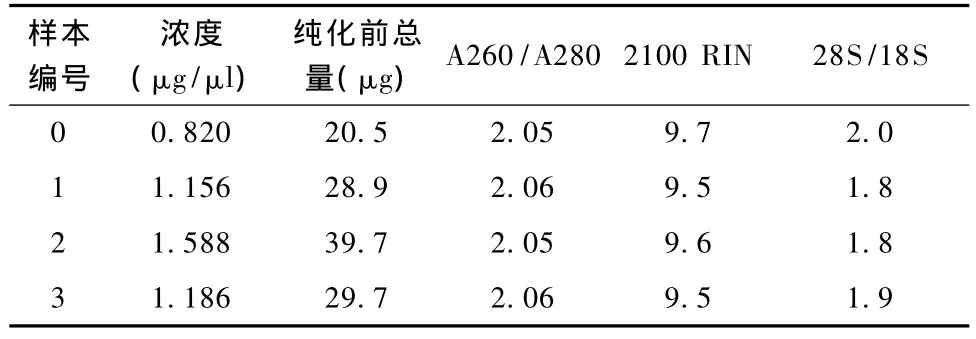
表1 RNA质量检测结果

图3 RNA ladder电泳结果

图4 正常组RNA电泳结果

图5 G418组RNA电泳结果
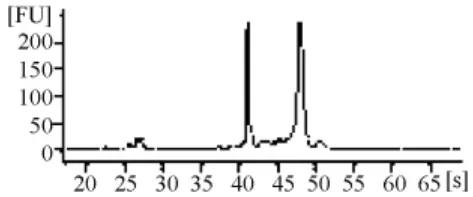
图6 阴性组RNA电泳结果

图7 RNAi组RNA电泳结果
3.3 芯片结果
3.3.1 干扰基因的表达 在数据表中,找到IFRD1基因2个对应转录本,其RNAi实验组与阴性对照组的比值分别为0.71(1555/2178)与0.69(4434/6427),与前面PCR检测结果近似,提示该基因经RNAi后,发生了部分降解,出现表达后沉默现象。
3.3.2 细胞周期通路基因改变 (1)周期蛋白、CDK、CKI表达变化。在真核细胞内,细胞周期主要由周期蛋白(cyclin)-周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)-周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitor,CKI)三者形成的1个精密的调控网络进行监督调控。在细胞周期中,细胞周期蛋白 cyclins是CDK的正向调节因子,CKI为CDK的负向调节因子。表2和图8显示,IFRD1干扰后,细胞周期蛋白cyclin和CDK表达以上调为主,而抑制因子 CKI以下调为主,表明细胞处于生长期;(2)S期DNA合成相关基因表达变化。表3图8显示,在 S期染色体 DNA复制前,要求G1期染色体处于复制前感受状态,该状态需要前复制复合物(PLC)结合在复制起点上。PLC由DNA复制起点识别复合体(ORC)、微型染色体维持蛋白复合物(MCM)以及CDC6和CDC45组成。这种处于复制前状态的染色体必须在特定的CDK-cyclin作用下才能启动DNA复制。ORC由ORC1L、ORC2L、ORC3L、ORC4L、ORC5L、ORC6L 6 个亚基构成,均参与 DNA 复制,其中亚基 1、2、4、5在复制启动中发挥重要的功效。微型染色体维持蛋白基因家族由 MCM2、MCM3、MCM 4、MCM 5、MCM 6、MCM 7组成蛋白复合体,均参与DNA复制、复制启动及转录调控等环节。IFRD1干扰后,MCM蛋白复合体以下调为主,ORC表达均下调,而 CDC6和 CDC45表达也下调,提示 RNAi组细胞 S期 DNA合成不活跃,染色体复制受阻;(3)细胞周期其他相关分子的变化。表4图8显示,从芯片结果可以看出,G1/S期检测点 p21、p57表达均下调,说明 G1/S期转化顺利;G2-M期检测点关键基因如MAD2L1、MAD2L2和BUB3等表达均上调,提示细胞有丝分裂受阻,细胞不能顺利从G2期进入M期分裂增殖;一些抑制细胞增殖因素如 TP53、MDM2表达均上调,亦提示细胞分裂增殖不活跃。

表2 IFRD1 RNAi后细胞周期通路CDK及相关分子表达

表3 IFRD1 RNAi后细胞周期通路S期DNA合成相关基因表达变化
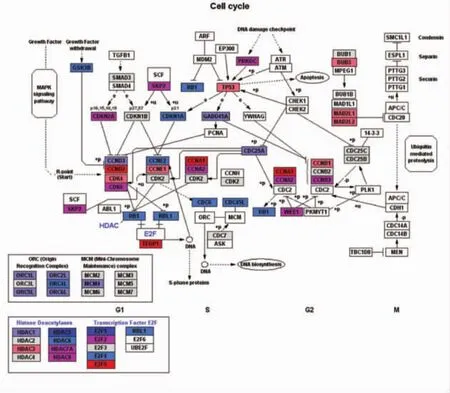
图8 细胞周期基因表达量变化

图9 G1-S基因表达量变化
4 讨论
基因芯片技术因其可以同步开展成千上万个基因表达的检测,形成较为完整的细胞基因表达谱,具有高通量、高速度、平行化等优点,成为目前研究基因表达的最有力的工具之一。近年来,该技术在中医药防治肿瘤的研究中得到了广泛的应用[8]。本研究在RNA干扰下调 IFRD1基因表达水平后,采用人类表达谱芯片检测该基因在肝癌细胞中表达降低后引起肝癌细胞基因表达谱的变化,以期阐明其影响肝癌发生发展的机制。

表4 IFRD1 RNAi后细胞周期通路其它基因的变化
“细胞周期”也称“细胞分裂周期”,是指一个细胞经生长、分裂而增殖成2个细胞的全过程,依次分为G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和 M期(有丝分裂期)。细胞周期的准确调控对生物的生存、繁殖、发育和遗传十分重要。
本研究发现,IFRD1干扰后引起大量基因的变化。芯片结果显示,细胞周期蛋白和CDK表达上调为主,CKI表达下调为主,提示细胞周期比较活跃;G1/S期检测点p21、p57表达均下调,表明 G1-S期转换顺利;但S期DNA合成相关基因以下调为主,提示S期 DNA合成受到抑制,有丝分裂检测点受阻,最终导致细胞增殖分裂受限。这可能是IFRD1基因RNA干扰后导致人肝癌细胞增殖变缓的机制。
[1]Swietlicki E,Iordanov H,Fritsch C,Yi L,Levin MS,Rubin DC.Growth factor regulation of PC4/TIS7,an immediate early gene expressed during gut adaptation after resection[J].JPEN J Parenter Enteral Nutr,2003,27(2):123-131.
[2]Han H,Hansen TR,Berg B,Hess BW,Ford SP.Maternal undernutrition induces differential cardiac gene expression in pulmonary hypertensive steers at high elevation[J]. Am J Physiol Heart Circ Physiol,2008,295(1):H382-389.
[3]Micheli L,Leonardi L,Conti F,Buanne P,Canu N,Caruso M,Tirone F.PC4 coactivatesMyoD by relieving the histone deacetylase 4-mediated inhibition of myocyte enhancer factor 2C[J].Mol Cell Biol,2005,25(6):2242-2259.
[4]Roth A,Gill R,Certa U.Temporal and spatial gene expression patterns after experimental stroke in a rat model and characterization of PC4,a potential regulator of transcription[J].Mol Cell Neurosci,2003,22(3):353-364.
[5]Vietor I,Huber LA.Role of TIS7 family of transcriptional regulators in differentiation and regeneration[J].Differentiation,2007,75(9):891-897.
[6]Vietor I,Vadivelu SK,Wick N,Hoffman R,Cotten M,Seiser C,Fialka I,Wunderlich W,Haase A,Korinkova G,Brosch G,Huber LA.TIS7 interacts with the mammalian SIN3 histone deacetylase complex in epithelial cells[J].EMBO J,2002,21(17):4621-4631.
[7]梁超,方肇勤,管冬元,等.RNAi检测 IFRD1在肝癌增殖中的作用及不同中医治法的调节[J].世界科学技术·中医药现代化,2010,12(5):723-729.
[8]胡卫,方肇勤.基因芯片技术在中医药防治肿瘤研究中的应用[J].上海中医药大学学报,2009,23(3):84-86.
