鸡肉空肠弯曲杆菌的分离鉴定及耐药性分析*
2012-08-21韩新锋刘书亮张晓利侯小刚
韩新锋,刘书亮,,张晓利,陈 荀,侯小刚
空肠弯曲杆菌(Campylobacterjejuni)是一种常见的人兽共患病原菌,主要导致人急性肠炎和食物中毒,并有可能进一步引发反应性关节炎、肝炎和格林-巴利综合征等免疫损伤性疾病[1]。空肠弯曲杆菌广泛存在于各种温血动物体内,其中鸡是带菌率最高的动物(最高可达100%)[2]。在发达国家,空肠弯曲菌在腹泻病人中的分离率已超过5%,超过了沙门氏菌和志贺氏菌。而在中国,空肠弯曲杆菌也是主要的腹泻病原菌之一。食用受到污染的动物产品、未经煮熟的禽肉和生牛奶是人类感染该菌的主要途径[3]。近些年,空肠弯曲杆菌感染率有上升的趋势,控制食品原料及食品中空肠弯曲杆菌的污染并加强食品中空肠弯曲杆菌的监测具有重要意义。
本研究旨在组合出一套对食源性空肠弯曲杆菌分离率高、鉴定准确的方法,从市场鸡肉中分离空肠弯曲杆菌,经生化试验和PCR鉴定后,对空肠弯曲杆菌分离株进行常见药物的敏感性试验,为空肠弯曲杆菌的分离鉴定和防制提供依据,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株 空肠弯曲杆菌(ATCC33560)、金黄色葡萄球菌(ATCC29215)、大肠杆菌(ATCC25922)由中国农业大学动物医学院吴聪明博士惠赠;单核细胞增生性李斯特菌(GIM1.228),购于广东省微生物研究所;植物乳杆菌、藤黄微球菌(ATCC10209)、铜绿假单胞杆菌(ATCC27853)、粪链球菌、热死环丝菌、沙门氏菌、奇异变形杆菌、枯草芽孢杆菌由四川农业大学食品微生物实验室收集保存。
1.1.2 培养基 Skirrow 琼脂、CCDA 琼脂、布氏肉汤购自北京陆桥技术有限公司;哥伦比亚琼脂购自北京奥博星生物技术有限责任公司;三糖铁培养基、M-H培养基、TTC(2,3,5-氯化三苯四氮唑)培养基、甘氨酸培养基、马尿酸钠培养基、肉汁胨培养基、肉汤培养基购自杭州天和微生物试剂有限公司。1.1.3 药物 青霉素类:氨苄西林(AMP);头孢类:先锋唑啉(CFZ)、头孢曲松钠(CTX)、头孢噻呋钠(CEF);氨基糖苷类:硫酸链霉素(STR)、硫酸庆大霉素(GEN)、硫酸阿米卡星(AMK)、硫酸卡那霉素(KAN)、盐酸大观霉素 (SPE)、硫酸 红霉素(EM)、阿奇霉素(AMZ);林可胺类:盐酸林可霉素(LIC);四环素类:盐酸四环素(TET)、强力霉素(DOTC);氯霉素类:氯霉素(CHL);磺胺类:甲氧苄啶(TRI)、磺胺异恶唑(SIA)、磺胺甲基异噁唑(SXT);喹诺酮类:萘啶酸(NA)、盐酸环丙沙星(CIP)、恩诺沙星(ENR)、盐酸洛美沙星(LMF)。以上所有抗菌药物均为原药粉,由课题组提供;头孢哌酮购自北京康蒂尼药业有限公司;P-714号抗生素混合液(万古霉素1.5 mg,三甲氧苄氨嘧啶乳酸盐0.76 mg,多粘菌素B 500 IU)购自北京陆桥生物技术有限公司。
1.1.4 试剂 标准新生牛血清、脱纤维羊血购自烟台开发区品格林实验室配套设备有限公司;1%氯化血红素、维生素K1购自嘉康源科技发展有限公司。过氧化氢、二甲基对苯二胺、三氯化铁、格里斯氏试剂等均为进口或国产分析纯试剂。Gold View核酸染料、2×long Taq PCR Master Mix、D2000 DNA Marker购于北京天根生化有限公司;Bacterial DNA Out抽提试剂盒购于绵阳天泽基因工程有限公司;PCR扩增引物,由上海英骏生物技术有限公司合成;琼脂糖凝胶DNA回收试剂盒,p MD18-T Vector克隆载体、Ligation Mix购于宝生物工程有限公司。
1.1.5 主要仪器和设备 MyCycler PCR 仪(Bio-Rad),SORVALL冷冻离心机(美国科俊仪器有限公司),OLYMPUS 显 微 镜 (OLYMPUS),PB-2B p H 计(SARTORIUS),显微成像系统(Bio-RAD),Milli-Q Gradient超纯水系统(Millipore公司)等。1.1.6 样品 按照食品样品的采样方法从四川省雅安市市场上分次采集鸡肉样品共183份。用保鲜袋包好采集的肉样,填好标签,置于备有冰袋的泡沫盒中运送到实验室检验。
1.2 方法
1.2.1 增菌培养 将新鲜肉样剪碎,并取约5 g放入50 m L带螺旋口的无菌离心管中,加入布氏肉汤至离心管口约2 cm,拧紧管盖,先在37℃下培养4 h,再加入100μL头孢哌酮(30 mg/L),拧紧管盖颠倒混匀[4],再于42℃下培养48 h。
1.2.2 分离纯化 取10μL增菌液划线于Skirrow平板上,微需氧条件下培养48 h。挑取符合空肠弯曲杆菌典型形态的菌落划线于CCDA平板上,培养48 h后,在平板上挑取灰色、扁平、像水珠的菌落划线于哥伦比亚血平板上进行纯化。根据ISO方法[5],将纯化的疑似菌株同时接种于血培养基和营养琼脂培养基上,若只在血平板上生长而琼脂平板上不生长,则保存菌种。
1.2.3 培养方法 将接菌后的平板置于清洁、干燥的干燥器内。缸盖及缸口涂以凡士林,放入小段点燃蜡烛于缸内,盖密缸盖。缸内燃烛因氧减少自行熄灭,此时容器内约含二氧化碳5%~10%。随后连同容器一并置于42℃培养箱中培养。
1.2.4 菌株的保存 将分离得到的菌株,接种于含10%小牛血清的布氏肉汤中培养48 h。将菌液转入无菌EP管中,加入甘油生理盐水使混合液中甘油浓度达到20%,-20℃保存。
1.2.5 菌种的初步鉴定 根据菌落生长特征、革兰氏染色特征、氧化酶试验和过氧化氢酶试验结果,按照 GB/T 4789.9-2003进行结果判定。
1.2.6 生化试验 按照 GB/T 4789.9-2003进行甘氨酸耐受试验、硫化氢生长试验、3.5%氯化钠的耐受性试验、25℃和42℃生长试验、马尿酸钠水解试验、萘啶酸试验、TTC(2,3,5-氯化三苯四氮唑)试验、硝酸盐还原试验。
1.2.7 分子生物学鉴定
1.2.7.1 引物设计 根据GenBank公布的空肠弯曲杆菌16S r DNA序列(登录号AL111168),利用Primer 5设计一对特异性引物,引物序列如下:
正向引物 F:5’AAT CAC TGG GCG TAA AGG 3’
反向引物 R:5’CGG TAT TGC GTC TCA TTG TAT3’
1.2.7.2 细菌总DNA的提取 将菌种接种于3 m L布氏肉汤(含10%新生牛血清)中,42℃微需氧条件下培养24 h,收集菌体。用Bacterial DNA out抽提试剂盒提取菌株的总DNA,-20℃保存备用。1.2.7.3 PCR扩增 PCR反应体系为25μL,包括:2×Taq PCR Master Mix 12.5μL(包括:0.1U long Taq polymerase/μL,500μmol/L d NTP,20 mmol/L p H8.3 Tris-HCl,3 mmol/L MgCl2),DNA模板1μL,引物各1μL,超纯水9.5μL。循环参数为:94℃预变性4 min,然后94℃30 s,54℃30 s,72℃30 s,35个循环后72℃延伸6 min。配制1.2%琼脂糖凝胶,取5μL PCR产物加样,70 V电压电泳40 min,凝胶成像系统拍照、分析试验结果。
1.2.7.4 PCR产物的克隆、测序和序列比对 利用DNA凝胶回收试剂盒回收纯化PCR产物,成功克隆至p MD18-T载体,送交上海英骏(Invitrogen)生物技术有限公司测序。将空肠弯曲杆菌标准菌株ATCC33560和分离株CJ-5的16S r DNA序列通过Blast程序与GenBank中核酸数据进行比对分析(http://www.ncbi.nlm.nih.gov/blast),并 用DNAStar软件绘制系统进化树。
1.2.8 药敏试验 按照美国临床实验室标准化协会(CLSI,前 NCCLS)规定进行[6]。无菌96孔板第1-11列加入灭菌 M-H肉汤(含10%新生牛血清)100μL,第1列加入100μL药物,混合均匀后,逐次2倍比梯度稀释至第11列,最后一列吸取100μL混合液弃去。将培养至48 h的M-H肉汤菌液稀释至0.5麦氏比浊管后,再用无菌M-H肉汤稀释100倍,分别取100μL菌液稀释液加入96孔板第1-11列各孔中,混合均匀。每个菌株设置两个平行试验。第12列上4孔加入200μL/孔灭菌MH肉汤作为阴性对照,第12列下4孔加入200μL/孔菌液作为阳性对照。药物和菌液上样完毕后,盖好板盖,置37℃微需氧条件下培养42 h。加TTC试剂(0.5%)1~2滴,培养30 min,最后观察结果,记录最低抑菌浓度值(MIC)。以空肠弯曲杆菌标准菌(ATCC33560)作为质控菌株。参考CLSI标准和文献[7-8],符合表1所列标准则判定菌株耐药。

表1 空肠弯曲杆菌的药敏试验判定标准Tab.1 Breakpoints applied for the interpretation of antimicrobial sensitiving test of C.jejuni
2 结 果
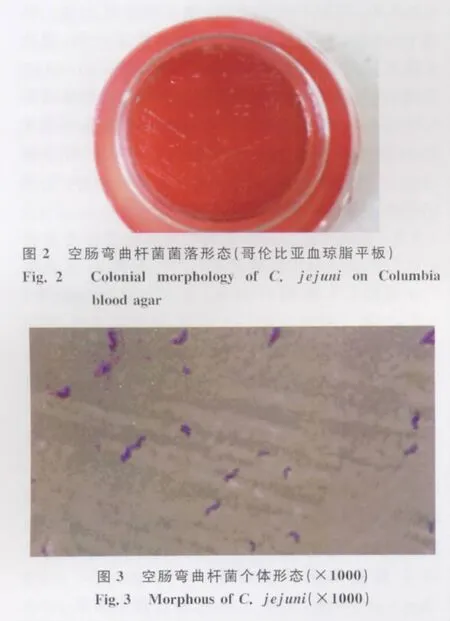
2.1 分离纯化 疑似空肠弯曲杆菌在CCDA培养基上为灰白、湿润的菌落(图1),在哥伦比亚血琼脂平板上的菌落特征为不溶血、扁平、灰色不闪光、半透明、白色、棕黄色凸起、边缘不整齐、有时沿接种线向外扩散的典型菌落(图2)。涂片作革兰氏染色镜检为G-菌,大小为(0.3~0.4)μm×(1.5~3)μm,如小逗点状,两菌体的末端相连时,呈S形、海鸥形或螺旋状(图3)。在固体培养基上培养时间过久或在不适条件下则常呈现球形或球杆形菌。
2.2 生化试验 具备以下特征的菌株可初步鉴定为空肠弯曲杆菌:镜检符合弯曲杆菌形态特征、接触酶试验阳性、氧化酶试验阳性、可在血平板上生长而不能在营养琼脂平板上生长。据此从183份鸡肉中初步分离得到36株疑似菌株。
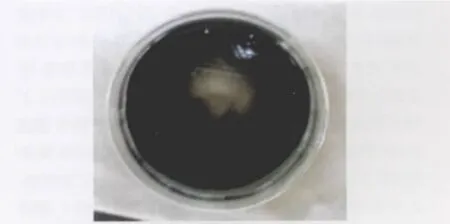
图1 空肠弯曲杆菌菌落形态(CCDA)Fig.1 Colonial morphology of C.jejuni on CCDA
生化试验结果符合如下特征者可进一步判定为空肠弯曲杆菌:1%甘氨酸耐受试验阳性,硫化氢试验阳性,3.5%氯化钠耐受试验阴性,25℃生长试验阴性,42℃生长试验阳性,马尿酸钠水解试验阳性,硝酸盐还原试验阳性,萘啶酸试验阴性,TTC试验阴性。经生化试验进一步鉴定出25株为空肠弯曲杆菌,编号为CJ-1~ CJ-25。
2.3 分子生物学鉴定
2.3.1 PCR鉴定空肠弯曲杆菌的特异性 所建立的PCR方法只能从空肠弯曲杆菌扩增出长约700 bp的特异性片段,不能从金黄色葡萄球菌、大肠杆菌、藤黄微球菌、铜绿假单胞杆菌、单核细胞增生李斯特氏菌、粪链球菌、热死环丝菌、沙门氏菌、植物乳杆菌、奇异变形杆菌和枯草芽孢杆菌等11种细菌得到扩增产物,具有良好的特异性。电泳结果见图4。2.3.2 鸡肉空肠弯曲杆菌分离株的16S r DNA扩增 对生化试验结果阳性的25株空肠弯曲杆菌进行PCR鉴定,结果见图5a、5b,其中第6、8、18和19号(共4株)为阴性,其余21株PCR结果均为阳性。2.3.3 空肠弯曲杆菌16S r DNA序列分析 测序结果表明,分离株CJ-5的16S r DNA扩增片段长711 bp。将序列提交至 Gen Bank,登录号为GQ249179。采用BLAST和DNASTAR Meg Align对空肠弯曲杆菌标准菌株ATCC33560和CJ-5分离株进行序列比对并绘制系统进化树(图6),表明两个菌株与登录号为AF372091.1、EU127523.1的空肠弯曲杆菌16S rDNA相应序列同源性为99.9%~100%。与同为弯曲菌属的结肠弯曲杆菌(C.coli)、海鸥弯曲杆菌(C.lari)的同源性则稍低(98.7%~99.4%),与副溶血弧菌(V.tubiashi)和大肠杆菌(E.coli)的16S r RNA的相应基因序列的同源性较低(75.5%~76.6%)。

图4 PCR鉴定空肠弯曲杆菌的16S r DNA电泳图Fig.4 PCR identification of C.jejuni targeted on 16S rDNA geneM:DNA Marker D2000;1.Campylobacter jejuni;2.Streptococcus faecalis;3.Escherichia coli;4.Staphylococcus aureus;5.Listeria monocytogenes;6.Micrococcus luteus;7.Pseudomonas aeruginosa;8.Brochothrix thermosphacta;9.Salmonella;10.Proteus mirabilis;11.Lactobacillus plantarum;12.Bacillus subtilis
通过对鸡肉分离菌株的培养特征、形态特征、生化试验、PCR鉴定和序列分析,最终从四川雅安市采集的183份鸡肉样品中分离得到21株空肠弯曲杆菌,污染率为11.5%(21/183)。
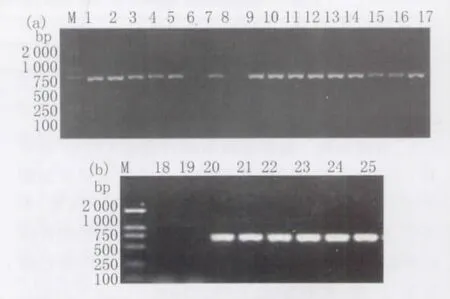
图5 (a、b)鸡肉空肠弯曲杆菌分离株16S rDNA PCR扩增产物电泳图Fig.5 (a,b)PCR results targeted on 16S r DNA of 25 suspected C.jejuni strains of chicken originM:DNA Marker D2000;lane 1-25,suspected isolates from chicken
2.4 药敏试验结果 肉汤微量稀释法测定分离菌株对常见抗菌药物(组合)的敏感性表明,对氨苄西林耐药率为14.3%,对萘啶酸的耐药率为42.9%。所有菌株对环丙沙星、四环素、红霉素、氯霉素、庆大霉素、链霉素不耐药(表2)。空肠弯曲菌分离株对头孢类抗生素MIC值普遍偏高,对甲氧苄啶和磺胺甲基异恶唑MIC值高,对恩诺沙星和盐酸洛美沙星MIC值较低。
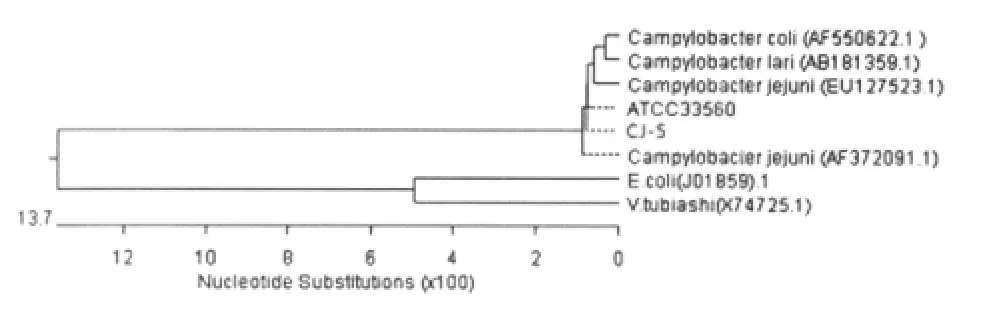
图6 空肠弯曲杆菌ATCC33560和CJ-5的16S r DNA序列比对进化树Fig.6 Phylogenetic tree of ATCC33560 and CJ-5 based on 16S rDNA gene

表2 鸡肉空肠弯曲杆菌分离株对8种抗菌药物的敏感性(n=21)Tab.2 Resistance to 8 antibiotics in C.jejuni isolated from chicken(n=21)
3 讨 论
空肠弯曲杆菌在食品样品中的存在量很低,对周围环境敏感且易进入活的但不可培养(VBNC)状态,样品的处理方法尤其是增菌方法是影响其分离或检测的一个关键环节。通过对比发现,FDA/BAM、USDA/FSIS、ISO 都有前增菌过程,有利于空肠弯曲杆菌的增殖。由于食品中的空肠弯曲杆菌多是受到损伤或是处于VBNC状态的细胞,它们能够在水体或肉类中存活,但增殖状况较差,并且对于选择性增菌培养基中抗生素(多粘菌素B、磺胺类等)药物较为敏感。因此,首先采用37℃、4 h的条件进行前增菌,使受损细菌得到恢复,然后采用选择性增菌培养,可提高其检出率。Oliveira等[9]对比了增菌前后的检出率,发现增菌后的检出率比增菌前提高了13%,1 CFU/m L菌液增菌24 h后可增至(2.5~8.5)×102CFU/m L。USDA/FSIS推荐增菌液中加入头孢哌酮,能有效抑制杂菌,有利于空肠弯曲杆菌的生长。Sallam[4]等利用离心管对空肠弯曲杆菌进行增菌取得了很好的效果。本研究参照该方法使用能够密封的离心管作为增菌容器,在增菌的前期好氧菌大量繁殖降低了离心管中的氧含量,提供一个适宜于空肠弯曲杆菌生长的环境。空肠弯曲杆菌常用的选择性分离培养基主要有两大类:一类是含血液的培养基如Campy-BAP琼脂、Skirrow琼脂和Butzler氏琼脂等;另一类是不含血液的培养基如CCDA、卵黄琼脂和微量铁盐琼脂等。培养基中的血液、碳粉和铁盐可以吸附氧气和毒性物质保证空肠弯曲菌具有良好的生长状态。值得推荐的是ISO方法[5]在分离时,同时使用血平板和营养琼脂平板。空肠弯曲杆菌不能在无血的营养琼脂平板上生长,可据此对空肠弯曲菌进行筛选。为达到空肠弯曲杆菌生长所需要的微需氧条件,常使用的方法有:换气法、烛缸法、减压产气法及微氧袋法等。本研究采用烛缸法培养标准菌株ATCC33560后,镜检观察到S型短杆菌,视野中未发现任何球形菌,表明烛缸法能够用于空肠弯曲杆菌的培养。
空肠弯曲杆菌的准确鉴定可以为其流行病学和危害评估提供重要依据,弯曲菌属内各种的危害程度不同增加了对其种水平精确鉴定的要求。由于空肠弯曲杆菌培养条件的苛刻和生化反应的惰性,其生化鉴定较为困难。测定16S r DNA基因序列已成为确定原核生物分类位置的重要依据。16S r DNA具有功能和进化上的同源性、极端保守性,原核生物序列差异≤1%~1.5%的细菌属于同一种[10]。Kaufmann等[11]根据ISO1027:1995推荐的生化方法对鸡肉中分离的空肠弯曲杆菌进行鉴定,同时PCR扩增16S r DNA高特异性序列进行鉴定,结果显示2.9%生化鉴定阳性的菌株经PCR鉴定为阴性。本研究中,16%生化鉴定阳性的菌株经PCR鉴定为阴性,21个分离株被准确鉴定为空肠弯曲杆菌,污染率为11.5%。较同样采用平板分离检测的吴斌(2.3%)[12]污染率高,表明所调查的市场鸡肉中空肠弯曲杆菌的污染较严重,也说明组合的增菌和分离方法效果好且敏感性提高。
空肠弯曲杆菌的耐药性日趋严重的问题已经引起了世界各国的重视,但目前还没有广泛认可的空肠弯曲杆菌耐药标准,阻碍了空肠弯曲杆菌耐药性的研究。本研究为食源空肠弯曲杆菌的耐药性研究提供了一定的基础数据。结果显示空肠弯曲杆菌分离株对氨苄西林耐药率为14.3%,对头孢类抗生素MIC值普遍偏高。人类可通过食用受到耐药菌株污染的食物而感染发病,并且会产生耐药性,所以应该引起高度的重视。空肠弯曲杆菌对氨苄西林的耐药率国外报道比国内报道低。Tremblay等[13]对59株空肠弯曲杆菌进行药敏试验,没有一株具有耐药性,而侯凤琴等[14]1994-1998年对从医院临床分离的空肠弯曲杆菌进行药敏试验,其耐药率为27.1%~50%。由于空肠弯曲杆菌至少含有一个或两个耐甲氧苄啶基因,因此它对甲氧苄啶类药物具有天然的耐药性[15],本试验结果与之一致,测得的对甲氧苄啶MIC值最低为40 mg/L,最高为1 280 mg/L。所有分离株对环丙沙星、四环素、红霉素、氯霉素、庆大霉素、链霉素不耐药。国外研究表明空肠弯曲杆菌对红霉素(80%)、克林霉素(64%)、卡那霉素(76%)、氨苄青霉素(31%)和环丙沙星(67%)有不同程度耐药性[16-17],而对庆大霉素最为敏感。也有研究表明空肠弯曲杆菌对氨苄青霉素(81.6%),环丙沙星(71.4%),四环素(26.5%)耐药,并且有30.6%的菌株显示多重耐药性[18]。这可能和国外曾经一度大量使用喹诺酮类药物来治疗家禽的腹泻等疾病有关。本文中空肠弯曲杆菌分离株对萘啶酸的耐药率为42.9%,对其它喹诺酮类药物的 MIC值很低,可能与鸡饲养用药或菌株数量有限有关。值得注意的是,我国制定的《食品动物禁用的兽药及其它化合物清单》并没有禁止喹诺酮类药物在食品动物中的使用,仍需加强监测。
本研究为基层检验检疫部门调查食源性空肠弯曲杆菌的流行规律和进行危害(如耐药性等)评估提供了理论依据和实用方法,也为进一步建立空肠弯曲杆菌准确的预警机制和制定有效的防制措施提供了参考。
[1]Bereswill S,Kist M.Recent developments in Campylobacter pathogenesis[J].Current Opinion in Infectious Diseases,2003,16(5),487 491.
[2]Smith MV,Muldoon PJ.Campylobacter fetus subspecies jejuni(Vibrio fetus)from commercially processed poultry [J].Applied Microbiology,1974,27(5):995-996.
[3]Friedman CR,Hoekstra RM,Samuel M,et al.Risk factors for sporadic Campylobacter infections in the United States:a casecontrol study on Food Net sites[J].Clinical Infectious Diseases,2004,38(S3):285-296.
[4]Sallam KI.Prevalence of Campylobacter in chicken and chicken by-products retailed in Sapporo area,Hokkaido,Japan [J].Food Control,2007(18):1113-1120.
[5]国际标准化组织.ISO10272-1[S].Microbiology of food and animal feeding stuffs Horizontal method for detection and enumeration of Campylobacter spp.2006:5.
[6]Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[S].8th edition.Approved standard M07-A8.Villanova,PA:NCCLS;2009:15-18.
[7]Papavasileiou H,Papavasileiou K,Chatzipanagiotou S,et al.E-volution of antimicrobial susceptibility ofCampylobacterjejunistrains isolated from hospitalised children in Athens[M].Greece:17th European Congress of Clinical Microbiology and Infectious Diseases,2007:925.
[8]Andersen SR,Saadbye P,Sukri NM,et al.Antimicrobial resistance amongCampylobacterjejuniisolated from raw poultry meat at retail level in Denmark [J].International Journal of Food Microbiology,2006,107(3):250-255.
[9]Oliveira TC,Barbut S,Griffiths MW,Detection ofCampylobacterjejuniin naturally contaminated chicken skin by melting peak analysis of amplicons in real-time PCR [J].International Journal of Food Microbiology,2005,104(1):105-111.
[10]Oyazabal OA,Wesley IV,Harmon KM,et al.Specific identification ofCampylobacterfetusby PCR targeting variable regions of the 16Sr DNA [J].Veterinary Microbiology,1997,58(1):61-71.
[11]Kaufmann P,Pfefferkorn A,Teuber M,et al.Identification and quantification of Bifid bacterium species isolated from food with genus specific 16S r RNA-targeted probes by colony hybridization and PCR [J].Applied Environmental Microbiology,1997,63(4):1268-1273.
[12]吴斌,秦成,钱斯日古楞.肉及肉制品中空肠弯曲菌的污染情况调查[J].中国微生态杂志,2004,116(14):212-213.
[13]Tremblay C,Gaudreau C.Antimicrobial susceptibility testing of 59 strains ofCampylobacterfetussubsp.fetus[J].Antimicrobial Agents and Chemotherapy,1998,42(7):1847-1849.
[14]侯凤琴,沈宝铨,孙新婷.200株空肠弯曲菌对30种抗生素敏感性研究[J].医师进修杂志,2001,24(3):39-40.
[15]Gibreel A,Skold O.An integron cassette carryingd frl with 90 bp repeat sequences located on the chromosome of trimethoprim-resistant isolates ofCampylobacterjejuni[J].Microbial Drug Resistance,2000,6(2):91-98.
[16]Hong J,Kim JM,Jung WK,et al.Prevalence and antibiotic resistance of Campylobacter spp.isolated from chicken meat,pork and beef in Korea from 2001 to 2006[J].Journal of Food Protection,2007,70(4):860-866.
[17]Wardak S,Szych J,Zasada AA,et al.Antibiotic resistance ofCampylobacter jejuniandCampylobactercoliclinical isolates from Poland [J],Antimicrobial Agents and Chemotherapy,2007,51(3):1123-1125.
[18]Jain D,Sinha S,Prasad KN,et al.Campylobacter species and drug resistance in a north Indian rural community[J].Transactions of the rural society of tropical medicine and hygiene,2005,99(3):207-214.
