博尔纳病病毒p24和p40基因星形胶质细胞特异表达重组质粒的构建*
2012-08-21李文娟亮1婧1戈1黄荣忠1鹏1
李文娟,张 亮1,,邓 婧1,,金 戈1,,黄荣忠1,,房 亮,谢 鹏1,
2.重庆医科大学神经科学研究中心,重庆市神经生物学重点实验室,重庆 400016;
博尔纳病毒(Borna disease virus,BDV)属于单分子负链RNA病毒目博尔纳病毒科博尔纳病毒属,1994年Briese等和Cubitt B等分别对Giessen株和V株BDV基因组测序,发现其共有8910bp[1-2]。BDV 基因组有 6 个主 要 开 放 读 码 框(Open reading frame,ORF),分别编码核蛋白(N,p40)、磷蛋白(P,p24)、基质蛋白(M,gpl8)、糖蛋白(G,gp94)、RNA 聚合酶 (L)和非糖基化的特殊蛋白 (X)[3]。研究发现p24和p40为BDV的两种重要结构蛋白,在感染宿主细胞与组织中高度表达,通常作为BDV检测的主要标志,在病毒致病中亦发挥重要作用[4-5]。BDV 感染宿主广泛,几乎能感染所有温血动物,且为严格嗜神经病毒,能持续感染动物中枢神经系统。星形胶质细胞是中枢神经系统中含量丰富的一种神经胶质细胞,生理功能广泛,对维持中枢神经系统内环境的稳定有重要作用。BDV能感染神经元并侵袭其周围的星形胶质细胞,势必引起星形胶质细胞功能紊乱,从而导致宿主神经功能障碍。因此,阐明BDV及病毒蛋白与星形胶质细胞的相互关系及作用机制对于理解BDV感染所导致的神经病理及神经生物学改变有重要意义。本实验选择含有GFAP启动子的星形胶质细胞特异性表达载体,分别制备了p24和p40重组质粒,为后续研究p24和p40单个病毒蛋白在BDV致病中的作用及与星形胶质细胞相互作用机制提供工具。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 PCR 仪(BIO-RAD PTC-200 DNA Engine cycler),凝胶成像系统(ChemiDocTM,Bio-Rad),恒温培养振荡器(ZHWY-103B,上海智城),分光光度仪(NanoDrop 1000,Thermo),离心机(Heraeus FrescoTM21,Thermo),CO2培养箱(SERIES II,Thermo),超净工作台(SW-CJ-1D,苏州净化),电泳仪(BG-Power 600,北京百晶),DNA限制 性 内 切 酶 (NEB),DNA 聚 合 酶 KOD-plus(TOYOBO),r Taq酶,DNA Ligation Kit和 DNA Marker(Ta KaRa),天根 DP103-离心柱型质粒小提试剂盒,A型小量DNA片段快速胶回收试剂盒(北京博大泰克),柱式浓缩型PCR产物纯化试剂盒(上海华舜),LB培养基为实验室自配(胰蛋白胨和酵母提取物为英国OXOID产品,NaCl购于上海生工),DMEM/High glucose(Hyclone),胎牛血清(Hyclone),青/链霉素浓缩液(Hyclone),质粒转染试剂盒(1ipofectamine-2000,Invitrogen),小鼠二步法免疫组化检测试剂(北京中杉),BDV p24/p40多抗(南京金斯瑞公司订制),其他试剂均为国产分析纯。
1.1.2 质粒、菌株与细胞 p QE-BDV p24和p QEBDVp40质粒由哈尔滨医科大学微生物教研室张凤民教授惠赠,p QE质粒载体含氨苄抗性基因,p QEBDVp24质粒包含BDVp24全长序列,p QE-BDVp40质粒包含BDVp40全长序列。p CMvie-GFAP质粒载体来自中国科学院上海生命科学院神经所,包含GFAP启动子、多克隆位点(MCS)、卡那抗性基因。p MD18-T载体购自 Ta KaRa公司。DH5α购自天根生化科技(北京)有限公司。U251细胞(美国模式培养物集存库)。
1.1.3 引物设计 设计两对引物分别扩增p24和p40蛋白的完整碱基序列,并分别在上下游引物5’端加入NheI和EcoR I酶切位点和保护碱基,引物由上海英骏生物技术有限公司合成,引物序列见表1。
表1 PCR引物Tab.1 PCR primers
1.2 方法
1.2.1 基因片段的扩增 分别以p QE-BDVp24和p QE-BDVp40质粒为模板进行PCR,加样总体系50 μL,其中质粒模板1μL,KOD PlusDNA聚合酶:2 μL,d NTP Mix:5μL,10×Buffer:5μL,MgSO4:4 μL,引物 F和引物 R 各1.5μL,dd H2O:32μL。PCR条件:94℃预变性2 min;98℃变性15 s,55℃ 退火30 s,68℃延伸2 min,35个循环;68℃再延伸10 min。PCR结束后,先取5μL产物上样进行1.0%琼脂糖凝胶电泳(电压7 V/cm电泳缓冲液为1×TBE),观察是否获得目的条带,如条带大小正确,则进行第二次电泳,上样40μL,电泳结束切取目的条带,用博大泰克胶回收试剂盒回收。以上操作均按照试剂盒提供的说明书进行。
1.2.2 PCR产物的TA克隆 胶回收后片段加A尾(25μL体系,胶回收产物20μL,10×PCR buffer 2.5μL,d NTP 1μL,r Taq 0.5μL,dd H2O 1μL,72℃,30 min)。加尾后,用上海华舜PCR产物纯化试剂盒对产物进行纯化。BDVp24和BDVp40目的片段分别连接p MD18-T 载体,加样体系:p MD18-T vector 0.5μL,PCR纯化后产物3.5μL,Ligation Mix 5μL;对照组加样体系为:p MD18-T vector 0.5μL,dd H2O 3.5μL,Ligation Mix 5μL,加样完成后16℃水浴2 h,转化DH5α感受态大肠杆菌,用氨苄抗性的LB固体培养基初步筛选阳性克隆,挑取阳性单克隆接种LB液体培养基中,37℃(220 r/min)振荡培养过夜,第2 d提取菌液中的质粒(T-BDVp24/p40),送上海英骏公司测序。
1.2.3 构建GFAP-BDVp24/p40质粒 用NheI和EcoR I双 酶 切 T-BDVp24/p40 质 粒 和 pCMvie-GFAP载体,T-BDVp24/p40质粒酶切体系为25 μL,(质粒:15μL,10×Buffer4:2.5μL,EcoR I:1 μL,NheI:1μL,BSA:0.25μL,dd H2O:5.25μL)37℃反应2.5 h。pCMvie-GFAP载体的酶切分两部分进行,先加入p CMvie-GFAP:6μL,10×Buffer4:2.5μL,NheI:1μL,BSA:0.25μL,dd H2O:14.25 μL,37℃水浴1 h后再加入EcoR I:1μL,37℃反应1.5 h。酶切产物电泳,用博大泰克胶回收试剂盒分别回收BDVp24片段,BDVp40和载体片段。用Ta KaRa公司的DNA Ligation Kit分别连接BDVp24片段和载体片段,BDVp40和载体片段,连接产物分别转化DH5α感受态大肠杆菌,用卡那抗性的LB平板初步筛选阳性克隆,挑取阳性单克隆接种LB液体培养基,37℃振摇(220 r/min)过夜,分别 提 取 菌 液 中 的 重 组 质 粒 p CMvie-GFAP-BDVp24/p40。
1.2.4 重组质粒的鉴定 所得含有GFAP启动子的基因重组质粒pCMvie-GFAP-BDVp24/p40一部分进行NheI和EcoR I双酶切验证片段大小和PCR鉴定,另取一部分质粒送上海英骏公司测序。
采用脂质体法将pCMvie-GFAP-BDVp24/p40质粒分别转染U251细胞,同时做空质粒转染的对照,使用96孔板,每孔中质粒和脂质体的加入量为:0.2μg质粒+0.5μL转染试剂。转染方法按说明书进行。转染24 h后,通过免疫细胞化学检测细胞中目的蛋白的表达。
2 结 果
2.1 BDVp24/p40基因片段的PCR结果 分别用相应引物对p QE-BDVp24和p QE-BDVp40质粒进行PCR扩增,PCR产物电泳结果如图1,可见p24与p40目的片段大小分别与625 bp、1130 bp相符。
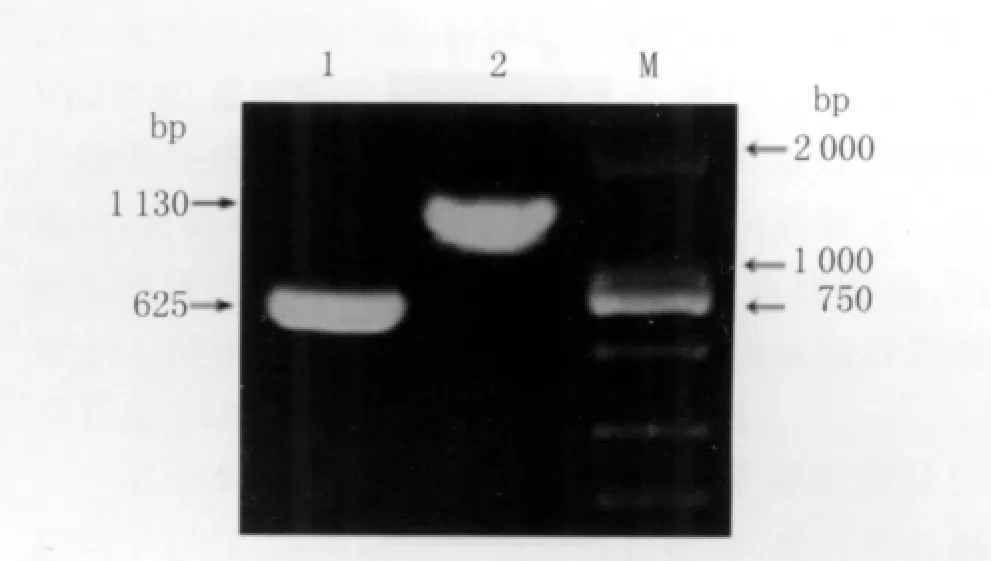
图1 p24和p40目的基因的PCR扩增产物电泳图Fig.1 Electrophoretic profile for PCR product of p24 and p40 genes1:PCR product of plasmid p QE-BDV p24;2:PCR product of plasmid pQE-BDV p40;M:DNA Marker(DL2000)
2.2 TA克隆质粒的鉴定 BDVp24/p40目的片段连接p MD18-T载体后,提取质粒送上海英骏公司测序,测序结果与BDV strain V/FR株进行比对,序列完全一致。
2.3 重 组 质 粒 的 鉴 定 以 p CMvie-GFAP-BDVp24/p40重组质粒为模板,用特异性引物进行PCR可得到片段大小相匹配的目的条带(图2)。重组质粒经NheI和EcoR I双酶切验证,片段大小正确(图3、4,p CMvie-GFAP载体片段约6.5kb)。重组质粒pCMvie-GFAP-BDVp24/p40经上海英俊公司测序,测序峰图见图5、图6,测序结果与BDVstrain V/FR株进行比对一致。将两种重组质粒分别转染U251细胞,24 h后采用免疫细胞化学方法检测P24/P40蛋白的表达,结果显示两种重组质粒转染的细胞均呈阳性,而空质粒转染细胞呈阴性。说明存在相应蛋白的表达(图7)。
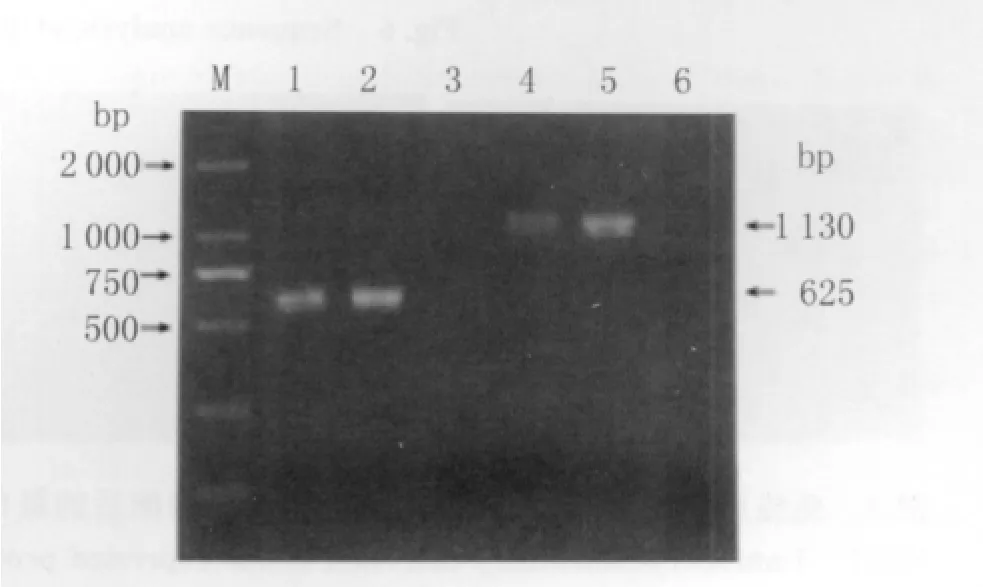
图2 重组质粒PCR鉴定Fig.2 Electrophoretic profile for PCR product of p24 and p40 genes in recombinant1-2:randomly selected recombinant p24 clone;4-5:randomly selected recombinant p40 clone;3 and 6:Negative control

3 讨 论
博尔纳病病毒是一种非分节段单股负链有包膜RNA病毒,具有高度的嗜神经性,曾于19世纪末在德国博尔纳(Borna)镇军用马匹中引起一种致死性脑炎的暴发流行,BDV便因此得名。BDV自然宿主广泛,几乎能感染包括马、羊、驴、人在内的所有温血动物。感染后动物可以出现急性的致死性脑炎或慢性轻微的神经与精神行为异常,也可以长期携带病毒而不表现出任何症状。近年来国内外的大量流行病学调查研究提示BDV感染与精神分裂症、抑郁症、多发性硬化、慢性疲劳综合征等人类神经精神疾病有关[6-8]。因此,对BDV的研究具有十分重要的临床意义。
神经胶质细胞是神经组织中一种无传导神经冲动能力的细胞群,但它们在神经元的生存和整个生命活动中起着支持、营养、保护、修复等重要作用。星形胶质细胞是神经胶质细胞中最主要的一种细胞,其功能广泛,主要表现在:对神经元的隔离和绝缘作用;参与吞噬溃变的细胞碎片,还可通过增生形成胶质瘢痕;调节神经元的代谢,表现在参与递质的代谢和维持内环境K+的稳定;存在许多神经递质的受体,如胆碱能、肾上腺素能、5-羟色胺能和一些神经肽能受体等。Song等的研究说明星形胶质细胞对神经分化的重要作用,既能加快干细胞增殖的速度,又能促进其向神经元方向分化[9],胶质细胞受到损害可影响神经系统的功能。目前对于BDV的致病机制有多种假说,包括BDV感染对脑内的神经递质及受体的影响,对脑内神经营养因子和信号转导的影响,分子模拟作用及对神经可塑性的干扰等方面。过去关于BDV细胞水平致病机制的研究人们重点关注BDV感染对神经元功能的影响,而近年来越来越多的研究发现BDV感染与星形胶质细胞亦存在密切的关系。Kamitani等通过对星形胶质细胞特异性表达BDV磷蛋白转基因小鼠的研究发现,该转基因小鼠出现行为异常,且神经生物学紊乱与BDV病毒感染新生动物产生的症状类似,提示磷蛋白能直接引起星形胶质细胞功能障碍并导致宿主行为改变[10]。Peng G等研究表明BDV磷蛋白能抑制星形胶质细胞一氧化氮和酶基因的表达,从而影响神经元的功能和神经元可塑性[11]。
启动子可以分为广谱型和组织特异性两种,前者在所有组织中都启动基因表达,后者仅在特定的组织中和一定的发育时期启动基因表达。本实验中所采用的GFAP启动子即为一种常用的神经组织特异性启动子。胶原纤维酸性蛋白(glial fibrillary acidic protein,GFAP),是一种由星形胶质细胞特异表达的中间丝细胞骨架蛋白,与星形胶质细胞的结构密切相关,现被广泛用做鉴别星形胶质细胞的一个标志物。而其编码基因gfa的GFAP启动子则被认为在调控星形胶质细胞的特异性转录及表达中起重要作用。1994年,Brenner等将GFAP启动子用于动物实验并证实其驱动效应基因在星形胶质细胞的特异性表达[12]。因此本实验从 p QE-BDVp24和p QE-BDVp40两种原核表达质粒中扩增p24和p40目的片段,最终制备p CMvie-GFAP-BDVp24/40重组质粒,经酶切、PCR、测序鉴定及表达产物的免疫细胞化学检测证实,两种重组质粒制备成功,且具有星形胶质细胞特异性表达的特点。后续可将该质粒转染星形胶质细胞株或原代细胞,用于p24和p40单个病毒蛋白对星形胶质细胞的影响及其在BDV致病机制中的作用等研究。
由于本重组质粒含有GFAP神经组织特异性启动子,与广谱型启动子相比具有靶向、高效和长期稳定的表达的优势。此外,本实验质粒构建过程中外源片段的插入采用了双酶切,避免了反向插入的产生。全过程中多次进行测序以排除质粒反复转化扩增时引起的碱基突变或缺失。重组质粒经过PCR、酶切、测序多种方法的鉴定,序列正确无误,经免疫细胞化学检测重组质粒可以表达蛋白,明确证实质粒构建成功有效,可用于后续实验研究。
[1]Briese T,Schneemann A,Lewis AJ,et al.Genomic organization of Borna disease virus[J].Proc Natl Acad Sci U S A,1994,91(10):4362-4366.
[2]Cubitt B,Oldstone C,de la Torre JC.Sequence and Genome Organization of Borna Disease Virus[J].J Virol,1994,68(3):1382-1396.
[3]de la Torre JC.Molecular biology of borna disease virus:prototype of a new group of animal viruses[J].J Virol,1994,68(12):7669-7675.
[4]Planz O,Rentzsch C,Batra A,et al.Pathogenesis of Borna disease virus:granulocyte fraction of psychiatric patients harbor infectious virus in the absence of antiviral antibodies[J].J Virol,1999,73(8);6251-6256.
[5]Yanai H,Kobayashi T,Hayaabi Y,et al.A Methionine-Rich Domain Mediates CRM1-Dependent Nuclear Export Activity of Borna disease virus Phoaphoprotien[J].J Virol,2006,80(3):1121-1129.
[6]Brenner M,Kisseberth WC,Su Y,et al.GFAP promoter directs strocyte-specific expression in transgenic mice[J].J Neurosci,1994,14:1030-1037.
[7]Salvatore M,Morzunov S,Schwemmle M,et al.Borna disease virus in brains of North American and European people with schizophrenia and bipolar disorder[J].Lancet,1997,349(9068):1813-1814.
[8]Rott R,Herzog S,Fleischer B,et al.Detection of serum antibodies to Borna disease virus in patients with psychiatric disorders[J].Science,1985,228(4700):755-756.
[9]赵立波,谢鹏,牟君,等.重庆地区抑郁症患者博尔纳病病毒感染的分子生物学研究[J].中国神经精神疾病杂志,2007,33(1):18-22.
[10]Song H,Stevens CF,Gage FH.Astroglia induce neurogenesis from adult neural stem cells[J].Nature,2002,417(6884):39-44.
[11]Kamitani W,Ono E,Yoshino S,et al.Glial expression of Borna disease virus phosphoprotein induces behavioral and neurological abnormalities in transgenic mice[J].Proc Natl Acad Sci U S A,2003,100(15):8969-8974.
[12]Peng G,Zhang F,Zhang Q,et al.Borna disease virus P protein inhibits nitric oxide synthase gene expression in astrocytes[J].Virology,2007,366(2):446-452.
