引种花卉紫串扦插苗对高温胁迫的生理响应
2012-08-20徐娜婷刘玉民刘亚敏何丙辉
徐娜婷,刘玉民,刘亚敏,何丙辉
(西南大学资源环境学院 西南大学三峡库区生态环境教育部重点实验室,重庆400715)
温度是影响植物生长的重要生态因子,植物正常的生长发育及生理、生态特性总是和适宜的温度条件联系在一起的,温度不仅影响植物对水分和矿质的吸收,而且影响物质的合成、转化与分配,进而影响植物细胞的分化与伸长[1]。莫亿伟等[2]对柱花草(Stylasanthes guianensis)研究发现,在温度、降水量和日照3个气象因子中,温度因子对其生长和产量的影响最大。高温胁迫会使植物的正常生理代谢受到抑制,产生细胞结构、生理生化过程等一系列变化,这是植物对胁迫信号感受、传导和适应的结果,也是植物抗高温的基础[3]。同时,植物有各种调控防御机制,以应对高温胁迫的有害影响[4]。特别是在非致命性的胁迫条件下,植物可能会调整自身压力条件。研究表明,植物叶绿素含量在很大程度上反映了植株的生长状况和光合能力,类胡萝卜素在细胞内可吸收剩余能量,淬灭活性氧,从而防止膜脂过氧化[5],而高温可导致植物体内光合色素的改变,影响植物的光合作用;丙二醛(MDA)是自由基作用于脂质发生过氧化反应的产物,高温可使植物体内MDA大量积累,破坏活性氧产生与清除之间的平衡,引起膜蛋白与膜内脂的变化,对植物造成高温伤害[6];脯氨酸(Pro)不仅是植物细胞质内渗透调节物质,还在稳定生物大分子结构、降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面起重要作用[7],高温能抑制脯氨酸参与蛋白质的合成作用,造成Pro在植物体内大量积累,使植物体内脯氨酸的含量显著增加[8];植物体具有的SOD、CAT等抗氧化酶保护系统可在一定范围内清除活性氧以维持体内自由基代谢的动态平衡,降低膜脂过氧化,保护膜系统的稳定性,提高植物的耐热性[9]。
紫串(译名)(Scaevola albida ‘Mauve Clusters’)属草海桐科草海桐属植物,原产于澳大利亚,是一种优良的多年生观赏花卉,具有生长快、适应性较强、易养护、花量大、花期长、花形美观、颜色鲜艳等特点,多应用于地被植物、吊兰和花床。国外研究显示[10],低温条件下草海桐属植物叶片会受到损害,大多数种类在0℃左右的温度下能够存活。但对于高温条件下植株的形态和生理变化,尤其是紫串未见报道。2006年由国家林业局“948”项目引种到我国的重庆进行适应性栽植,由于原产地的环境条件与我国的差异较大,尤其是我国南方夏季的持续高温制约紫串的正常生长,但高温对其伤害机制尚不清楚,因此开展紫串在我国的生理适应性研究对于引种及资源评价具有重要意义。本试验根据多年重庆气温的变化情况,通过设置不同的温度梯度,研究了紫串在各种温度条件下的生理生化变化趋势,以揭示其对高温的生理适应机制,并为紫串引种地的选择提供理论依据。
1 材料与方法
1.1 材料来源
试验材料为2006年从澳大利亚引进的紫串植株,在西南大学实验农场进行扩繁栽培。于2010年11月选取健康且生长一致的紫串枝条在西南大学温室内进行扦插,扦插基质为1紫色土∶1珍珠岩∶2腐殖质,成活后对扦插苗进行常规管理,管理技术一致。2011年4月选取生长一致的紫串扦插苗进行温度胁迫试验。
1.2 试验设计
根据重庆市的气象研究资料,46年来重庆市最高气温达到43℃,6-8月的平均昼夜温差8~9℃[11]。因此本研究设定的处理温度为45℃/34℃(昼/夜)、40℃/30℃、35℃/27℃,以25℃/22℃作对照,所有处理每天均为10h光照/14h黑暗。2011年4月开始进行高温处理试验,每个处理均随机选取扦插苗30株,采用RXZ智能PQX多段人工气候箱对其进行持续高温处理。控制人工气候箱的空气湿度(60±10)%,光照强度100μmol/(m2·s),水分补给情况一致。分别于处理1,2和3d后观察植株受害情况,并测定叶片的各项生理指标(从第2片起采叶片,同一测定指标取同一序号的叶片),所有指标均重复测定3次。
1.3 测定方法
受害指数:受害指数(%)=∑(各级株数×级数)/(最高级数×总株树)×100%[7]。受害程度分5级,0级:无受害症状;1级:1~2片叶变黄;2级:全部叶变黄;3级:1~2片叶萎蔫;4级:整株萎蔫枯死。
相关生理指标测定:采用比色法测定叶绿素和类胡萝卜素含量[12];酸性茚三酮比色法测定脯氨酸含量[13];TBA比色法测定MDA含量[14];NBT光还原法测定SOD活性[12],以抑制NBT光化还原的50%为1个酶活性单位(U);紫外吸收法测定CAT活性[12],以1min内OD240减少0.1的酶量为1个酶活性单位(U)。
1.4 数据处理与分析
采用SPSS 17.0进行方差分析和相关分析,运用最小极差法分析显著性,采用Excel 2003绘制图表。
2 结果与分析
2.1 高温胁迫对紫串形态特征的影响
高温胁迫对紫串的形态特征产生了一定的影响(表1),随着胁迫温度的升高,紫串受害指数逐渐增大。35℃高温处理时,紫串植株生长良好,其受害指数随时间变化不显著;40℃高温处理时,随着胁迫时间的延长,受害指数逐渐增大,40℃高温胁迫3d有50%植株叶片变黄,30%植株叶片卷曲、皱缩、变软,解除胁迫10d后,所有植株都能够完成自我恢复;45℃高温处理时,紫串植株受害指数显著高于对照,表现明显的热害症状,处理3d后只有45%的植株可通过自身调节而继续存活,55%植株萎蔫甚至死亡,解除胁迫10d后,多数植株能够完成恢复,仅有少数植株死亡。

表1 高温胁迫对受害指数的影响(平均值±标准误)Table 1 Effects of high temperature on injury indices(mean±SE) %
2.2 高温胁迫对紫串光合色素含量的影响
高温胁迫过程中紫串叶片叶绿素和类胡萝卜素含量呈规律性变化,随胁迫温度升高,叶绿素含量逐渐下降,且随胁迫时间延长下降程度越大,随胁迫温度升高类胡萝卜素含量也呈下降趋势(表2)。与对照相比,在35℃处理区叶绿素和类胡萝卜素含量略有减少;在40℃处理区叶绿素和类胡萝卜素含量均与对照差异显著(P<0.05);在45℃处理区叶绿素含量显著减少,处理1~3d后分别降为对照的59.11%,55.71%,45.8%;高温胁迫下,叶绿素a/b值逐渐下降,Car/Chl值逐渐上升。
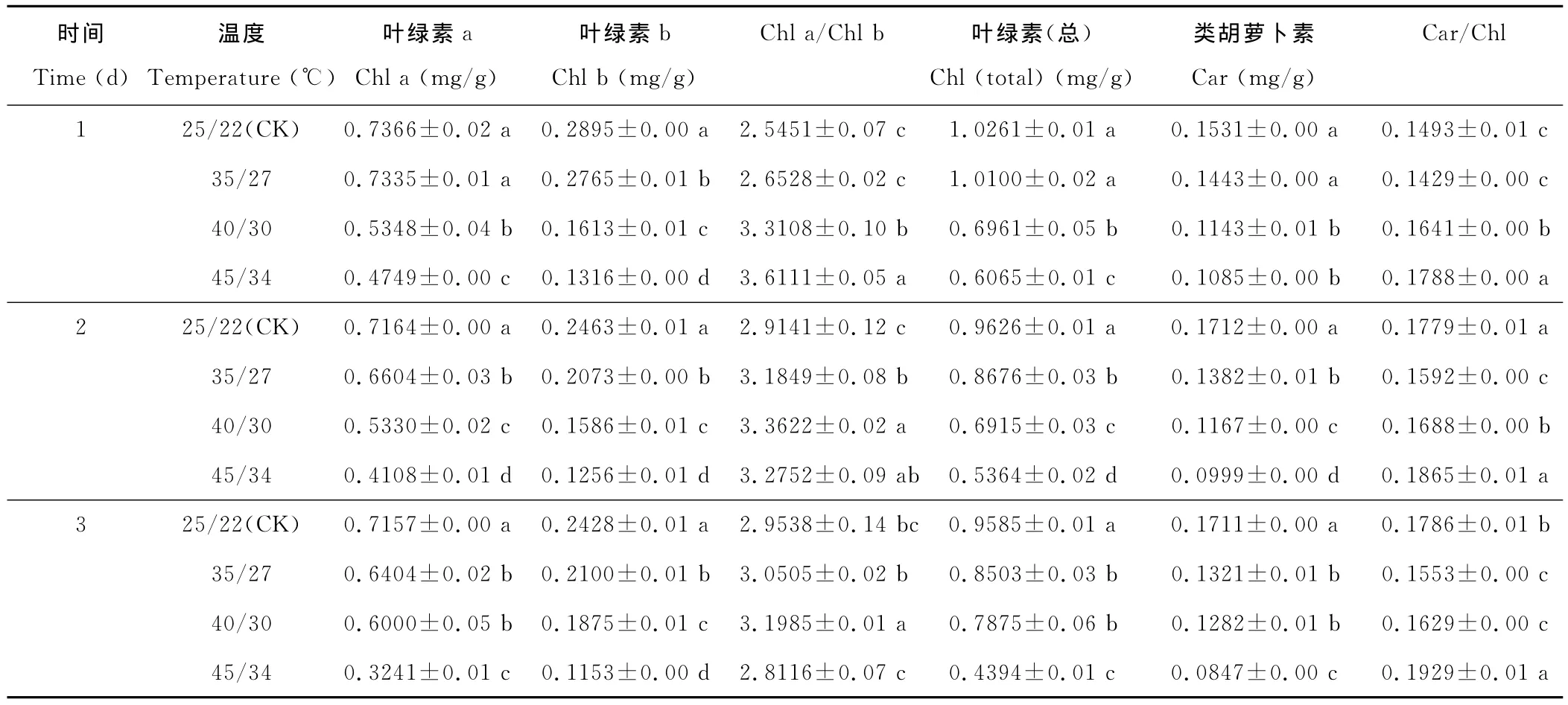
表2 高温胁迫对光合色素含量的影响(平均值±标准误)Table 2 Effects of high temperature on photosynthetic pigment contents(mean±SE)
2.3 高温胁迫对紫串丙二醛含量的影响
随高温胁迫水平的加强,丙二醛含量呈现微增-急剧增加-缓慢减少的趋势(图1)。35℃与40℃处理区变化趋势基本一致,处理1d后与对照差异不显著,处理2~3d后,MDA含量加速累积,均与对照差异显著;在45℃处理区,处理1d后,丙二醛含量显著增加并达到最大值,为对照的2.6倍,处理2~3d后,其含量略有降低但仍高于对照,分别为对照的2.0和1.9倍。这可能是由于MDA与细胞内成分发生反应引起的。
2.4 高温胁迫对紫串脯氨酸含量的影响
在高温胁迫环境下,随着处理温度的升高紫串叶片中脯氨酸含量呈逐渐增加的趋势(图2)。在35℃高温条件下,脯氨酸含量与对照相比略有增加,但变化不显著;在40℃高温条件下,脯氨酸含量与对照相比有显著增加;在35℃和40℃高温条件下,随胁迫时间的延长脯氨酸含量均呈逐渐增加的趋势,由于脯氨酸在体内的积累有防止细胞脱水的作用,在一定程度上提高了紫串对高温的抵抗能力,这有利于其对高温环境的适应;在45℃高温条件下,紫串叶片中脯氨酸含量显著高于其他温度条件的值,但随胁迫时间的延长脯氨酸含量有先升后降的趋势,45℃处理2d后急剧升到最大值,为对照的4.15倍,处理3d后略有下降,可能是因为长时间的高温胁迫已超出了紫串的自我调节能力,植物组织代谢遭到了破坏。
2.5 高温胁迫对紫串SOD活性的影响
高温胁迫条件下,紫串体内SOD活性随胁迫温度升高和胁迫时间的延长均呈上升趋势,但增幅较小(图3)。在35℃和40℃处理区,SOD活性随时间变化的趋势基本一致且差异不显著,但均与对照差异显著,45℃短时间(1d)处理时与35℃和40℃处理时的结果一致,无显著差异,长时间处理时SOD活性显著高于其他处理温度的值,SOD活性随胁迫时间延长持续升高,处理3d后SOD活性达到最大,为对照的1.5倍。
2.6 高温胁迫对紫串CAT活性的影响
CAT活性随处理温度的加强呈先上升后下降的趋势(图4)。在35℃处理区,处理1d后CAT活性变化不明显,处理2~3d后其活性升高,均与对照差异显著;在40℃处理区,处理2d后CAT活性达到最大值,为对照的1.2倍;在45℃处理区,CAT活性急剧下降,处理2~3d后分别降为对照的68.13%,54.96%,可能是由于长持续高温造成了CAT的快速分解。
2.7 相关分析
各生理指标的相关性分析显示(表3),叶绿素与类胡萝卜素呈极显著正相关,叶绿素与Pro、SOD和MDA呈极显著负相关,Pro、SOD与 MDA呈极显著正相关。另外,叶绿素、CAT与受害指数呈极显著负相关,MDA、Pro、SOD与受害指数呈极显著正相关。这些表明,紫串的生理指标间存在极显著的相关关系,高温胁迫过程中各生理指标相互协同。高温胁迫抑制了紫串叶绿素、类胡萝卜素的生成,诱导产生了Pro、MDA、SOD和CAT应对胁迫环境。

图1 高温胁迫对丙二醛含量影响(平均值±标准误)Fig.1 Effects of high temperature on contents of MDA(mean±SE)
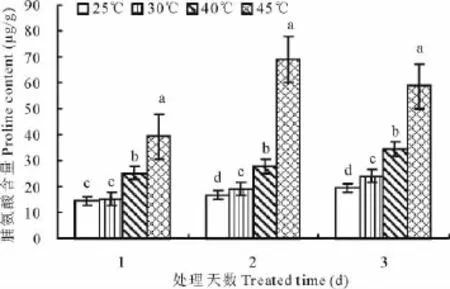
图2 高温胁迫对脯氨酸含量影响(平均值±标准误)Fig.2 Effects of high temperature on contents of Pro(mean±SE)

图3 高温胁迫对SOD活性的影响(平均值±标准误)Fig.3 Effects of high temperature on SOD activities(mean±SE)
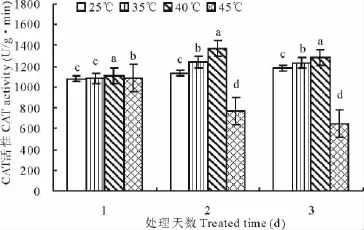
图4 高温胁迫对CAT活性的影响(平均值±标准误)Fig.4 Effects of high temperature on CAT activities(mean±SE)
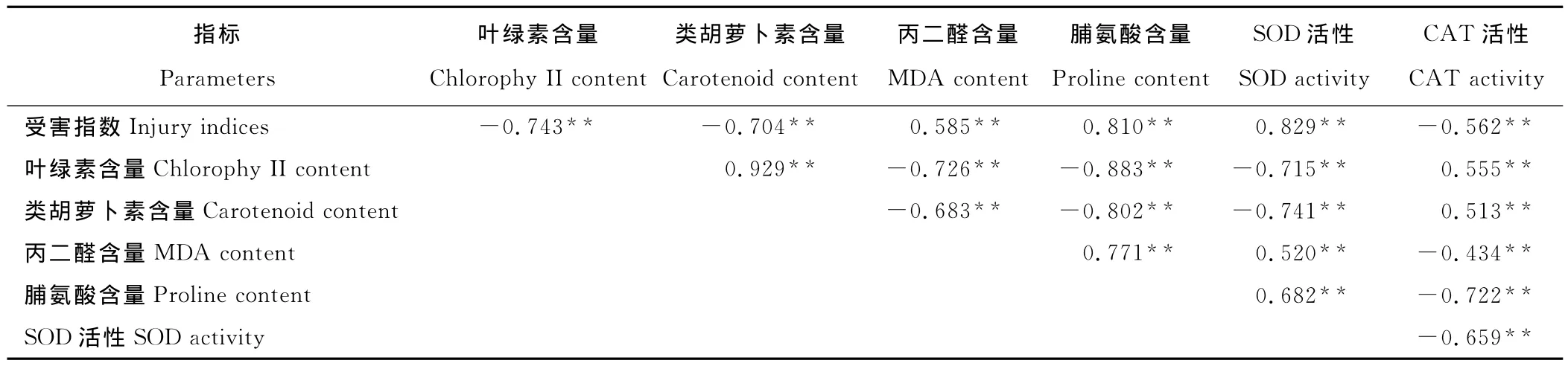
表3 高温胁迫下紫串各生理生化指标相关性分析Table 3 Correlation between physiological and biochemical indices in Mauve Clusters leaves under high temperature stresses
3 讨论
受害指数是反应植株受伤害程度的指标之一,受害指数越高,植株所受伤害越大。本试验中,高温对紫串的伤害均随处理的加强而加重。一定程度的短暂高温对紫串长势没有明显影响,较严重的高温胁迫对紫串造成一定伤害,可以通过自我调节进行恢复,但当高温胁迫水平达到紫串的耐受极限时,便不能自我恢复而死亡。
植物体内光合色素是光合作用的物质基础,光合作用是植物能量代谢和物质转换的关键,高温逆境对其影响很大。本试验高温胁迫下,叶绿素含量明显下降,其可能原因一方面是高温胁迫抑制了叶绿素的合成,另一方面高温胁迫引起活性氧的累积,加速了叶绿素的降解。Car/Chl值的升高说明高温胁迫刺激类胡萝卜素的合成以对机体形成保护。高温导致Chl a/Chl b降低,主要是由于叶绿素a受高温影响大,下降的幅度大,而叶绿素b所受影响相对较小,这种叶绿素a和叶绿素b含量下降的不平衡性,必然导致叶片光合作用的降低,这与张桂莲等[15]的研究结果相同。
MDA是膜脂过氧化作用的最终产物,是细胞膜损害程度的指示物质,其含量可以反映细胞膜脂质过氧化程度和植物对逆境条件反应的强弱[16]。MDA能与蛋白质结合引起膜蛋白的变性,从而直接影响膜的流动性和透性,对植物产生伤害[17]。紫串在高温处理下叶片中MDA均有累积,且随高温胁迫水平的加强累积增多,MDA含量持续上升,表明膜质过氧化程度加强,植物细胞膜受到了严重的高温伤害。Pro含量的增加与膜脂过氧化作用也有很大关系,Pro可作为细胞质的渗透调节物质及能量库调节细胞氧化还原势,对细胞内保水和清除活性氧具有一定影响[18]。本试验在一定温度范围内(45℃以下),游离脯氨酸的积累与胁迫强度呈正相关。温度胁迫条件(35℃处理区)越弱,体内脯氨酸积累就越慢,温度胁迫条件越强(40℃处理区,45℃处理),体内脯氨酸积累越快。但持续强度高温胁迫(45℃胁迫3d后)会超出紫串耐受极限,反而引起体内脯氨酸积累下降。
抗氧化防御机制是植物对高温逆境的适应,其强弱与耐热性的高低有很大的关系[19]。超氧化物歧化酶(SOD)具有特殊的生理活性,它具有较强的清除活性氧、保护细胞膜透性的作用[20];过氧化氢酶(CAT)能消除植物体内由光呼吸形成的过多的H2O2,以维持植物体内的H2O2处在一个低浓度水平;CAT和SOD结合起来可以把有害的超氧阴离子自由基和H2O2转化成无毒的H2O和O2,从而防止活性氧引起的膜质过氧化及其他伤害[21]。本试验中,随高温胁迫的增强紫串植株中SOD活性逐渐升高,这是紫串应对高温胁迫的一种自我响应机制,是为缓解高温胁迫时因超氧自由基增加而造成对植株的伤害;低强度的高温胁迫时(35℃和40℃),CAT活性随胁迫时间延长而升高,是为了清除SOD反应过程中产生的H2O2,也是应对高温胁迫的一种自我调节反应,但高强度的高温胁迫时(45℃),CAT活性随胁迫时间延长而急剧下降,表明紫串的自我调节能力是有限的。在持续高温环境中(45℃处理3d),紫串自身对活性氧自由基和H2O2的清除能力均有所下降,对热胁迫可能缺乏有效的保护机制,导致体内活性氧代谢失调,引起自由基的积累,加剧了细胞膜脂过氧化作用。因此,高温胁迫对紫串的伤害可能与植株体内活性氧代谢失调有关。
高温可导致植物体内活性氧自由基大量产生,破坏叶内自由基的产生与清除的动态平衡关系,活性氧大量增加又可使膜脂过氧化作用加剧,导致膜结构和功能的破坏,从而影响到叶片的生理生化机能,因此,用单一耐热指标难以判断植物对高温的综合适应力。高温环境中紫串通过自身MDA、Pro含量、SOD和CAT活性的动态变化,在一定程度上维持了光和色素的稳定,保护了细胞膜质的完整性,清除了体内过量的超氧自由基和H2O2,减轻了高温对植物的伤害,这是紫串适应高温环境的重要调节机制;MDA、Pro含量、SOD和CAT活性与紫串的受害指数均有显著的相关性,这些都可作为判定紫串耐热性的重要生理指标。
[1] 夏钦,何丙辉,刘玉民,等.高温胁迫对粉带扦插苗形态与生理特征的影响[J].生态学报,2010,30(19):5217-5224.
[2] 莫亿伟,郭振飞,谢江辉.温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J].草业学报,2011,20(1):96-101.
[3] 陈培琴,郁松林,詹妍妮,等.植物在高温胁迫下的生理研究进展[J].中国农学通报,2006,26(5):224-225.
[4] 刘晓军,洪光宇,袁志诚,等.干热胁迫下两种苇状羊茅对不同水肥处理的响应机理[J].草业学报,2011,20(1):46-54.
[5] Willekens H,Van Camp W,Van Montagu M,et al.Ozone,sulfur dioxide,and ultraviolet have similar effects on mRNA accumulation of antioxidant genes in Nicotiana plumbagimfolia L[J].Plant Physiology,1994,(106):1007-1014.
[6] Martireau J R,Specht J E.Temperature tolerance in soybeans[J].Crop Science,1979,19:75-81.
[7] 尹贤贵,罗庆熙.番茄耐热性鉴定方法研究[J].西南农业学报,2001,14(2):62-66.
[8] 许详明,叶和春 脯氨酸代谢与植物抗渗透胁迫的研究进展[J].植物学通报,2000,17(6):536-542.
[9] Dirk I,Marc V M.Oxidative stress in plants[J].Current Opinion in Biotechnology,1996,(6):153-158.
[10] Soo-Hyung Kim,Paul R,Fisher J,et al.Analysis and modeling of gas exchange processes in Scaevola aemula[J].Scientia Horticulturae,2007,(114):170-176.
[11] 张天宇,程炳岩,刘晓冉,等.重庆极端高温的变化特征及其对区域性增暖的响应[J].气象,2008,2:71-78.
[12] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:169-170.
[13] 孔祥生,易现峰.植物生理学实验技术[M].北京:中国农业出版社,2008:252-253.
[14] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:274-276.
[15] 张桂莲,陈立云,张顺堂,等.抽穗开花期高温对水稻剑叶理化特性的影响[J].中国农业科学,2007,40(7):1345-1352.
[16] 陈传军,沈益新,周建国,等.高温季节草地早熟禾草坪质量与叶片抗氧化酶活性的变化[J].草业学报,2006,15(4):81-87.
[17] 陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989,6(4):211-217.
[18] 覃光球,严重玲,韦莉莉.秋茄幼苗叶片单宁、可溶性糖和脯氨酸含量对Cd胁迫的响应[J].生态学报,2006,26(10):3366-3371.
[19] Elena M,Natalya K,Carla P,et al.Molecular genetics of heat tolerance and heat shock proteins in cereals[J].Plant Molecular Biology,2002,48:667-681.
[20] 陶俊,俞菊,俞丽琴,等.短期高温胁迫对一品红幼苗抗氧化系统的影响[J].园艺学报,2008,35(11):1681-1684.
[21] 魏瑞成,裴燕,政晓丽,等.金霉素和其代谢物胁迫对小白菜幼苗生长和抗氧化酶活性及累积效应的影响[J].草业学报,2011,20(5):102-110.
