模拟盐胁迫对白榆种子发芽、出苗及幼苗生长的影响
2012-08-20刘炳响王志刚杨敏生梁海永
刘炳响,王志刚,杨敏生,梁海永
(河北农业大学林学院 河北省林木种质资源与森林保护重点实验室,河北 保定071000)
土壤盐渍化是制约农林业生产发展的重大问题。土壤盐渍化使大面积土壤资源难以利用,严重制约农林业生产发展和生态环境的改善。全世界约有3.8亿hm2土地具有不同程度的盐渍化,约占可耕地面积的10%。我国约有2 600万hm2盐荒地和700万hm2次生盐渍化土壤,占可耕地面积的25%左右[1]。随着我国人口的剧增、工业的迅猛发展和生态环境改善的迫切需要,合理开发和利用大面积的盐渍化土地,筛选耐盐植物资源,提高农林业生产能力,改善盐渍化土地生态环境成为我国农林业生产中的迫切任务。
白榆(Ulmus pumila)是我国华北、东北、西北等地区重要的乡土树种,其生长快、材质好,适应性强,特别是耐盐碱、抗寒、抗旱、耐瘠薄,对烟和有毒气体的抗性也较强。同时,白榆树皮含纤维16.14%,纤维坚韧,可代麻用,制绳索、麻袋或人造棉。树皮及根皮有粘液的胶质物,可作造纸糊料。果实俗称榆钱,种子含油率25.5%,可榨油供食用,制肥皂及其他工业用油。新鲜嫩叶是很好的牲畜饲料,果、叶、树皮还可入药[2]。目前,白榆是我国北方滨海盐碱地造林的主要树种之一,现阶段对白榆抗盐性方面的研究也有不少报导[3-5],但主要集中在白榆幼苗耐盐性比较及白榆对盐胁迫的生理响应方面。
白榆在华北、东北地区滨海盐化土壤中有很多成片或者零星野生资源分布,每年4-5月份大量白榆种子散落,但林下少有白榆种子萌发成苗。因此,深入了解盐化土壤如何制约白榆种子萌发、出苗和幼苗生长,探讨盐胁迫条件下白榆萌芽和幼苗生长状况与土壤盐分的关系,从而进一步揭示白榆种子萌发、出苗和幼苗生长阶段适应盐渍环境的机理具有重要意义。对盐胁迫白榆萌芽、出苗,生长的影响等方面进行了研究,试图理解白榆对盐渍环境的适应机制及抗盐苗木的选育提供理论依据。
1 材料与方法
1.1 实验材料
供试白榆种子2011年5月初采于河北省盐山县耐盐碱林木良种繁育基地。选取籽粒饱满、质地均匀的种子,试验于2011年5月10至6月20日进行。
1.2 种子萌芽实验
试验采用中性盐NaCl,设置4个浓度梯度,分别为0(蒸馏水对照)、100、200和300mmol/L。在12cm的培养皿内铺设2层定性滤纸,每皿浇相应浓度的NaCl溶液10mL后播种30粒,置于25℃恒温培养箱中进行发芽试验[6,7],每个处理5次重复。种子萌发过程中每24h观察记录1次种子的发芽情况(以芽长达到种子长一半为种子发芽标准)。在统计发芽粒数期间测定培养皿重量,如水分损失过多可添加适量蒸馏水。在发芽末期连续5 d发芽粒数平均不足供试种子总数的1%时计算发芽率,并计算发芽指数和平均发芽时间。各发芽指标计算公式如下[8,9]:

其中Gi为第i天发芽种子数,Di为天数。
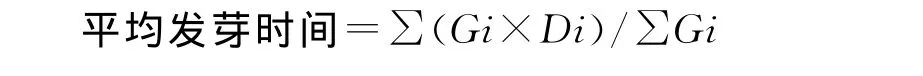
1.3 田间出苗实验
于河北农业大学苗圃进行田间试验,土壤含盐量为0.06%,有机质含量2.04%,全氮1.63g/kg。选用底部有孔的盆(口径30cm,高30cm),每盆装土干重10kg,根据实验需要,按照质量分数配置成NaCl浓度为0%,0.1%,0.2%,0.3%,0.4%,0.5%六个盐分处理。每盆选取100粒饱满的白榆种子均匀播于盆中,播种后覆土0.5cm左右,每个盐分处理5盆重复。实验过程中,定期浇少量水,以平衡蒸发量。为防止盐分流失,花盆下垫塑料托盘,渗出的溶液再返倒回盆中。播种后每天观察记录出苗和死苗情况,以两片子叶出土定义为出苗,并记录出苗时间,第10天计算出苗率(出苗数/播种种子数)。出苗后正常生长,在15d仍存活的苗定义为成苗,计算成苗率(成苗数/播种种子数)。
1.4 盐胁迫对幼苗生长影响测定
第30天统计各处理白榆幼苗存活情况(存活数/播种种子数),测定成活幼苗平均高度、根系条数和平均长度及快速叶绿素荧光参数。快速叶绿素荧光动力学曲线测定与计算方法:每个处理选取测定5株,参考Strasserf等[10]的方法,测定前先将叶片暗适应15min,然后利用Pocket PEA植物效率分析仪(Hansatech,UK)测定叶片快速叶绿素荧光诱导动力学曲线(O-J-I-P曲线)。
JIP-test分析:根据李鹏民等[11]的方法,对获得的OJIP荧光诱导曲线进行分析:最大光化学效率(在t=0时)φPo;捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率(在t=0时)Ψo;用于电子传递的量子产额(在t=0时)φEo;用于热耗散的量子比率φDo;单位面积吸收的光能(在t=0时)ABS/CSO;单位面积吸收的光能(在t=tFM时)ABS/CSM;单位面积捕获的光能(在t=tFM时)TRO/CSM;单位面积的电子传递的量子产额(在t=tFM时)ETO/CSM;单位面积的热耗散(在t=tFM时)DIO/CSM;单位面积的反应中心的数量(在t=0时)RC/CSO;单位面积的反应中心的数量(在t=tFM时)RC/CSM;以吸收光能为基础的性能指数PIABS;以单位面积为基础的性能指数PICSM;以单位材料面积为基础的推动力DFCSM。
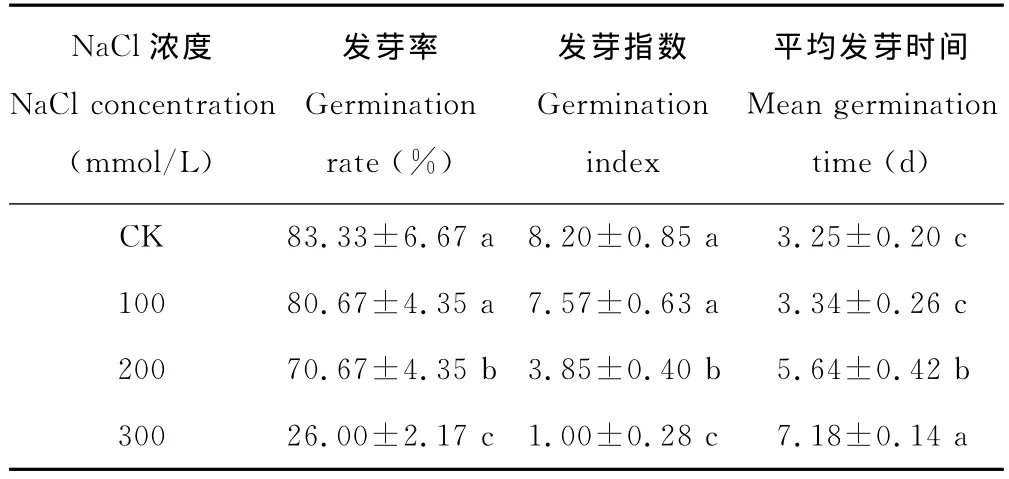
表1 盐胁迫对白榆种子发芽率、发芽指数和平均发芽时间的影响Table 1 Effects of salt stress on germination rate,germination index and mean germination time of U.pumila
1.5 统计分析
试验数据采用 Microsoft Excel 2003进行计算,用SPSS 17.0统计软件进行方差分析
2 结果与分析
2.1 盐胁迫对白榆种子萌发的影响
100mmol/L盐浓度白榆种子发芽率与对照相比差异不显著(表1),说明白榆种子具有一定的耐盐性。盐分浓度达到200mmol/L,白榆种子发芽率降低达到显著水平,随着溶液盐浓度的增加,种子发芽率急剧下降,当盐分浓度300mmol/L,发芽率下降为对照水平的31.20%。与发芽率相比,白榆种子发芽指数对盐胁迫的反应更加敏感,100mmol/L盐浓度发芽指数与对照相比差异不显著,200和300mmol/L盐浓度下,发芽指数显著下降,分别比对照下降53.05%和87.80%。盐胁迫使种子的发芽率和发芽指数下降,同样也会影响种子的发芽时间,使种子萌发延迟,当盐浓度到达200 mmol/L差异显著,300mmol/L盐浓度使种子平均发芽时间延长了3.93d。
2.2 盐胁迫对白榆幼苗出苗和成活的影响
随着土壤中盐浓度的增加,白榆出苗率和幼苗成活率整体呈现下降的趋势(图1)。0.1%盐浓度没有显著降低白榆的出苗率,当土壤盐分含量0.2%以上(包含0.2%),白榆出苗率急剧下降,均显著低于对照水平,出苗率分别为对照的69.44%,30.56%,15.65%和9.54%。盐渍化土壤中,白榆出苗并不意味着成活,受土壤盐分和水分胁迫可能造成白榆幼苗出苗后陆续死亡。白榆幼苗成活率与出苗率趋势相同,但出苗率对盐分胁迫程度敏感,0.1%盐浓度成苗率显著低于对照水平,随着土壤盐浓度的增加,出苗后死亡比例逐渐增大。
2.3 盐胁迫对白榆存活和生长的影响
由于有些成活的白榆幼苗不能适应土壤盐渍环境,加上土壤表层盐分受太阳光照影响较大,造成一部分幼苗不能存活。播种30d后,白榆存活率随着土壤盐分浓度的增加而降低,各盐分处理显著低于对照水平(表2)。白榆幼苗苗高和根长对土壤盐胁迫的反应十分敏感,随土壤盐浓度增加,平均苗高和平均根长均显著下降,盐胁迫抑制了白榆幼苗的苗高和根系生长。根系生长对盐胁迫的响应更加敏感,各盐分处理根长比苗高下降的比例高6.28%,17.14%,28.21%,18.62%和12.65%。土壤0.1%盐浓度白榆幼苗根系条数略有增加,但达到显著水平。当土壤盐分浓度到达0.30%,根系条数下降显著低于对照,并随土壤盐浓度的进一步增加,根系条数迅速下降。
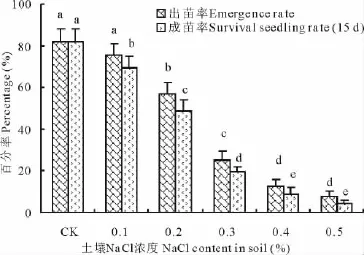
图1 盐胁迫对白榆出苗率(10d)和成活率(15d)的影响Fig.1 Effects of salt stress on the emergence rate(10d)and survival seedling rate(15d)of U.pumila
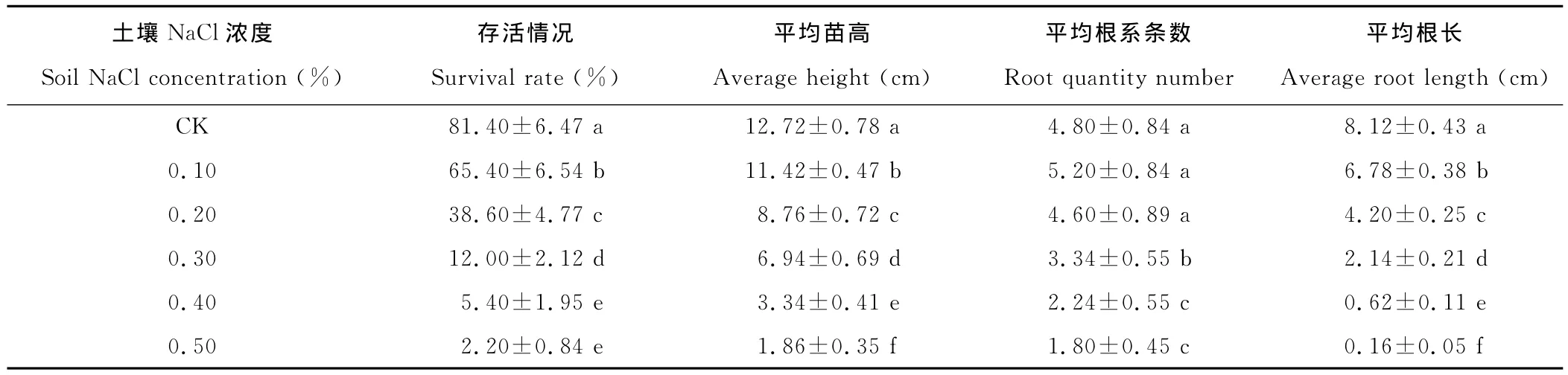
表2 盐胁迫对白榆幼苗存活率、苗高和根系生长的影响Table 2 Effects of salt stress on the survival rate,height and root growth of U.pumila
2.4 盐胁迫对快速叶绿素荧光诱导动力学曲线的影响
图2为白榆不同盐浓度处理下,O-J-I-P曲线的变化情况。不同浓度盐处理快速叶绿素荧光诱导动力学曲线(O-J-I-P曲线)变化显著。随着盐胁迫浓度的增加,J点和I点的荧光强度逐渐增强,均明显高于对照。J相和I相显著升高,盐胁迫叶片J相的变化是由于QB-非还原性PSⅡ反应中心在PSⅡ反应中心中所占的比例增加造成的。盐胁迫叶片I相的升高可能是还原型PQ库失活所致。白榆在盐处理下O-J-I-P曲线变形为O-J-K-I-P曲线,即在曲线中出现明显的拐点K,K点出现在5ms左右。
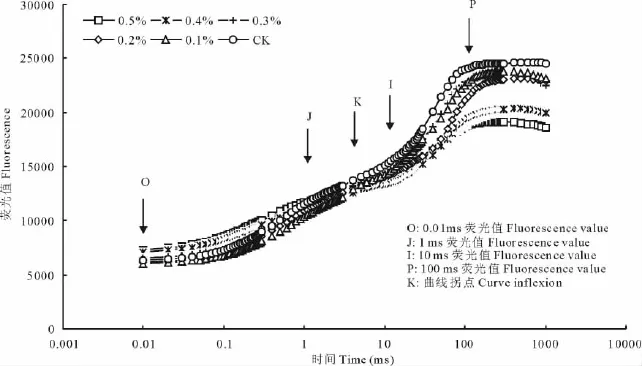
图2 白榆不同盐处理下的 O-J-I-P曲线Fig.2 The curve of O-J-I-P of U.pumilaunder salt stress
2.5 盐胁迫对量子产额或能量分配比率的影响
白榆在不同盐度处理下吸收、转化、用于电子传递和以热辐射方式耗散的能量发生明显变化(表3)。φPo反映了暗适应后的最大光化学效率,其测定与调制式荧光仪的参数Fv/Fm的测定相一致,随着盐处理浓度增加,白榆叶片φPo先升高后降低,当盐胁迫浓度达到0.3%,φPo下降达显著水平,说明光合机构发生了光抑制,发生光抑制是PSⅡ受到伤害的体现,也是植物进行光保护的过程;Ψo反映了在反应中心捕获的激子中,用来推动电子传递到电子传递链中QA下游的其他电子受体的激子占用来推动QA还原激子的比率,当盐浓度达到0.5%时,与对照相比Ψo降低达到显著水平,而0.20%~0.40%与对照相比,Ψo虽有降低,但差异不显著;φEo用于电子传递的量子产额,反映了反应中心捕获的光能将电子传递到电子传递链中超过QA的其他电子受体的概率,随着盐处理浓度增加,叶片φEo先升高后降低,当盐处理浓度达到0.4%,φEo降低与对照相比差异显著,φEo比对照降低了10.9%;φDo用于热耗散的量子比率,盐处理增加了白榆叶片φDo,当盐胁迫浓度达到0.3%,φDo增加达显著水平。盐胁迫下,叶片光合系统吸收的光能应用于光化学反应的能量降低,而天线耗散能量增强,叶片具有较高的过剩能量耗散能力,有效地通过叶黄素循环耗散掉过剩的激发能,是其自我保护的一种机制。
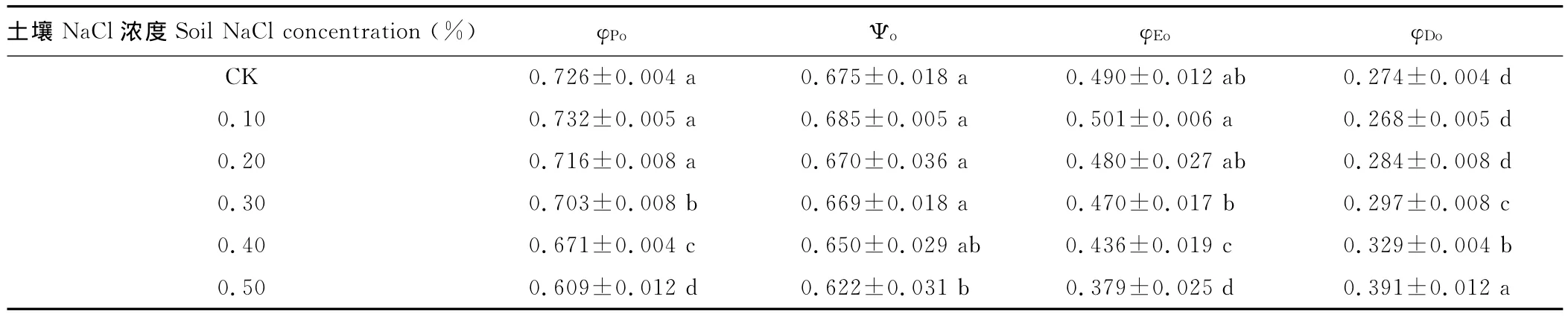
表3 NaCl胁迫下白榆叶绿素荧光诱导动力学参数变化Table 3 Changes of chlorophyll a fluorescence parameters under NaCl stress of U.pumila (mean±SE)
2.6 盐胁迫对比活性参数的影响
ABS/CSO其大小近于初始荧光Fo是PSⅡ反应中心全部开放时的荧光,其大小主要与PSⅡ天线色素内最初激子密度、天线色素到PSⅡ反应中心的激发能传递速率的结构状态和叶绿素含量有关,而与光合作用的光化学反应无关[12,13]。盐分含量低于0.2%,ABS/CSO呈现先下降后上升的趋势,但未达到显著差异水平。当NaCl含量达到0.3%时,ABS/CSO比对照显著增加,可能是植物叶片PSⅡ反应中心出现了可逆的失活或出现了不易逆转的破坏,也可能由于植物叶片类囊体膜受到损伤造成的,ABS/CSO增加量越多,类囊体膜受损坏程度就越严重,光合作用潜力下降,活性则降低。随着土壤盐含量的增加,单位面积吸收的光能(t=tFM时,ABS/CSM≈Fm)和单位面积反应中心数量(RC/CSO和RC/CSM)呈现下降趋势。ABS/CSM的下降主要是盐胁迫使反应中心降解或失活,或是导致天线色素结构的改变并迫使天线色素降解,从而引起叶片捕获的光能下降,进而导致单位面积上用来还原QA的激发能(TRO/CSM)及进入超过QA的电子传递链中的还原能(ETO/CSM)减少。单位面积光合机构有活性反应中心的数目(RC/CSO和RC/CSM)的下降则是由于盐胁迫导致白榆叶片PSⅡ反应中心降解和失活造成的。TRO/CSM和ETO/CSM反应单位面积光能捕获和电子传递的量子产额,随土壤盐浓度增加,均呈先升后降的趋势。当土壤盐浓度达到0.2%(TRO/CSM)和0.3%(ETO/CSM)时差异显著,说明低盐处理,并未影响叶片单位面积光能捕获和电子传递的量子产额,当土壤盐含量达到浓度,TRO/CSM和ETO/CSM均显著降低,严重制约了单位面积叶片的光能捕获和电子传递过程。
随着土壤盐含量的增加,DIO/CSM先降后增,当土壤盐处理达到0.4%(表4),DIO/CSM达到显著水平,为保护光合机构不被过剩激发能伤害,白榆启动光保护机制,热耗散掉过多的光能,这也就从另一个角度说明0.4%盐浓度处理导致反应中心失活,使剩余的反应中心所承受的激发压增大,叶片遭受盐胁迫后启动了相应的防御机制,使得叶片中过剩激发能得到及时耗散。
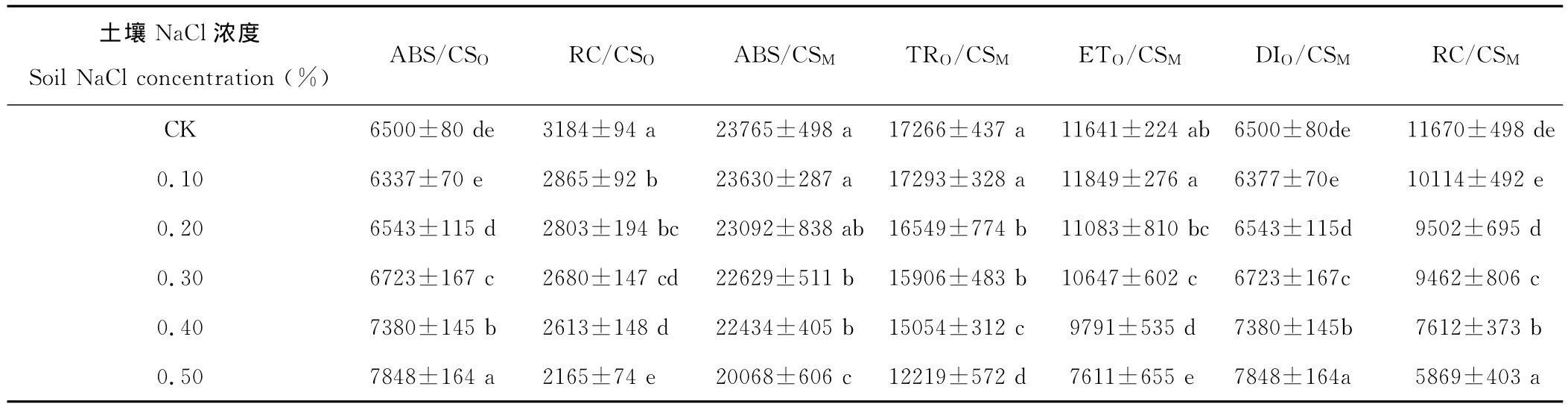
表4 NaCl胁迫下白榆比活性参数变化Table 4 The specific activity under NaCl stress parameter changes of U.pumila (mean±SE)
2.7 性能及推动力的影响
PIABS指以吸收光能为基础的性能指数,PICSM指以单位面积为基础的性能指数,DFCSM以单位材料面积为基础的推动力。随土壤盐胁迫浓度的增加,PIABS、PICSM和DFCSM均较大幅度降低。PIABS分别下降了8.8%,13.1%,28.1%,52.8%和67.0%(图3),盐分严重影响了植物对光能的吸收。单位材料面积的性能指数PICSM分别比对照下降24.7%,26.8%,36.6%,46.1%和74.4%,以吸收光能为基础的性能指数PIABS、单位材料面积为基础的推动力DFCSM和单位面积为基础的性能指数在土壤盐浓度0.1%时差异显著,可见PIABS、PICSM和DFCSM三个参数对盐胁迫十分敏感,能很好地反映胁迫对光合机构的影响。
3 讨论与结论
3.1 盐胁迫对白榆萌芽、出苗和存活的影响
随着盐胁迫浓度的增加,白榆种子发芽率和发芽指数呈下降趋势,平均发芽时间逐渐延长,这与纪荣花等[14]研究结果相一致,说明这3个指标均反映了白榆种子对盐胁迫的响应。100mmol/L盐浓度对白榆发芽率、发芽指数和平均发芽时间的影响均差异不显著,说明白榆种子能够忍受100mmol/L盐浓度,具有一定的耐盐性,只有盐处理达到一定浓度,才会对白榆种子萌芽造成影响。发芽指数对盐浓度变化最为敏感,可作为白榆种子耐盐性筛选的重要指标。
植物生长周期中不同阶段对逆境的耐受能力不同,一般认为,种子阶段的耐受能力强,幼苗阶段耐受能力较弱[15,16],所以萌发了的种子不一定出苗,即使出苗也不意味着能够存活下来。随着土壤盐浓度增加,白榆幼苗出苗率、成苗率和存活率均呈下降趋势,且各盐分处理(对照除外),出苗后一些幼苗陆续死亡。这种趋势也就揭示了滨海盐碱地有很多成片或者零星野生资源分布,每年大量白榆种子散落,但林下极少有白榆幼苗的原因。
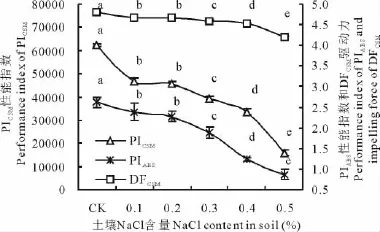
图3 不同NaCl胁迫下性能及推动力的变化Fig.3 The changes of performance and driving force under different NaCl stress
3.2 盐胁迫对白榆幼苗生长的影响
盐胁迫抑制了白榆幼苗生长,平均苗高和平均根长均显著下降,这与陈炳东等[17]、李存桢等[18]与景艳霞和袁庆华[19]研究结果相一致,根系条数则呈先增加后降低的趋势。根系伸长对盐胁迫的响应更加敏感,更能反映盐胁迫对白榆幼苗生长的影响。植物根系直接和土壤接触,收到盐分、水分和养分吸收的影响,受影响最为直接。
3.3 盐胁迫对白榆叶绿素荧光动力学的影响
PSⅡ对逆境胁迫非常敏感,因此,植物叶片的PSⅡ的光化学反应特性是衡量逆境胁迫对光合器官伤害的有效指标[20,21]。NaCl处理可以增加PSⅡ对光的敏感性,加速光抑制的产生,通过降低反应中心的光能捕获效率,避免吸收过多光能,从而减少对光合机构造成的损伤;随着土壤盐浓度增加,反应中心数目也受到影响,植物进一步减少光能的吸收,这种反应中心失活可能也是植物自身的一种保护机制[22],避免光合机构受到损伤。电子传递链QA后的电子传递也受到影响,这表明QA后的暗反应也可能受到了影响。
很多研究表明,胁迫会使最小荧光值(FO)升高,ABS/CSO大小近于初始荧光(FO),随着盐胁迫的增强,最小荧光值增加,Fo上升,说明PSⅡ内色素吸收的能量流向光化学的部分减少,以热和荧光形式散失的能量增加,这样避免或减轻光合机构的破坏。造成白榆ABS/CSO升高的原因,可以归结为2个方面。第一,盐胁迫使PSⅡ反应中心与色素天线细胞分离,阻断了能量向PSⅡ中的传递过程。反应中心与天线细胞的这种分离是一种激发能的猝灭器,它可以耗散掉过多的光能,从而保护邻近的反应中心不受破坏。第二,盐处理打破了QA和QB的氧化还原平衡,使得电子可以更加容易从质体醌库中流回,导致了Fo处的荧光有所上升[13,23]。
快速叶绿素荧光诱导动力学曲线(O-J-I-P荧光曲线)包含大量有关光合原初光化学反应的信息,能更好地反映胁迫对光合机构的影响[24,25]。现已证明,O-J-I-P荧光曲线中K点的出现与PSⅡ的供体,特别是放氧复合体受伤害有关[26,27],当PSⅡ的供体侧受到伤害时,经过很短的时间(在J点之前),叶绿素荧光产量就会急剧上升,出现 K 点,多相荧光(O-J-I-P)变为(O-J-K-I-P)[28-30]。盐胁迫导致 K 点(5ms)的出现,K 点的出现是由于水裂解系统被抑制以及QA之前受体侧的部分被抑制所造成的。在此抑制过程中,受伤害的是放氧复合体(OEC),所以K点也可以作为OEC受伤害的一个特殊标记点[10,31,32],Ψo则可以反映PSⅡ受体侧的相对电子传递速率[11]。
盐胁迫下,φPo和Ψo降低,导致QA传递电子的能力下降,引起φEo下降,但φDo显著提高,白榆叶片的自我保护机制启动;φEo明显下降也表明了盐胁迫抑制QA-的电子传递。盐胁迫对PSⅡ电子传递受体侧的影响可能是胁迫导致QB位点的改变而降低其与质体醌结合的亲和力。
RC/CSM、ABS/CSM、TRO/CSM和ETO/CSM都下降,而 DIO/CSM增加,表明 NaCl胁迫可能一方面使反应中心降解或失活,另一方面通过改变天线色素的结构或者使天线降解,而使得捕获的光能下降,进而导致单位面积上用来还原QA的激发能和进入超过QA-的电子传递链中的还原能减少,与此同时,胁迫导致单位叶面积热耗散增加,说明白榆叶片遭受胁迫后启动了相应的防御机制,使叶片中的过剩激发能得以及时耗散。热耗散是植物抗光抑制破坏的主要机制,热耗散通常反映植物非辐射能力耗散大小[21,33]。结果表明盐胁迫增加,使叶片接受的光能转变为热能消耗掉,从而保护光合机构免受过量光能的危害。
随土壤盐浓度增加,PIABS、PICSM和DFCSM均较大幅度降低,表明性能指数(PIABS、PICSM)和推动力(DFCSM)对盐胁迫比较敏感,能较好地反映胁迫对光合机构的影响。盐胁迫下,白榆叶片发生光抑制,PSⅡ的受体侧受到伤害,PSⅡ反应中心降解或失活,迫使叶片启动了的防御机制。
[1] 张永锋,梁正伟,隋丽,等.盐碱胁迫对苗期紫花苜蓿生理特性的影响[J].草业学报,2009,18(4):230-235.
[2] 刘苹.白榆半同胞家系、无性系遗传变异与早期选择研究[D].泰安:山东农业大学,2003.
[3] 夏尚光.美国岩榆的引种育苗技术与耐盐耐旱特性研究[D].江苏:南京林业大学,2005.
[4] 刘炳响.白榆耐盐差异性研究[D].河北:河北农业大学,2005.
[5] 李庆贱.白榆家系苗期耐盐碱对比试验与优良家系选择[D].北京:北京林业大学,2010.
[6] 师东,张爱勤.盐碱胁迫对两种补血草种子萌发的影响[J].草业科学,2011,28(8):1445-1450.
[7] 彭清青,李春杰,宋梅玲,等.不同酸碱条件下内生真菌对三种禾草种子萌发的影响[J].草业学报,2011,20(5):72-78.
[8] 芦翔,汪强,赵惠萍,等.盐胁迫对不同燕麦品种种子萌发和出苗影响的研究[J].草业学报,2009,26(7):77-81.
[9] 刘慧霞,申晓蓉,郭正刚.硅对紫花苜蓿种子萌发及幼苗生长发育的影响[J].草业学报,2011,20(1):155-160.
[10] Strasserf R J,Srivastava A,Govindjee.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry And Photobiology,1995,61(1):32-42.
[11] 李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
[12] Pandey D M,Kang K H,Yeo U D.Effects of excessive photon on the photosynthetic pigments and violaxanthin de-epoxidase activity in the xanthophyll cycle of spinach leaf[J].Plant Science,2005,168(1):161-166.
[13] 白志英,李存东,赵金锋,等.干旱胁迫对小麦代换系叶绿素荧光参数的影响及染色体效应初步分析[J].中国农业科学,2011,44(1):47-57.
[14] 纪荣花,于磊,鲁为华,等.盐碱胁迫对芨芨草种子萌发的影响[J].草业科学,2011,28(2):245-250.
[15] 刘金萍,高奔,李欣,等.盐旱互作对不同生境盐地碱蓬种子萌发和幼苗生长的影响[J].生态学报,2010,30(20):5485-5490.
[16] 党伟光,高贤明,王瑾芳,等.紫茎泽兰入侵地区土壤种子库特征[J].生物多样性,2008,16(2):126-132.
[17] 陈炳东,黄高宝,陈玉梁,等.盐胁迫对油葵根系活力和幼苗生长的影响[J].中国油料作物学报,2008,30(3):327-330.
[18] 李存桢,刘小京,杨艳敏,等.盐胁迫对盐地碱蓬种子萌发及幼苗生长的影响[J].中国农学通报,2005,21(5):209-212.
[19] 景艳霞,袁庆华.NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响[J].草业学报,2011,20(2):134-139.
[20] 桂仁意,刘亚迪,郭小勤,等.不同剂量Cs-γ射对毛竹幼苗叶片叶绿素荧光参数的影响[J].植物学报,2010,45(1):66-72.
[21] 贾永霞,孙锦,王丽萍,等.低氧胁迫下黄瓜植株热耗散途径[J].应用生态学报,2011,22(3):707-712.
[22] 艾军勇,张道勇,牟书勇,等.EDTA对波士顿蕨吸收Hg的影响及其光合响应[J].应用与环境生物学报,2011,17(2):219-222.
[23] Yamane Y,Shikanai T,Kashino Y,et al.Reduction of QAin the dark:Another cause of fluorescence Fo increases by high temperature in higher plants[J].Photosynthesis Research,2000,63(1):23-34.
[24] Appenroth K J,Stckel J,Srivastava A,et al.Multiple effect of chromate on the photosynthetic apparatus of Spirodela polyrhiza asprobed by OJIP chlorophyll a fluorescence measurements[J].Environmental Pollution,2001,115(1):49-64.
[25] Van Heerden P D R,Tsimilli-Michael M,Kruger G H J,et al.Dark chilling effects on soybean genotypes during vegetative development:Parallel studies of CO2assimilation,chlorophyll a fluorescence kinetics O-J-I-P and nitrogen fixation[J].Physiologia Plantarum,2003,117(4):476-491.
[26] Chen H X,Li W J,An S Z,et al.Characterization of PSⅡphotochemistry and thermostability in salt-treated Rumex leaves[J].Journal of Plant Physiology,2004,161(3):257-264.
[27] 宋旭丽,胡春梅,孟静静,等.NaCl胁迫加重强光胁迫下超大甜椒叶片的光系统II和光系统I的光抑制[J].植物生态学报,2011,35(6):681-686.
[28] 张谧,王慧娟,于长青.超旱生植物沙冬青高温胁迫下的快速叶绿素荧光动力学特征[J].生态环境学报,2009,18(6):2272-2277.
[29] Strivastava A,Strasser R J.Stress and stress management of land plants during a regular day[J].Journal Plant Physiology,1996,148(3-4):445-455.
[30] van Heerden P D R,Strasser R J,Kruger G H J.Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics[J].Physiologia Plantarum,2004,121(2):239-249.
[31] 吴长艾,孟庆伟,邹琦,等.小麦不同品种叶片对光氧化胁迫响应的比较研究[J].作物学报,2003,29(3):339-344.
[32] 孙山,张立涛,高辉远,等.晴天条件下光、温变化对苹果绿色果皮原初光化学反应的影响[J].应用生态学报,2009,20(10):2431-2436.
[33] Morosinotto T,Caffarri S,Da’Osto L,et al.Mechanistic aspects of the xanthophyll dynamics in higher plant thylakoids[J].Physiologia Plantarum,2003,119(3):347-354.
