海盐胁迫下苏牧2号象草幼苗不同器官中阳离子分配与运输
2012-08-20刘智微钟小仙常盼盼刘伟国
刘智微,钟小仙*,常盼盼,2,刘伟国,3
(1.江苏省农业科学院畜牧研究所,江苏 南京210014;2.南京农业大学动物科技学院,江苏 南京210095;3.扬州大学动物科技学院,江苏 扬州225009)
自20世纪30年代以来,美国、前苏联、日本、以色列及澳大利亚的学者就十分注意土壤的盐碱化及植物的耐盐性研究[1]。我国对盐生牧草的研究自20世纪50年代开始,从国内外收集和引进了大量耐盐牧草种质资源,如星星草(Puccinellia tenuiflora)[2]、碱蓬(Suaeda salsa)[3,4]、羊草(Leymus chinensis)[3,5]、海滨锦葵(Kosteletzkya virginica)[6]、獐毛(Aeluropus littoralis var.sinensis)[7]、三角滨藜(Atriplex triangularis)[8]等。目前,国内研究最普遍的是NaCl胁迫对植物的影响。已有研究表明,盐胁迫下,植物主要依靠吸收和积累无机盐离子进行渗透调节,增加细胞浓度,降低细胞渗透势,防止细胞脱水;但高盐环境下,植物原生质膜被破坏,导致Na+大量涌入胞内,破坏细胞中Na+、Cl-平衡状态,影响K+和Ca2+的胞内分布,对植物造成单盐毒害作用以及盐离子导致的渗透胁迫和养分亏缺,抑制植物生长[9,10]。但大部分牧草虽然耐盐性强,对盐碱地改良效果良好,品质和适口性却很差,难以直接用于畜牧业生产,主要以滩涂生态改良为主。
象草(Pennisetum purpureum)为禾本科狼尾草属多年生草本植物,是一种适宜于热带和亚热带地区种植的多用途牧草[11,12]。国内外研究表明,它可作为草食畜禽和鱼类的优质青饲料、水土保持植物、优质纸浆和人造板原料,还是重要的生物质能源作物[13,14]。苏牧2号象草为2010年国家审定的耐盐象草新品种,刘智微等[15]以N51象草为原始对照,已初步明确了苏牧2号象草叶片内抗氧化酶活性和MDA含量与其耐盐性强弱的关系。苏牧2号象草具有喜温、耐湿、耐干旱和抗倒伏,全生育期无明显病虫危害,耐盐性强,盐含量≤0.6%生长良好的特点,在浙中部含盐量为0.30%~0.45%海涂地种植,干物质产量可达12 000~20 000kg/hm2。根据农业部组织的第二次全国土壤普查资料统计,在已开垦种植的1亿亩左右的盐渍土中,大多数含盐量在1.0%以下,特别是长江口以南东南部滨海盐土与海涂,1m土体的平均含盐量小于0.6%,因此,苏牧2号象草特别适合在我国南方滨海滩涂开发利用中使用。目前,对象草的研究主要大量集中于其产量、青饲料和青贮品质以及工业应用方面,对于海盐胁迫下象草不同器官中阳离子含量及其毒害机理的研究较少。本研究通过盆栽试验,研究不同浓度海盐胁迫下苏牧2号象草幼苗不同器官中Na+、K+、Ca2+和Mg2+含量随海盐胁迫时间延长的变化情况,并与象草N51进行对照分析,旨在从离子角度分析海盐对象草的毒害作用以及苏牧2号耐盐的部分生理原因,以期为盐渍土的高效生态利用和象草产业化开发提供技术支撑以及象草的耐盐生理机制研究提供理论依据。
1 材料与方法
1.1 供试材料
苏牧2号象草(P.purpureumcv.Sumu No.2)由江苏省农业科学院畜牧研究所提供,N51象草由美国引进。试验海盐为广东省多品种盐公司出品的海水养殖专用盐。
1.2 试验方法
1.2.1 幼苗培养 试验于2010年9月开始在江苏省农业科学院日光能温室中进行。首先选取生长健康的苏牧2号和N51象草植株,利用茎秆扦插法育苗,培养基质为经淘洗的蛭石,育苗期间用1/2Hoagland营养液浇灌。
1.2.2 海盐胁迫处理 一个月后选取生长基本一致的幼苗(4片真叶)移栽于装有蛭石的塑料花盆(盆高15cm,口径20cm)中,每盆3株,2个供试材料各3盆放于同一大周转箱(长60cm、宽40cm、高15cm)中,然后分别把含海盐0(CK),4,6和10g/L的1/2Hoagland营养液(电导率分别为1.1,4.9,7.4和12.3ds/m)浇灌到各大周转箱中,每个处理4箱,记录液面高度,每天观察补水,保持液面高度。
1.2.3 测定方法 分别在海盐胁迫后第7,14,21和28天,每处理取3次重复测定不同器官中Na+、K+、Ca2+和Mg2+离子的含量。将测定的植株从花盆中取出,用去离子水冲洗干净,吸水纸吸干植株表面水分,将根、茎、叶分开,放入烘箱中105℃杀青1h,80℃烘48h,烘干的样品粉碎后精确称量草粉0.500 0g放入消煮管中,加入高氯酸∶浓硝酸为1∶4的消煮液15mL,管口加盖漏斗,140℃消煮至溶液透明呈淡黄色,继续消煮1h,冷却后50 mL容量瓶定容,取1mL稀释至20mL,用原子吸收光谱法(日立Z-8000原子吸收分光光度计)测定各离子的含量。
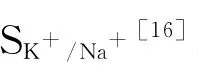
1.3 数据统计
试验数据均采用SAS 9.0统计分析,Microsoft Excel 2003作图。
2 结果与分析
2.1 Na+含量
相同胁迫天数下,苏牧2号和N51植株各部分Na+含量均随海盐浓度的升高而升高(图1)。除胁迫后第7天N51根中Na+含量为6g/L处理显著高于4g/L外,苏牧2号和N51根中Na+含量均随海盐浓度升高而极显著升高。苏牧2号茎中Na+含量在胁迫后第7和14天随海盐浓度升高而极显著升高,21和28d显著升高,N51则均随含盐浓度升高而极显著升高。苏牧2号和N51叶中的Na+含量,不同海盐处理均显著高于对照,各海盐处理间差异不尽相同。
相同海盐浓度胁迫下,随胁迫时间的延长,苏牧2号和N51植株各部分Na+含量始终为叶<茎<根。苏牧2号根中Na+含量随胁迫时间延长呈先升后降的趋势,0~6g/L处理的Na+含量随胁迫时间延长无显著差异,10 g/L处理的14,21和28dNa+含量无显著差异,但均极显著高于7d的Na+含量。N51根中Na+含量随胁迫时间延长的变化趋势和差异随浓度不同变化各异。除0g/L处理下苏牧2号茎中Na+含量随胁迫时间的延长呈下降的趋势外,苏牧2号和N51的茎和叶中Na+含量均呈先降后升的趋势,显著性差异不同浓度各异。
其中,随海盐胁迫时间的延长,苏牧2号根中Na+含量在0~6g/L处理下与N51的差异逐渐不显著,而10 g/L处理下苏牧2号Na+含量显著高于N51。4~10g/L海盐浓度胁迫后,除4g/L胁迫后第7天及6g/L胁迫后第14天苏牧2号与N51无显著差异外,茎中Na+含量苏牧2号均显著低于N51。叶中Na+含量苏牧2号均低于N51,差异不尽相同。
致歉也存在正式与不正式的区别,不正式致歉通常是用在亲朋好友、爱人、熟人之间,它的目标用来消除误解,解除隔阂。正式的致歉通常用在国家和国家间,媒体和大众间。例如:波兰总统通过媒体,向遭受迫害的犹太人致歉。

图1 海盐胁迫下不同象草品种体内钠离子含量Fig.1 Na+ content in different P.purpureumunder sea-salt stress
2.2 K+含量
相同胁迫天数下,苏牧2号和N51植株各部分K+含量均随海盐浓度的升高而降低(图2)。除胁迫后第21天N51根中K+含量4g/L处理和6g/L处理无显著差异外,苏牧2号和N51根中K+含量均为6~10g/L极显著低于0~4g/L。苏牧2号和N51茎、叶中K+含量总体均随海盐浓度升高而极显著下降,除胁迫后第14天苏牧2号及胁迫后第7天N51茎中K+含量为6g/L与10g/L差异不显著,及胁迫后28d苏牧2号叶中K+含量为4g/L与6g/L无显著差异。
相同海盐浓度胁迫下,随胁迫时间的延长,苏牧2号和N51植株各部分K+含量均为根<叶<茎。除N51在4g/L处理后28d显著高于21d外,苏牧2号和N51根中K+含量均随胁迫时间的延长呈下降的趋势,各海盐处理的下降幅度不尽相同。苏牧2号茎中K+含量均随胁迫时间的延长呈升降升的变化趋势,7~21d变化极显著,21和28d差异不显著,N51茎中及苏牧2号和N51叶中K+含量随胁迫时间的延长的变化趋势和差异性不同浓度表现不一。
其中,4~10g/L海盐浓度胁迫后,除10g/L处理后21d苏牧2号与N51无显著差异外,苏牧2号根中K+含量均显著高于N51;除6g/L处理后14d和4g/L处理后28d苏牧2号和N51茎中K+含量差异不显著外,苏牧2号茎中K+含量极显著高于N51;而苏牧2号和N51叶中K+含量高低则不尽相同。

图2 海盐胁迫下不同象草品种体内钾离子含量Fig.2 K+ content in different P.purpureumunder sea-salt stress
2.3 Ca2+含量
相同胁迫天数下,苏牧2号和N51植株各部分Ca2+含量均随海盐浓度的升高而降低(图3)。苏牧2号和N51根中Ca2+含量为4~10g/L均极显著高于0g/L(CK),而各海盐处理间Ca2+含量的显著性差异不尽相同。苏牧2号茎、叶中Ca2+含量则随海盐浓度升高而下降的幅度不尽相同。N51茎中Ca2+含量在胁迫后14~28d均随海盐浓度升高而显著降低,胁迫后第7天为10g/L极显著低于0~6g/L,叶中的Ca2+含量随海盐浓度升高而极显著降低。
相同海盐浓度胁迫下,随海盐胁迫时间的延长,苏牧2号和N51植株各部分Ca2+含量均为根<茎<叶。除4g/L海盐浓度处理后28d苏牧2号根中Ca2+含量大于21d外,苏牧2号和N51根、茎中Ca2+含量均随胁迫时间的延长而降低,不同处理显著性差异各异;叶中Ca2+含量则随胁迫时间的延长呈先降后升的趋势,总体上随时间变化极显著。其中,除0g/L处理后14d和4g/L处理后28d时苏牧2号茎中Ca2+含量与N51无显著差异外,苏牧2号茎中Ca2+含量均极显著高于N51;而苏牧2号和N51根、叶中Ca2+含量随浓度变化高低表现不一。
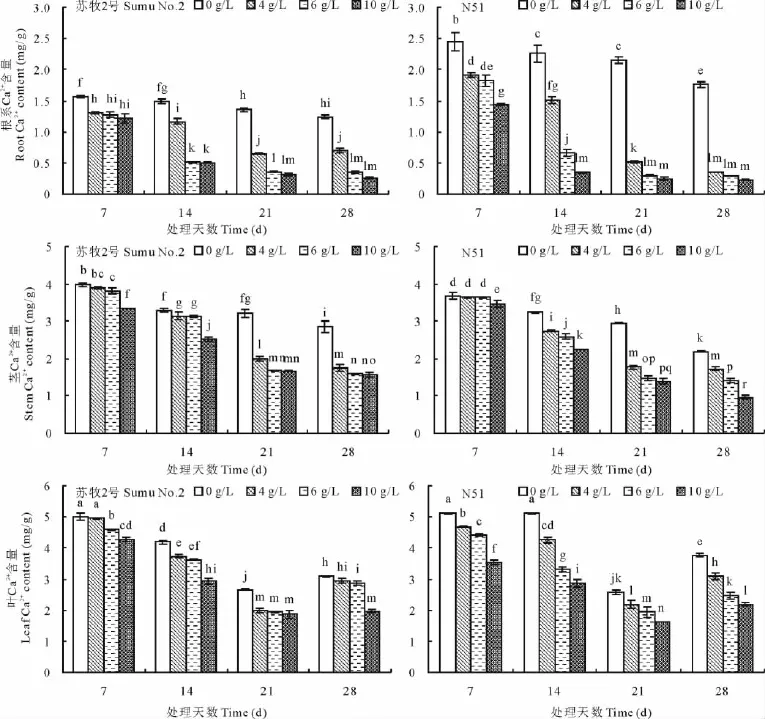
图3 海盐胁迫下不同象草品种体内钙离子含量Fig.3 Ca2+ content in different P.purpureumunder sea-salt stress
2.4 Mg2+含量
相同胁迫天数下,苏牧2号和N51植株各部分Mg2+含量均随海盐浓度的升高而降低(图4)。苏牧2号叶中Mg2+含量随海盐浓度的升高总体呈显著下降趋势,N51叶中及苏牧2号和N51根、茎中Mg2+含量随海盐浓度升高而下降的幅度不尽相同。

图4 海盐胁迫下不同象草品种体内镁离子含量Fig.4 Mg2+ content in different P.purpureumunder sea-salt stress
2.5 K+/Na+
相同天数胁迫下,苏牧2号和N51根、茎和叶中的K+/Na+均随海盐处理浓度的升高而降低(图5)。苏牧2号和N51根中K+/Na+均为4~10g/L极显著低于0g/L,4~10g/L海盐处理间总体上差异不显著。苏牧2号在胁迫后第28天及N51在胁迫后第7和28天茎中的K+/Na+均为6和10g/L无显著差异,极显著低于4 g/L,4g/L极显著低于0g/L,苏牧2号在胁迫后7,14和21d及N51在胁迫后第14和21d总体均为0g/L>4 g/L>6g/L>10g/L(P<0.05)。除胁迫后第28天,6g/L和10g/L处理下苏牧2号叶中的K+/Na+无显著差异,苏牧2号叶中的K+/Na+随浓度变化为0g/L>4g/L>6g/L>10g/L(P<0.05),除胁迫后第14天,6g/L和10g/L处理下N51叶内K+/Na+无显著差异外,N51叶内K+/Na+随海盐浓度升高而极显著下降。

图5 海盐胁迫下不同象草品种体内K+/Na+Fig.5 K+/Na+in different P.purpureumunder sea-salt stress
相同海盐浓度胁迫下,苏牧2号和N51根中K+/Na+总体随胁迫时间的延长而下降,植株各部分K+/Na+为根<茎<叶。其中,4g/L处理下苏牧2号根中K+/Na+为21d小于28d,0g/L和4g/L处理下N51根中K+/Na+为21d小于28d,但均无显著差异。除0g/L处理下苏牧2号茎中K+/Na+随胁迫天数的延长呈极显著上升的趋势外,苏牧2号和N51茎、叶中K+/Na+均随胁迫天数的延长呈先升后降的趋势,不同浓度下降幅度各异,叶中不同处理的升降时间点不同。
其中,0g/L处理后7d和14d,苏牧2号根中K+/Na+极显著低于N51,21d和28d无显著差异,在4~10 g/L处理下,苏牧2号和N51根中K+/Na+均无显著差异。除0g/L胁迫后14d和21d苏牧2号茎中K+/Na+极显著低于N51外,苏牧2号茎K+/Na+均高于N51,各浓度下显著性差异不尽相同。除4g/L处理后28d苏牧2号叶中K+/Na+与N51无显著差异外,4~10g/L处理下苏牧2号均显著高于N51,0g/L处理后7~21d苏牧2号均高于N51,差异不显著,处理后28d苏牧2号极显著高于N51。
2.6 选择性运输系数
相同天数胁迫下,根系与茎的运输选择性系数SK+/Na+(茎/根)总体上随海盐浓度的升高而降低,苏牧2号和N51的4~10g/L处理均低于其对照0g/L。相同海盐浓度胁迫下,随胁迫时间的延长,除0g/L时苏牧2号呈上升趋势外,苏牧2号和N51均呈先升后降的趋势。除4g/L处理后第7天和0g/L处理后第21天苏牧2号低于N51外,苏牧2号均高于N51,是其运输系数的1.02~2.19倍(表1)。

表1 海盐胁迫下不同象草品种根系与茎和茎与叶片的运输选择系数Table 1 SK+/Na+ (leaf/stem)and SK+/Na+ (stem/root)in different P.purpureumunder sea-salt stress
苏牧2号和N51茎与绿叶的运输选择性系数SK+/Na+(叶/茎)随海盐浓度升高和胁迫天数的延长变化不尽相同。0g/L时,随胁迫时间延长茎与叶片的运输选择性系数SK+/Na+(叶/茎)苏牧2号分别是N51的1.45,1.63,1.80和1.18倍,4~10g/L处理下运输系数大小表现不一。
3 讨论
3.1 植株不同部位Na+、K+的分配与运输
离子毒害是盐胁迫对植物造成的主要危害之一[17],盐分中的Na+极易造成单盐毒害,同时对K+和Ca2+等阳离子的吸收产生拮抗作用,使植物组织细胞内离子平衡受破坏,典型指标就是K+/Na+降低[18,19]。随海盐浓度的增加,苏牧2号和N51象草植株各部分的Na+含量迅速增加,由于Na+和K+有相似的离子半径和水合能,两者之间会相互竞争转运体的同一结合位,所以Na+往往利用K+的途径进入植物体内[20,21],Na+和K+之间的相互竞争,造成了植物体内K+的亏缺[22,23],即随海盐浓度的升高,苏牧2号和N51植株各部分K+含量总体上均极显著降低。随胁迫天数的延长,海盐胁迫初期,在含大量Na+的海盐胁迫下,象草质膜透性增强,质膜对K+选择性降低,可能导致Na+大量上运,使得苏牧2号和N51在胁迫后7d茎、叶中Na+大量积累,但随着根部Na+含量不断积累,可能刺激了植物对K+的吸收[16],根部向茎、叶选择性运输更多K+含量,抑制Na+向茎、叶的运输,地上部Na+含量下降,以维持较高的K+/Na+来进行渗透调节,而胁迫后28dNa+含量再次升高,推测可能由于外界温度升高,强烈的蒸发导致海盐浓度增大[24,25],植株遭受更高海盐浓度胁迫,造成Na+在体内的攀升。但对于海盐浓度、胁迫时间和温度交叉作用对象草离子分配及运输情况的研究有待进一步深入。在整个海盐胁迫进程中,苏牧2号和N51根中Na+含量均高于茎、叶,说明象草可以将Na+区域化的截留在根部抑制其向地上部的运输,向茎选择性运输相对更多的K+,茎中K+/Na+升高,象草植株耐盐能力增强,这与钟小仙等[26]前期的研究结果相一致。而K+/Na+的高低作为许多植物较为可靠的耐盐指标,SK+/Na+的选择性运输系数越高,表明植物对K+的选择性运输越强,植物体的抗盐性越强[27,28]。本研究中,苏牧2号SK+/Na+(茎/根)是N51的1.02~2.19倍,因而苏牧2号吸收的K+向茎运输选择性增加,而Na+的运输选择性降低,提高了茎、叶的K+/Na+,从而减轻了植株受盐害程度,是其耐盐性比N51增强的原因之一。
3.2 植株不同部位Ca2+、Mg2+的分配
Ca2+、Mg2+作为植物生长发育所需要的重要营养元素,对于维持象草在海盐胁迫下正常生长具有十分重要的意义。已有研究表明,液泡膜上存在2种Ca2+通道,当植物受到盐胁迫时,Ca2+通道受诱导开放,Ca2+从液泡中释放出来,与钙调蛋白或钙结合蛋白结合,调节细胞代谢或基因表达,促进植物适应逆境[29]。不同海盐浓度胁迫下,苏牧2号和N51植株各部分对Ca2+的吸收均受到不同程度的抑制,但随胁迫时间的延长,苏牧2号茎中Ca2+含量总体上均极著高于N51,而朱小梅等[30]通过对作物耐盐品种和盐敏感品种的比较表明从外部吸收的Ca2+可降低Na+的毒性,促进植株对K+的选择性吸收,提高K+/Na+。因而苏牧2号茎中较高的Ca2+含量可以促进其茎部对K+的选择性吸收,将Na+截流于根部,提高茎中K+/Na+,这样也利于植物对其他营养元素的吸收,进而平衡植物组织细胞内离子浓度,提高了苏牧2号象草的耐海盐胁迫能力。
Mg2+则在植物的生理作用中尤其是在光合作用中有着其他二价阳离子所不可替代的作用[31]。本研究结果显示,随海盐浓度的升高,苏牧2号和N51植株对Mg2+的吸收均受到了抑制,而Mg2+是叶绿素分子的重要组成部分[20],对Mg2+吸收的抑制会降低象草的光合作用,影响象草的生物量。但海盐胁迫后,苏牧2号叶中Mg2+含量极显著高于N51,表明海盐胁迫下苏牧2号的光合作用受到的影响小于N51,但Mg2+在植物适应盐渍环境过程中的具体作用和机理还有待进一步研究。
4 结论
相同胁迫天数下,苏牧2号和N51植株各部分Na+含量均随海盐浓度的升高而升高,K+、Ca2+、Mg2+含量和K+/Na+均随海盐浓度的升高而降低。
相同海盐浓度胁迫下,随胁迫时间的延长,苏牧2号和N51植株各部分Na+含量由低到高为叶<茎<根,K+含量为根<叶<茎,Ca2+含量为根<茎<叶,Mg2+含量为叶<根<茎,K+/Na+为根<茎<叶。
在4~10g/L处理下,苏牧2号和N51根中K+/Na+均无显著差异,苏牧2号茎K+/Na+均高于N51,各浓度下显著性差异不尽相同;除4g/L处理后28d苏牧2号叶中K+/Na+与N51无显著差异外,苏牧2号均显著高于N51。SK+/Na+(茎/根)除4g/L处理后第7天和0g/L处理后第21天苏牧2号低于N51外,苏牧2号均高于N51,是其运输系数的1.02~2.19倍。
[1] 沙伟,滕兆岩,王岩,等.星星草耐盐性研究进展[J].齐齐哈尔大学学报,2007,23(2):93-99.
[2] 丁海荣,洪立州,王茂文,等.星星草耐盐生理机制及改良盐碱土壤研究进展[J].安徽农学通报,2007,13(16):58-59.
[3] 王萍,郭继勋.盐碱化草地常见牧草耐盐机理研究[J].东北师范大学学报自然科学版,1998,(3):116-119.
[4] 杨明锋,杨超,侯文莲,等.NaCl和KCl胁迫对碱蓬根和地上部分生长的效应[J].山东师范大学学报(自然科学版),2002,17(1):68-72.
[5] 侯振安,李品芳,郭世文,等.NaCl胁迫对苜蓿和羊草生长与水分利用的影响[J].中国农业科学,2002,35(7):894-900.
[6] 党瑞红,周俊山,范海.海滨锦葵的抗盐特性[J].植物生理学通讯,2008,44(4):635-638.
[7] 刘志华.盐生植物獐毛耐盐基础生理的研究[J].衡水学院学报,2007,9(1):5-9.
[8] 卜庆梅,柏新富,朱建军,等.盐胁迫条件下三角滨藜叶片中盐分的积累与分配[J].应用与环境生物学报,2007,13(2):192-195.
[9] 王龙强,米永伟,蔺海明.盐胁迫对枸杞属两种植物幼苗离子吸收和分配的影响[J].草业学报,2011,20(4):129-136.
[10] 张永亮,聂微微,任秀珍,等.复盐胁迫下二种虉草K+、Na+吸收与运输的特点[J].中国草地学报,2010,32(3):28-33.
[11] 王先宏,蔡青,杨清辉,等.象草(Pennisetum purpureumSchumach)的减数分裂及植物学特征[J].亚热带农业研究,2005,1(3):7-10.
[12] Lowe A J,Thorpe W,Teale A,et al.Characterisation of germplasm accessions of Napier grass(Pennisetum purpureumand P.purpureum×P.glaucumHybrids)and comparison with farm clones using RAPD[J].Genetic Resources and Crop Evolution,2003,50:121-132.
[13] 王晓敏,张燕,龚德勇.能源植物象草的综合利用和栽培技术[J].河北农业科学,2010,14(4):96-97.
[14] Nyambati E M,Sollenberger L E,Kunkle W E.Feed intake and lactation performance of dairy cows offered napier grass supplemented with legume hay[J].Livestock Production Science,2003,83(2):179-189.
[15] 刘智微,钟小仙,沈益新.海盐胁迫对苏牧2号象草抗氧化酶活性和MDA含量的影响[J].中国草地学报,2011,33(1):24-29.
[16] 李品芳,杨志成.NaCl胁迫高羊茅生长及K+、Na+吸收与运输的动态变化[J].草业学报,2005,14(4):58-64.
[17] 张永亮,聂微微,任秀珍,等.复盐胁迫下二种虉草K+、Na+吸收与运输的特点[J].中国草地学报,2010,32(3):28-33.
[18] Greenway H,Munns R.Mechanism of salt tolerance in non-halophytes[J].Annual Review of Plant Physiology and Plant MolecularBiology,1980,31:149-190.
[19] 於丙军,刘友良.SOS基因家族与植物耐盐性[J].植物生理学通讯,2004,40(4):409-413.
[20] 景艳霞,袁庆.NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响[J].草业学报,2011,20(2):134-139.
[21] Blumwald E.Sodium transport and salt tolerance in plants[J].Current Opinion in Cell Biology,2000,12:431-434.
[22] 陈菊培.盐胁迫下植物细胞吸收Na+的可能途径[J].海南大学学报自然科学版,2005,23(4):383-390.
[23] 朱义,谭贵娥,何池全,等.盐胁迫对高羊茅(Festuca arundinacea)幼苗生长和离子分布的影响[J].生态学报,2007,27(12):5447-5454.
[24] 冯玉龙,刘恩举,崔臻祥.根系温度对植物的影响-根温对植物代谢的影响[J].东北林业大学学报,1995,23(4):94-99.
[25] 高瑞,赵瑞华,杨学军,等.盐分和温度对盐节木幼苗早期生长的影响[J].生态学报,2009,29(10):5395-5405.
[26] 钟小仙,张建丽,张国正,等.海盐胁迫下象草体细胞突变体苗期生长及Na+、K+分配[J].中国草地学报,2010,32(1):48-52.
[27] 邹丽娜,周志宇,颜淑云,等.盐分胁迫对紫穗槐幼苗生理生化特性的影响[J].草业学报,2011,20(3):84-90.
[28] 赵昕,赵敏桂,谭会娟,等.NaCl胁迫对盐芥和拟南芥K+、Na+吸收的影响[J].草业学报,2007,16(4):21-24.
[29] 李子芳,王玉国,孙守钧.植物应对盐胁迫的生理机制[J].河北农业科学,2008,12(3):1-3.
[30] 朱小梅,洪立洲,王茂文,等.NaCl胁迫下作物对离子的吸收及分配[J].中国土壤与肥料,2010,4:1-4.
[31] 邹轶,顾洪如,钟小仙,等.海盐胁迫对海滨雀稗生长及植株体内阳离子含量的影响[J].草业科学,2009,26(4):117-120.
