SRAP与SSR分子标记在柳枝稷杂种鉴定中的比较分析
2012-08-20张婧黄琳凯ZHAOBingyu张新全严海东蒋晓阳
张婧,黄琳凯*,ZHAO Bing-yu,张新全,严海东,蒋晓阳
(1.四川农业大学草业科学系,四川 雅安625014;2.弗吉尼亚理工大学,美国 弗吉尼亚州VA 24061)
柳枝稷 (Panicum virgatum)是一种高大的多年生草本C4植物,具有适应性广、生物质产量高和对环境友好等优点,在生态改良和新能源开发方面潜力巨大[1]。开发清洁可再生的生物质能源意义深远,美国能源部将柳枝稷作为纤维素类能源植物中的模式植物,而我国对柳枝稷的应用和研究尚处于起步阶段,选育适合我国栽培的柳枝稷品种可加快能源植物产业的发展。
品种选育和改良可有效提高其能量转化率和经济效益,而分子育种可大大加快柳枝稷的育种进程。杂种鉴定是遗传育种的基础工作之一,鉴定出的真杂种可为杂交育种和遗传图谱构建等提供重要依据。柳枝稷是异花授粉多倍体植物[2],在杂交过程中由于隔离不严或者具有一定的自交率等原因,不同来源花粉可导致种子生物学混杂,因此对杂交后代的真实性鉴定十分必要。分子标记技术由于具有快速简便,可以实现高通量等优点,被广泛应用于各种植物的杂种鉴定和杂种纯度分析工作中,如柚(Citrus maxima)[3],辣椒(Capsicum annuum)[4],枣(Ziziphus jujuba)[5]等。其中简单重复序列(simple sequence repeat,SSR)标记技术具有共显性、结果可靠、重复性好的特点,在杂种鉴定,遗传多样性研究,遗传图谱构建等方面应用广泛[6-9]。表达序列标签(expressed sequence tags,ESTs)的发展促进了SSR的应用,并且快速增长的ESTs数据已成为SSR标记的重要开发来源。与基因组SSR相比,EST-SSR的开发不需要构建DNA文库及克隆测序等步骤,更为节省成本和时间[10]。2001年美国加州大学 Li和 Quiros[11]发明了相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)技术,是一种新型的基于PCR的随机引物标记系统。SRAP属于显性标记,具有多态性高,操作简便等优势,已经被广泛运用于遗传多样性分析和杂种鉴定工作中,如多花黑麦草(Lolium multiflorum)[12]、结缕草(Zoysia japonica)[13]、紫花苜蓿(Medicago sativa)[14]、柱花草(Stylosanthes guianensis)[15]等植物。但是这2种分子标记在柳枝稷杂种鉴定中的比较分析,尚未见报道。
本研究分别利用SRAP和SSR标记技术对柳枝稷165个杂交后代进行杂种真实性鉴定,分析显性标记SRAP与共显性标记SSR在杂种鉴定中的扩增多态性以及鉴定准确性和效率,为应用分子标记技术快速鉴定柳枝稷乃至异花授粉多倍体植物的杂种真实性提供依据,且鉴定得到的真杂种可以用于构建柳枝稷遗传图谱、重要性状的QTL定位等研究。
1 材料与方法
1.1 供试材料
亲本Alamo和Dacotah,以及以Alamo为父本,Dacotah为母本杂交得到的165株F1植株,编号为DAT1~DAT165。杂交后代和亲本均盆栽于温室中。其中Alamo属于低地生态型,植株较高大,茎秆粗壮;Dacotah属于高地生态型,茎秆较细,分枝较多。
1.2 基因组DNA提取
本实验于2010年4月进行。以柳枝稷幼叶为材料,采用植物基因组DNA提取试剂盒(天根公司)提取DNA。提取的DNA用0.8%的琼脂糖凝胶电泳进行纯度的检测。将DNA样品置于-20℃冰箱保存。待开始实验时,将各个DNA样品取出一部分稀释至20ng/μL,放于4℃冰箱保存并备用。
1.3 SRAP分析
SRAP标记引物序列见Li和Quiros[11]的报道。SRAP标记共有上游引物12条,下游引物19条,两两组合为228对引物。用亲本Alamo和Dacotah对SRAP引物进行父本特征带的筛选。PCR扩增反应体系为20μL:DNA 2μL(20ng/μL),2×Taq PCR MasterMix(天根公司)10μL,上下游引物各1μL(10μmol/L),灭菌水补齐20μL。
SRAP-PCR反应程序为:94℃预变性5min;94℃变性1min,35℃复性1min,72℃延伸1min,共5个循环;94℃变性1min,50℃复性1min,72℃延伸1min,共35个循环;最后72℃延伸10min,-20℃保存[16]。以上PCR反应在PTC-200PCR(Bio-Rad)仪上进行。最后PCR扩增产物采用2.0%的琼脂糖凝胶进行电泳分离,0.1mg/mL的溴化乙锭(EB)染色,120V电压(5V/cm)在0.5×TBE缓冲液中电泳约1.5h,电泳结束后凝胶在凝胶成像系统(Bio-Rad)中照相并保存。
1.4 SSR分析
柳枝稷EST-SSR标记引物序列由Tobias等[17]提供,共30对引物。随机选择2个F1植株及双亲共4份材料的DNA对30对EST-SSR引物进行多态性筛选,选择扩增条带清晰、带型稳定,具有父本特征带的引物,用于杂种鉴定。PCR反应扩增体系20μL:DNA 2μL(20ng/μL),2×Taq PCR MasterMix(天根公司)10μL,上下游引物各1μL(10μmol/L),灭菌水补齐20μL。
EST-SSR PCR反应程序为:94℃预变性5min;94℃变性1min,52℃退火1min,72℃延伸1.5min,共35个循环;最后72℃延伸10min,4℃保存。最后PCR扩增产物采用1.2%的琼脂糖凝胶进行电泳分离,0.1 mg/mL的溴化乙锭 (EB)染色,120V电压(5V/cm)在0.5×TBE缓冲液中电泳约1.5h,电泳结束后凝胶在凝胶成像系统(Bio-Rad)中照相并保存。
1.5 杂种鉴定
对于显性标记SRAP分子标记,F1扩增产物中具有父本特异条带,则可鉴定为真杂种,若仅具有母本特异条带,则需结合其他引物进行进一步分析;对于共显性标记SSR分子标记,选取具有双亲互补型条带的引物进行分析,F1扩增产物中具有父本特异条带,则鉴定为真杂种,反之则为假杂种。
2 结果与分析
2.1 亲本间具有多态性的SRAP引物筛选
对228对引物进行多态性条带的筛选,选出在子代中多态性好,且具有父本特征带的引物组合为:me1+em7,me2+em16,me2+em5,me3+em12,me7+em13,me10+em19,共6对。所选引物的多态性比率最大66.66%,最小为33.33%,平均为40.00%。
2.2 具有双亲互补带型的EST-SSR引物筛选
从30对EST-SSR引物中,筛选出11对带型稳定并在杂种及亲本间具有多态性的引物(表1),这些多态性引物中,primer23,primer79,primer793和primer995具有双亲互补带型,引物的多态性条带比率为100.00%。所选引物多态性比率最小为50.00%,平均为71.22%。
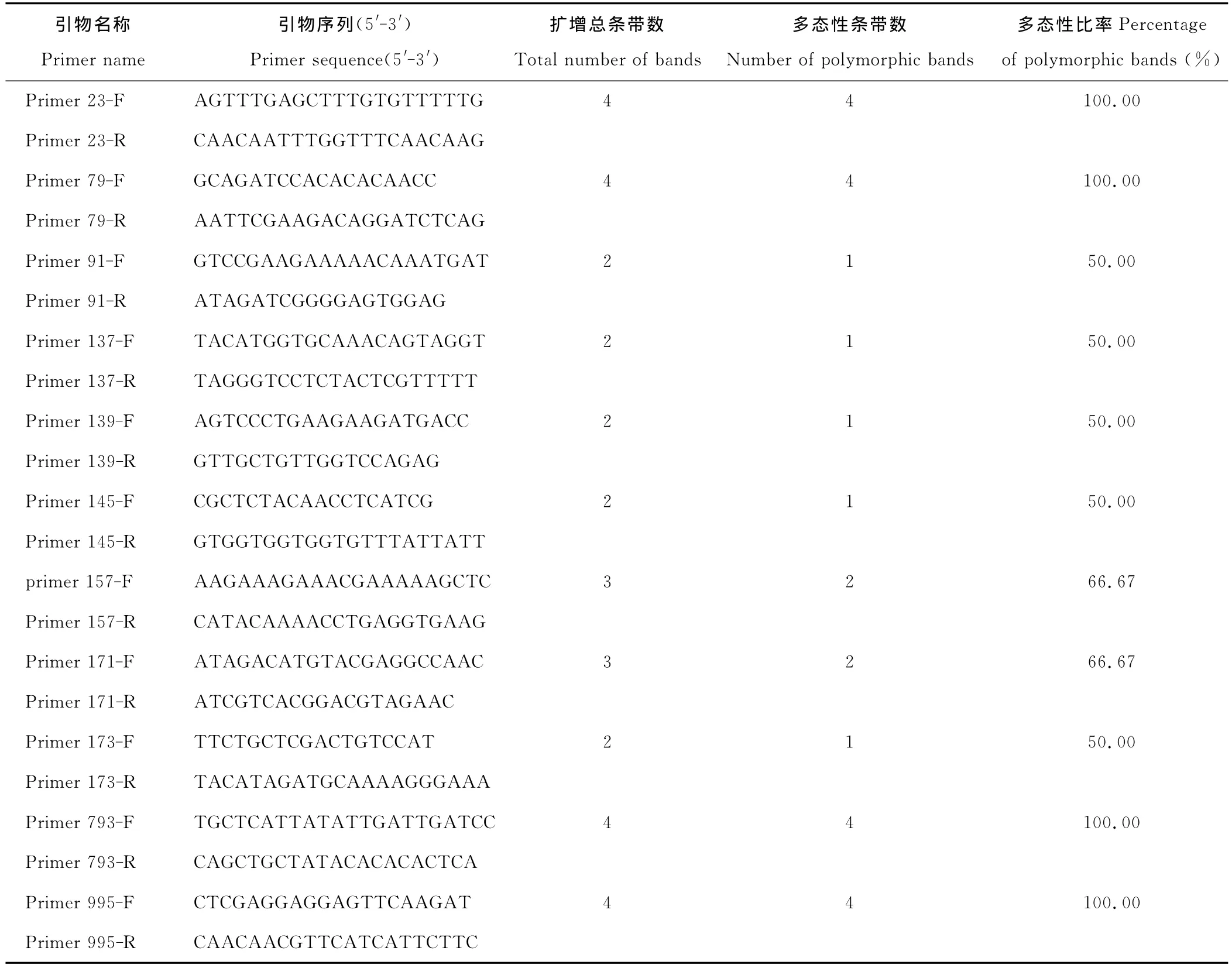
表1 11对SSR引物多态性统计结果Table 1 The polymorphism of 11pairs of SSR primers
2.3 杂种真实性鉴定
在用SRAP引物鉴定过程中,引物me1+em7有69个F1植株的扩增图谱中没有出现父本特征带(表2),继而使用其余引物逐一鉴定,只要出现父本特征带则判定为真杂种,若仅有母本特征带则利用其他引物进一步分析。实验中共使用6对引物鉴定了165个F1植株的真实性,DAT163在所用引物中均未出现父本特征带,不能确认是否为真杂种。引物me1+em7的扩增图谱见图1。
在用EST-SSR引物鉴定过程中,仅使用1对引物,即primer23,就可以鉴别所有F1植株的真实性,体现了共显性标记SSR在杂种鉴定中的高效性。但是应该选择具有双亲互补性条带进行杂种鉴定,如primer23,primer79,primer793和primer995,在父本Alamo中扩增带型为ab,在母本Dacotah中扩增带型为cd(primer23扩增效果见图2)。鉴定结果为DAT163未出现父本特征带,确认其为假杂种,与SRAP鉴定结果基本相同。
2.4 柳枝稷杂种群体的SRAP与SSR标记扩增产物多态性
利用6对SRAP引物对165个F1植株扩增,共得到20个条带,平均每对引物得到3.3个条带,其中多态性条带共8条,平均每对引物1.3条多态性条带,多态性条带百分比为40%。因此SRAP在杂交种中检测的多态性百分比相对较低(表2)。
用SSR引物primer23扩增时,得到4个条带均为多态性条带,属于双亲互补型,多态性条带比率为100%(表2)。表明SSR标记能够检测出较多的遗传位点,获得多态性高的PCR结果,鉴定效率更高。
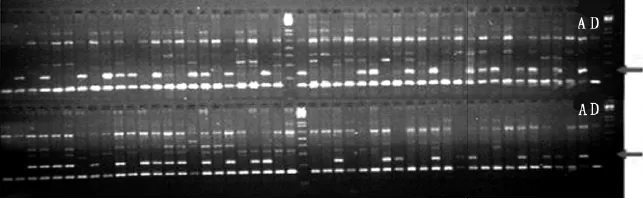
图1 引物me1+em7对柳枝稷F1的SRAP检测图谱Fig.1 SRAP marker amplified with primer me1+em7in the F1population

图2 引物primer23对柳枝稷杂交种的SSR检测图谱Fig.2 SSR fingerprint amplified with primer pair No.primer23in switchgrass hybrids
3 讨论
就准确性而言,SSR与SRAP标记的鉴定结果相同,都可用于柳枝稷的杂种鉴定工作,从而提高结果的准确性。但就鉴定效率而言,SSR分子标记表现出了很大的优势。SRAP标记是一种显性标记,在对杂种的真实性进行鉴定时,出现父本特异条带就可以认为是真杂种,而出现母本特异条带时则不能说明是否为真杂种。显性标记只能肯定杂种的真实性,不能否定。同时,用多个引物才可以确定杂交种的真实与否。SSR是一种共显性标记,本研究中只用1对ESTSSR引物便鉴定出了165个杂种的真实性,表现出了EST-SSR在杂种鉴定工作中的高效率。在研究中用了6对SRAP引物才鉴别出165个F1植株的杂种真实性,因此共显性的EST-SSR标记在杂种鉴定工作中有独特的优势,但要选择在亲本中高度多态的引物,最好是在亲本间能扩增出4个不同的条带,如引物primer23。
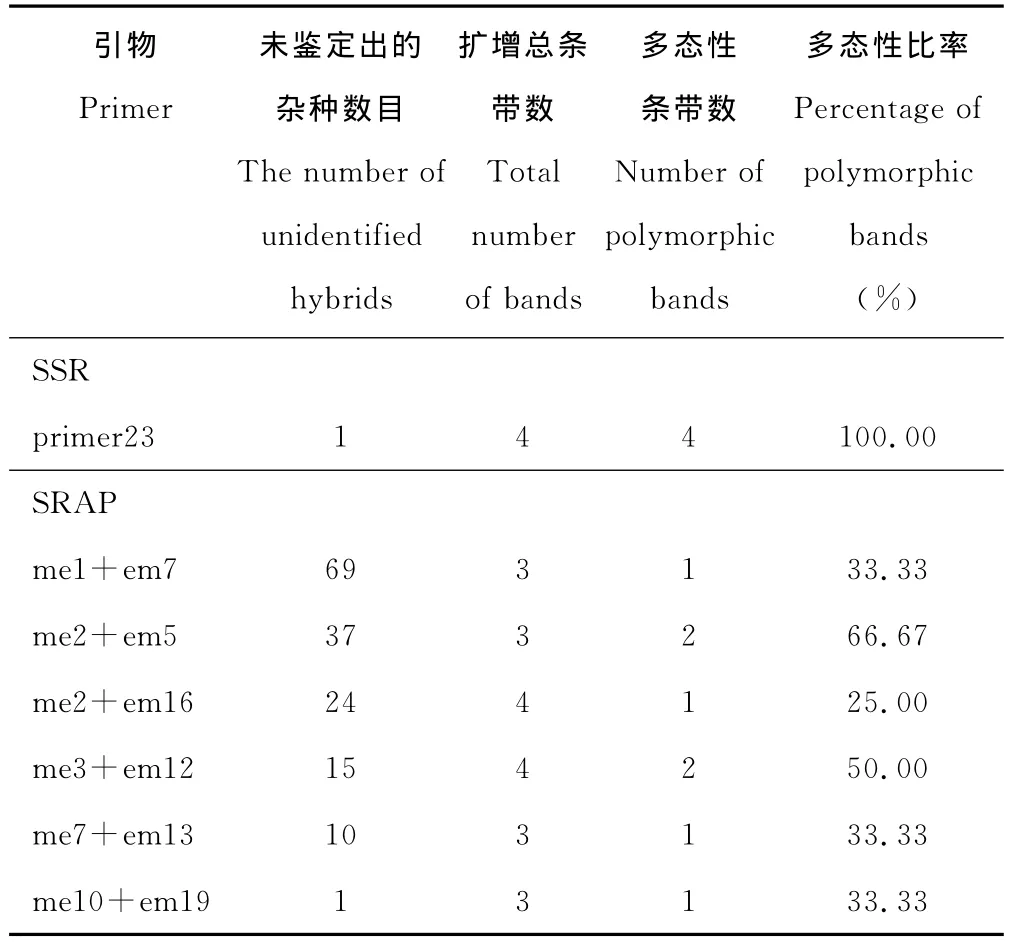
表2 SSR标记与SRAP标记鉴定结果Table 2 Identification of 165hybrids by SSR and SRAP markers
本研究中,SRAP标记扩增条带的多态性比率低于SSR标记。SSR多态性产生主要是由于DNA复制和修复过程中碱基的滑动、错配或减数分裂过程中姊妹染色单体的不均等交换,故多态性产生的几率较高[18]。SSR为共显性遗传,每个位点具有多个等位基因,因此SSR标记的期望异质性比显性标记SRAP高。王华忠等[19]利用SRAP与SSR标记分析不同类型甜菜(Beta vulgaris)的遗传多样性证实了这一点,在他的研究中,11对SRAP引物共扩增出199个条带,其中86条具有多态性,多态性带比率为43.7%,而SSR的9对引物共产生35条扩增带,多态性比率为100%,远远高于SRAP。
EST-SSR不仅具备传统基因组SSR标记的优点,而且开发简单快捷,费用更低;ESTs来自转录区,保守性高,故其通用性较好;此外EST-SSR可直接和表达基因相关联,发现连锁的分子标记之后,更容易克隆到目标基因[20]。作为一种新的SSR标记,EST-SSR标记已经在许多植物种类中得到应用,例如葡萄(Vitis vinifera)、甘蔗(Saccharum officinarum)、小麦(Triticum aestivum)以及高羊茅(Festuca arundinacea)等物种[10],但在杂种鉴定中的应用报道较少。
目前报道的杂种鉴定研究多是基于单一分子标记鉴定的结果,本研究同时应用SSR和SRAP标记技术进行杂种鉴定,鉴定结果比单一标记鉴定的结果更准确、可靠,为应用分子标记技术快速鉴定柳枝稷乃至异花授粉多倍体植物的杂种真实性提供科学依据,且鉴定出的真杂种可用于柳枝稷遗传图谱的构建及重要性状的QTL定位,从而为柳枝稷分子标记辅助育种的研究打下重要基础。
[1] Adler P R,Stephen J D G,Partonw J.Life cycle assessment of net greenhouse gas flux for bioenergy cropping systems[J].Ecological Applications,2007,17:675-691.
[2] Sanderson M A,Reed R L,McLaughlin S B,et al.Switchgrass as a sustainable bioenergy crop[J].Bioresource Technology,1996,56:83-93.
[3] 韩国辉,向素琼,汪卫星,等.沙田柚杂交后代群体的SSR鉴定与遗传多样性分析[J].中国农业科学,2010,43(22):4678-4686.
[4] 陈学军,方荣,周坤华,等.辣椒种间杂种的表型鉴定及SRAP分析[J].西北植物学报,2011,31(2):0286-0290.
[5] 鹿金颖,毛永民,申莲英,等.用AFLP分子标记鉴定冬枣自然授粉实生后代杂种的研究[J].园艺学报,2005,32(4):680-683.
[6] 谢文刚,张新全,陈永霞.鸭茅杂交种的SSR分子标记鉴定及遗传变异分析[J].草业学报,2010,19(2):212-217.
[7] 鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析[J].草业学报,2010,19(4):122-134.
[8] 乔岩,王汉宁,张成,等.玉米胚乳突变基因ae连锁累赘的SSR分析[J].草业学报,2011,20(1):140-147.
[9] 韩永增,王赞,高洪文,等.小叶锦鸡儿SSR-PCR体系优化及应用[J].草业科学,2011,28(3):399-413.
[10] 姜春芽,廖娇,徐小彪,等.植物EST-SSR技术及其应用[J].分子植物育种,2009,7(1):125-129.
[11] Li G,Quiros C F.Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction:Its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103:455-461.
[12] 季杨,张新全,马啸,等.多花黑麦草品种(系)间杂交及其杂种后代SRAP遗传分析[J].草业学报,2009,18(4):260-265.
[13] 薛丹丹,郭海林,郑轶琦,等.结缕草属植物杂交后代杂种真实性鉴定——SRAP分子标记[J].草业学报,2009,18(1):72-79.
[14] 何庆元,吴萍,张晓红,等.不同秋眠性苜蓿SRAP体系优化及遗传多样性分析[J].草业学报,2011,20(2):201-209.
[15] 张伟丽,刘凤民,刘艾,等.柱花草SRAP-PCR体系优化及其遗传多样性分析[J].草业学报,2011,20(4):159-168.
[16] 林忠旭,张献龙,聂以春,等.棉花SRAP遗传连锁图构建[J].科学通报,2003,48(15):1676-1679.
[17] Tobias C M,Hayden D M,Twigg P,et al.Genic microsatellite markers derived from EST sequences of switchgrass[J].Molecular Ecology Notes,2006,6:185-187.
[18] Powell W,Morgante M,Andre C,et al.The comparison of RFLP,RAPD,AFLP and SSR (microsatellite)markers for germplasm analysis[J].Molecular Breeding,1996,2:225-238.
[19] 王华忠,吴则东,王晓武,等.利用SRAP与SSR标记分析不同类型甜菜的遗传多样性[J].作物学报,2008,34(1):37-46.
[20] Schubert R,Starck G M,Riegel R.Development of EST-PCR markers and monitoring their intrapopulationa genetic variation in Picea abies (L.)Karst[J].Theoretical Applied Genetics,2001,103:1223-1231.
