祁连山不同海拔梯度山生柳遗传多样性的SSR分析
2012-08-20郭敏马彦军李毅
郭敏,马彦军,李毅
(甘肃农业大学林学院,甘肃 兰州730070)
简单重复序列(SSR,simple sequence repeat)由Moore等于1991年创立,是一类由几个碱基组成的基序串联重复而成的DNA序列,其长度一般较短,每单元长度在1~6bp,两边有保守的DNA序列[1]。SSR具有很多优点,它具有高度的多态性,数量丰富、信息含量高和重复性好等特点,遵循孟德尔的遗传规律同时具有共显性的模式,而且对DNA的纯度要求不高,这就大大减少了工作的复杂度。并且SSR标记覆盖整个基因组,呈现多基因特点,表现为共显性遗传[2-5]。
需要引起注意的是在SSR引物的获得途径中,由于目前只建立了DNA文库和cDNA文库,因此对于其中大多数的物种获取SSR引物是比较困难的,对于一些以往处于初步研究的树种可以借鉴其近缘种甚至其他物种已开发的引物[6],如柑橘属(Citrus)的不同种[7]以及猕猴桃属(Actinidia)的不同种的引物开发[8]。本试验中首先通过杨树(Populus)引物在柳树(Salix)上的通用性探究旨在加速杨柳树种遗传育种学的研究进程。
山生柳(Salix oritrepha)为杨柳科柳属多年生落叶直立小灌木,为我国特有种,主要分布于海拔3 000~3 700m的高山山脊、山坡、沟谷林缘,具有生长快,无病虫害等特点[9],山生柳不仅具有以灌护草、以灌育草的作用,还能有效控制水土流失、涵养水源、培育土壤,对于生态系统的稳定性有着重要作用[10]。目前国内在分子方面对祁连山不同海拔梯度高寒植物的遗传多样性分析未见报道。因此本课题组在已进行的研究中,对祁连山脉的山生柳资源进行了较多研究,并对分布于祁连山西水生态站的山生柳进行了梯度式考察取样并作了细致的群落调查[11,12]。本试验试图通过从杨树引物中筛选适合山生柳的引物并通过优化反应条件,建立山生柳SSR标记的反应体系和条件,分析山生柳的遗传多样性,为山生柳的进一步研究提供依据,并为保护和发展祁连山高寒植被提出科学依据。
1 材料与方法
1.1 取样方法和SSR引物来源
本研究选择山生柳分布较为广泛的祁连山自然保护区西水生态站作为实验点,该区极端最高气温40℃,极端最低气温-35℃,年降水量400.8mm,集中在6-9月,空气相对湿度58%,年蒸发量3 878mm,平均日照时数2 879.8h,无霜期平均187d。该区土壤和植被因气候差异而形成明显的垂直分布带,山地森林灰褐土和亚高山灌丛草甸土是森林适宜生长的土壤,山地森林灰褐土分布在海拔2 400~3 300m地带,是乔木林的主要分布带,混杂有山生柳。亚高山灌丛草甸土分布在海拔3 300~3 900m地带,是山生柳的主要分布带。
取样时,首先在海拔2 800~3 500m范围内设样线,在各样线上沿海拔梯度平均每50m设置16m×16m的样地1块,共9个样地。然后在各样地内,对山生柳进行取样。每个梯度随机采20个无病害的叶片作样方,共9个海拔梯度,180个单株(表1),随着海拔的升高,山生柳的形态也有显著变化。引物来源(http://www.ornl gov/sci/ipgc/ssr_resource.htm,USA),随机抽取合成。采用改良后的CTAB法提取植物 DNA[13],-20℃下保存。于2009年6月-2010年6月进行了研究。
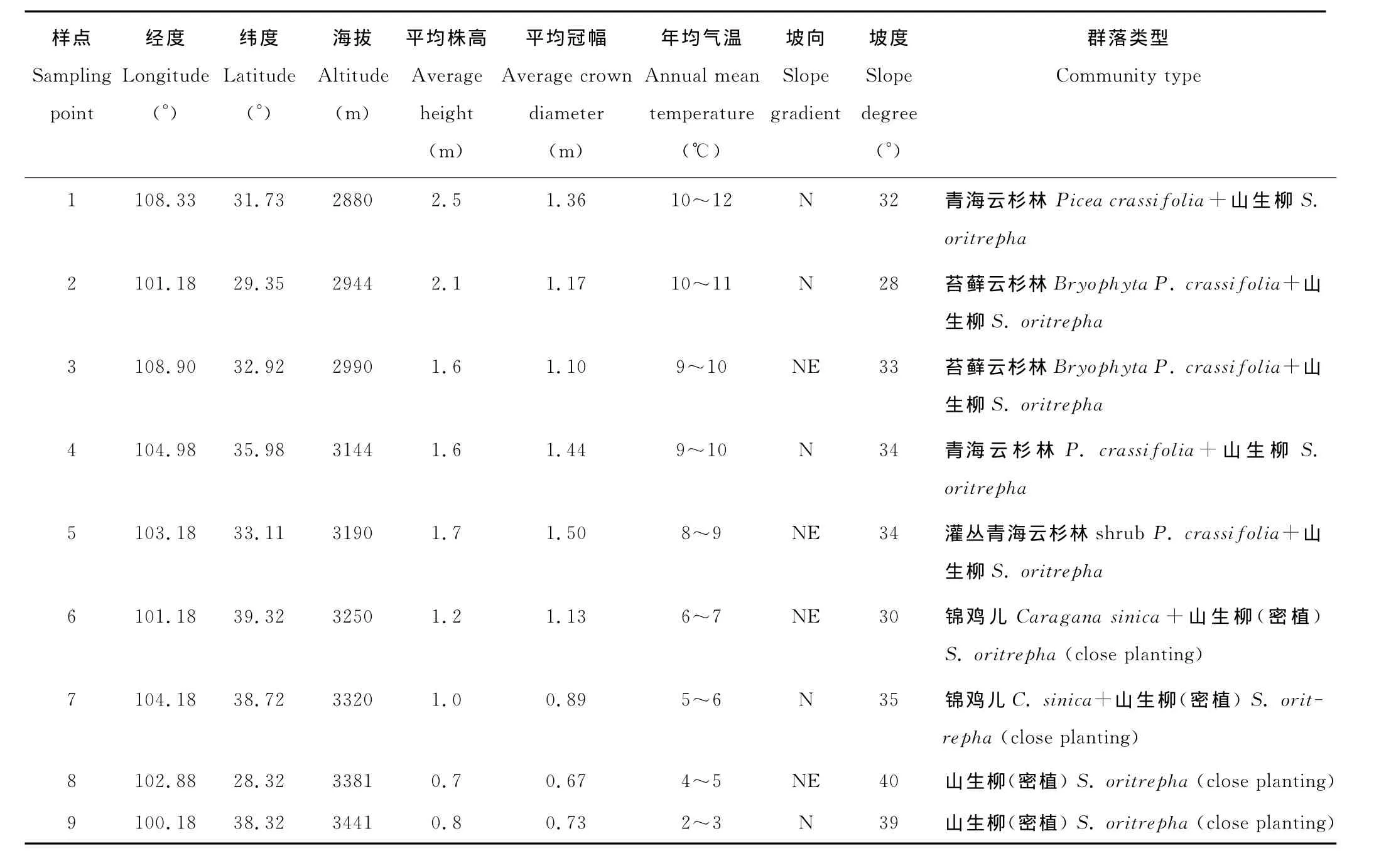
表1 材料来源及生境特点Table 1 The origin of examined plants and their habitat characteristics
1.2 PCR扩增和成果检测
PCR程序采用优化后的山生柳20μL体系,其中含有2.5mmol/L Mg2+1μL,0.10mmol/L浓度的dNTPs 1.5μL,0.5UTaq酶用量为1μL,20ng/μL DNA模板1μL,0.5μmol/L的上下游引物各2μL,10×Taq Buffer 2μL、ddH2O加至20μL。PCR的预扩增程序经优化后,94℃预变性5min,94℃变性30s,54℃(不同引物有不同的退火温度)退火45s,72℃延伸30s,循环数30个,最后再72℃延伸10min,4℃保温。PCR产物经8%变性聚丙烯酰胺凝胶电泳(200V稳压,2h)分离,银染检测[14]。
1.3 数据统计和分析
根据电泳结果,本研究用Amersham Pharmacia Biotech公司的Image Scanner电泳扫描分析对凝胶进行扫描,根据共显性分子标记基因型分型的原则,对得到的图谱进行分析。有带记为1,无带记为0[15],采用Popgen 32软件进行数据处理,该软件的优点是处理的数据量大,适合于等位酶数据处理也适合于SSR的数据处理,因为它能给出所研究的各群体之间的一些资料,如:多态位点百分率,群体间的遗传距离及遗传一致度等。
2 结果和分析
2.1 山生柳SSR扩增引物的筛选
通过对PCR扩增的各个引物结果进行直观比较从而筛选出15条带型稳定,重复性高的最佳引物。利用这15对引物对山生柳的遗传多样性进一步分析。15个引物,共扩增出211条条带,分子量50~2 000bp,不同引物扩增的多态性带纹数目从8到22不等,形成了带型丰富、片断大小及其组合不同的电泳图谱(图2和图3)。其中多态性条带有176个,这说明了山生柳具有较高的遗传多样性。杨属引物的多态性比例达到76.41%。47对引物中,有43对带型稳定清晰,通用性达91.1%(图1),杨树引物的多态性比例较好(表2),引物WPMS15的多态性比率达到了90%,而引物SHUKl23、SHUKl24、SHUK034的多态性比率甚至达到了100%。结果证明了杨属植物的引物在山生柳SSR-PCR体系建设中通用性良好。
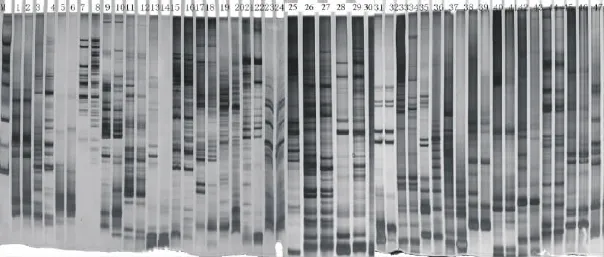
图1 引物1~47为待筛选杨树引物的扩增Fig.1 Primer 1-47for populus primer which were selected
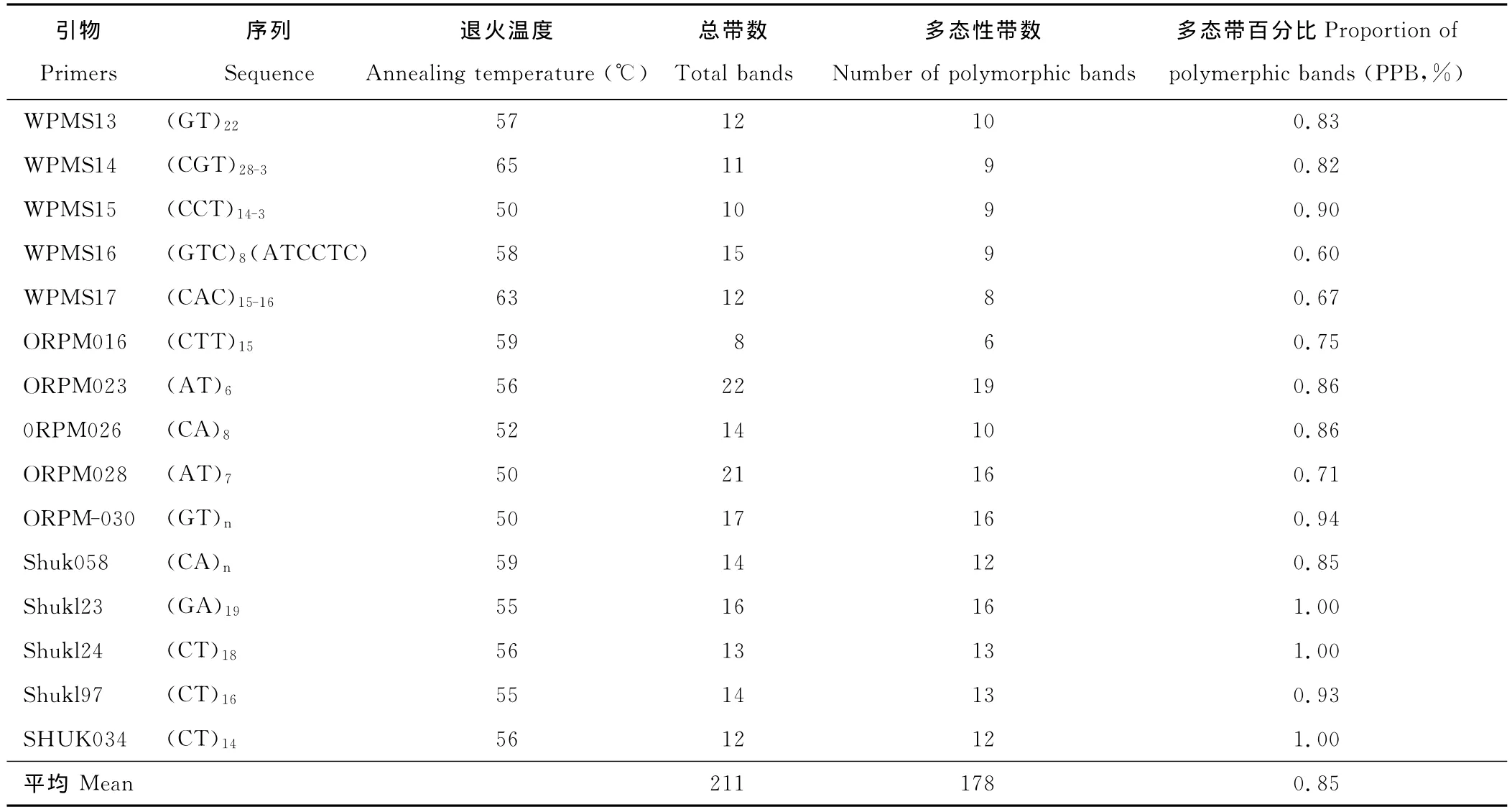
表2 选用15对引物扩增的谱带信息Table 2 The information on bands generated by 15SSRs
2.2 山生柳不同海拔梯度的遗传多样性分析
通过Popgen32计算得出的结果显示各海拔梯度的shannon指数(I)的多态性在0.234 2~0.598 8,平均为0.419 2。Nei指数在0.146 0~0.434 2(表3),平均为0.279 6,2种指标都表明山生柳种群具有较高的遗传多样性[16],而且随着海拔梯度的升高遗传多样性呈现升高的趋势。不同海拔梯度间的Gst和Nm,总的遗传多样性Ht=0.282 2,种群内遗传多样性 Hs=0.255 8,Gst=0.093 5,即9.35%的遗传变异存在在居群间,90.55%的遗传变异存在居群内(表4)。不同引物其遗传分化系数所占的比例不同,其中ORPM-030最高,占到25.39%,引物SHUK034最低,为4.64%(表4)。基于种群间遗传分化系数计算的基因流为Nm=4.848 7>1,这说明居群间有较高水平的基因流,足以防止遗传漂变所导致群居间的遗传分化。图2和图3显示了不同引物在山生柳扩增中的多态性,不同引物形成了8~22的带型丰富及重复性好的电泳图谱。同时观察到杨树引物能很好的显示物种的遗传分化情况,可以方便的鉴定物种的遗传多样性。
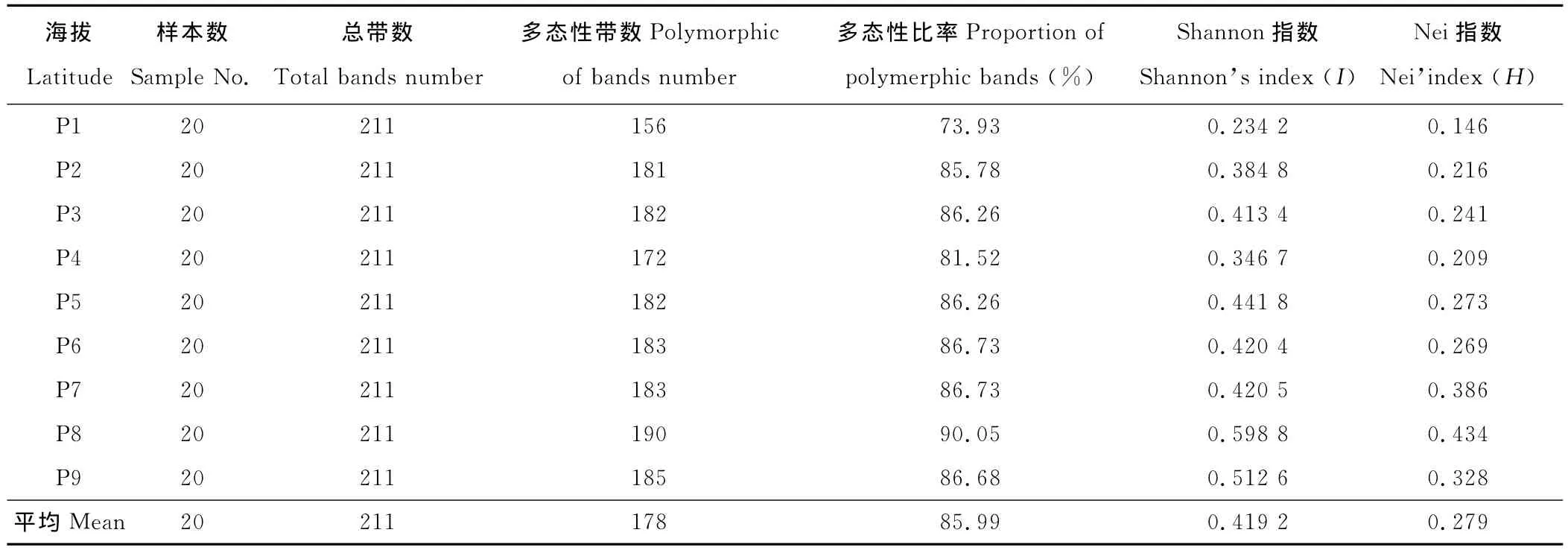
表3 甘肃祁连山不同海拔梯度山生柳的遗传多样性Table 3 Genetic diversity analysis of different latitudes of S.oritrepha
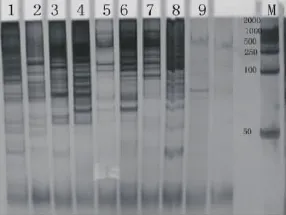
图2 引物ORPM-030在不同海拔山生柳中的扩增结果Fig.2 SSR amplification results of S.oritrepha with primer ORPM-030
2.3 山生柳不同海拔梯度的遗传距离和遗传一致度
9个海拔梯度具有较高的遗传一致度平均为0.943 7(表5),其中海拔梯度P9和P8相似系数最高,为0.999 7,海拔梯度越高,遗传多样性越高,具有较多相同的遗传物质。9个海拔梯度的遗传距离平均为0.029 6,海拔梯度P8和P9的遗传距离最小,同样说明高海拔的山生柳就有较高的遗传多样性。
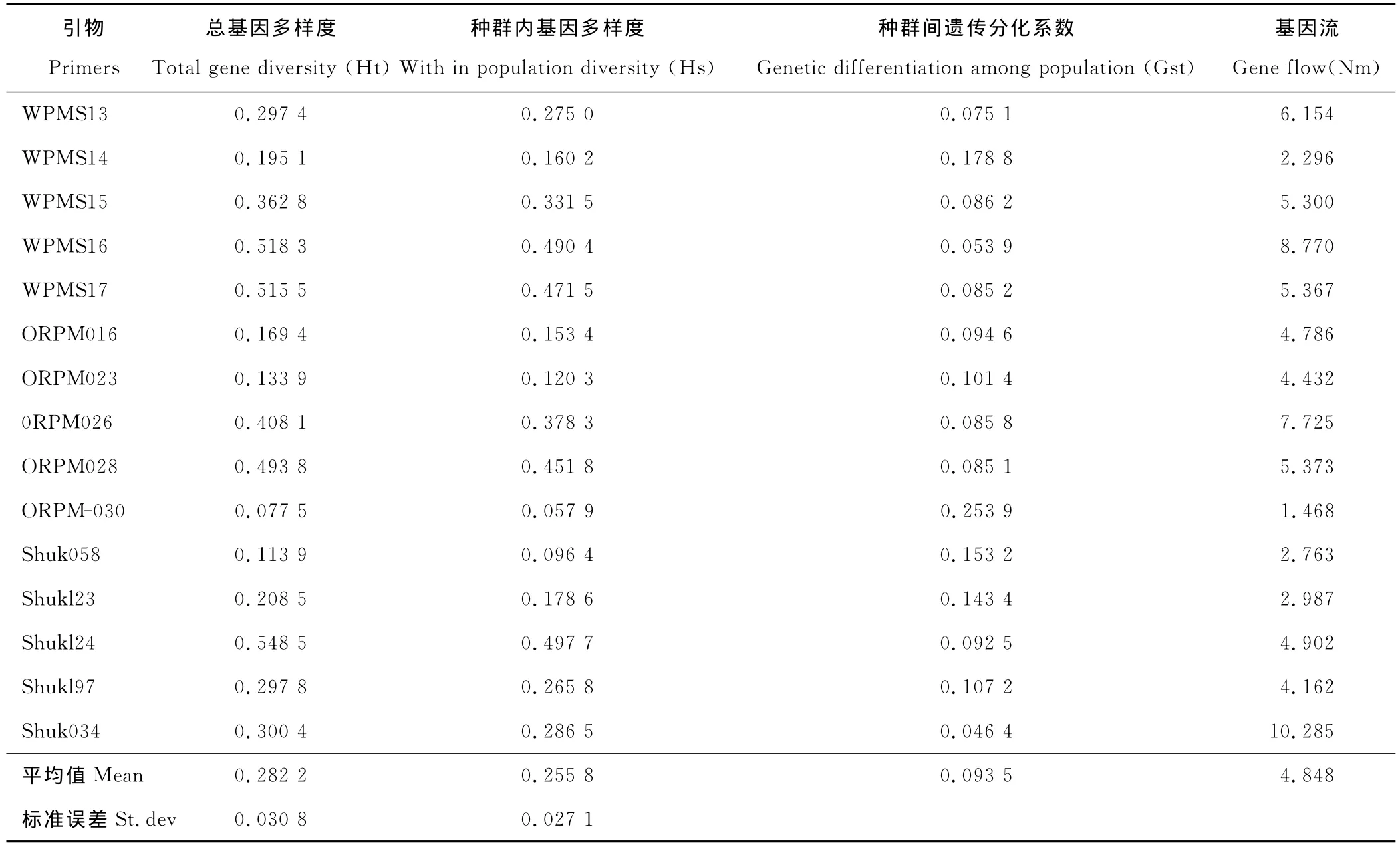
表4 甘肃省祁连山不同海拔梯度山生柳种群的遗传分化Table 4 Genetic differentiations among nine altitudes of S.oritrepha
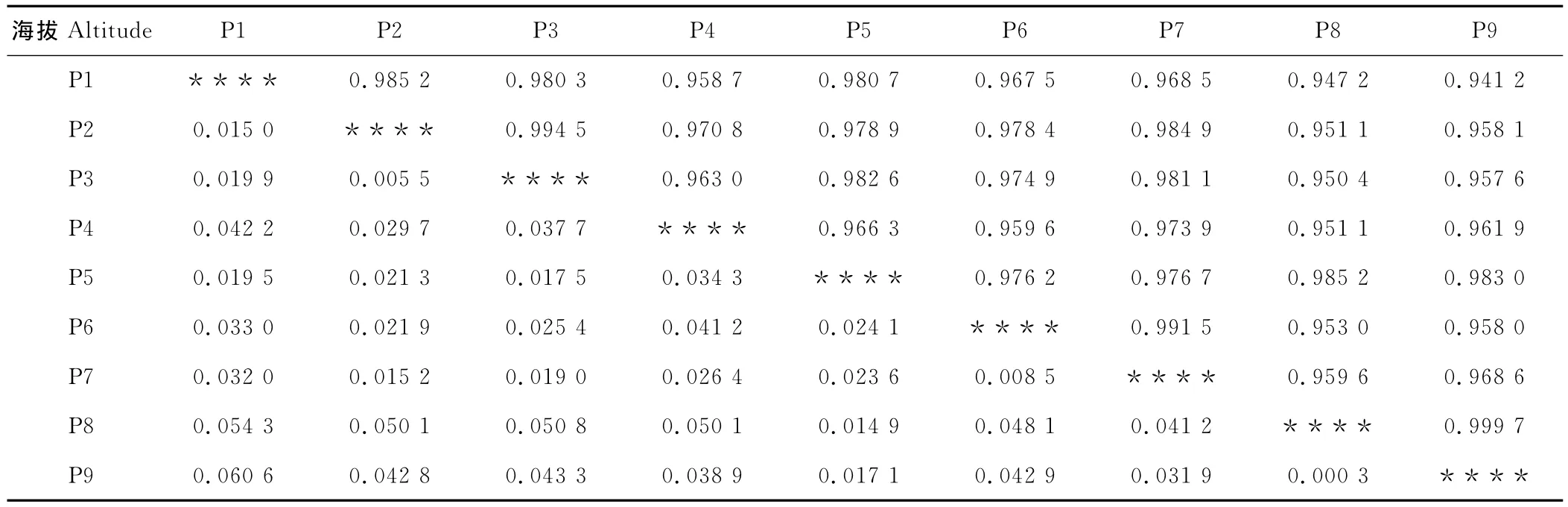
表5 不同海拔梯度山生柳遗传一致度和遗传距离Table 5 Genetic identity and distance between different altitude of S.oritrepha
2.4 山生柳9个不同海拔的聚类分析
根据种群间的遗传距离,采用类平均法(UPGMA)对9个种群进行聚类绘图(图4),大体分为3类群,P2首先和P3相聚,再与P1,P5相聚为一类。P6和P7相聚再与P4聚为第2类群,最后P8与P9聚为第3类群。Mantel检验结果表明,遗传距离与空间地理距离有显著相关性。
3 结论与讨论
3.1 杨柳引物扩增的通用性
在SSR标记中多态性非常高,信息量丰富,而引物的变异度大,只要开发出合适的特异引物,检测分析就变得简单易行,因而SSR标记在遗传多样性分析中有很高的应用价值[17,18]。但SSR标记两端序列保守,所以设计的引物必须考虑与两端保守序列互补[19],这使SSR标记的进行有一定的困难[20]。现有的SSR标记数量有限,所以不能标记所有的功能基因,为了对某种植物进行SSR标记,就必须设立与该植物或相近物种的特定引物[21]。杨树作为林木中的优势树种,成为第3个完成基因组测序的物种,所以其SSR引物应充分被利用。本实验中通过杨柳引物通用性的探究,不仅可以有效弥补柳树分子标记不足的现状,替代在柳树中重新开发标记,节约引物开发成本,而且丰富其标记的数量。今后可在柳树SSR实验上采用杨属引物,从而节省时间和成本。尤其本实验中引物SHUKl23、SHUKl24、SHUK034的多态性比率达到了100%,充分证明了杨柳引物的通用性很好。
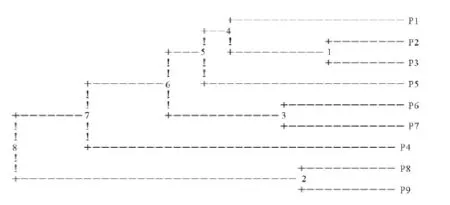
图4 甘肃祁连山9个海拔梯度山生柳种群的遗传聚类图Fig.4 Dendrogram of nine latitudes of Gansu S.oritrepha
3.2 山生柳不同海拔居群的遗传分化
通过SSR实验结果显示山生柳具有较高的遗传多样性,多态性条带比率在50%以上被认为遗传多样性是丰富的[22]。表明该物种还未产生自交衰退现象。当种群Nm>1时,存在一定的基因漂流,它能足以抵制遗传漂变导致群居间的遗传分化。在本试验中,Wright[23]认为当Nm=4.8487>1,属于较高水平,说明不同居群间存在一定的基因流动,可以防止由遗传漂变引起的亚种群之间的遗传分化,其可能为:1)山生柳具有有性繁殖与无性繁殖的双重性,北方风沙大,花粉与种子可以随处传播。2)其种群有着一定的克隆生长,一定年龄的基株(个体)可形成多个克隆分株,进而构成高寒灌丛平。根据结果显示随着海拔梯度的升高,山生柳的遗传多样性有所增大,这可能与一定的气候,温度相关联。
在群落中,由于生境梯度与物种的生物学特征的不同,经常会出现:1)群落中物种交错重叠,呈现极为复杂的关系。2)群落中物种相互不发生交错关系,呈现明显的分布界限。3)群落中某一个或几个物种生态适应性较宽一些,但是其他物种(或类型)由于生境梯度的急剧变化,而被严格限制在某种生境中[24]。在聚类图4中出现了一定情况的交错现象,说明在一定海拔处呈现出明显的生态交错区。保护现存自然种群以保存尽可能多的遗传多样性是适宜的保护措施[25],生境适宜促进物种进化,有利于物种长期生存发展,从另一方面证明山生柳对高寒气候的适应性很强,这也是本试验在不同海拔对山生柳遗传多样性进行探究的目的所在。根据计算得到的不同海拔梯度 Ht=0.282 2,Hs=0.255 8,Gst在0.046 4~0.253 9,平均为0.093 5,即4.64%~25.39%的遗传变异存在于居群间,74.76%~95.26%的遗传变异存在于居群内。山生柳以有性繁殖为主,但是,由于山生柳分布于寒带气候如:高山、亚高山、山地寒温针叶林带和冰雪带之间,具有长期积雪、风大、低温、干燥等气候特点。因此,在恶劣的环境下,山生柳有性繁殖受到极大限制,因而主要依靠无性繁殖来维持其稳定。
山生柳聚类分析结果与形态学观察特征基本一致,即说明了遗传本质差异对外部形态特征的对应反应[26]。从另一方面证实SSR标记稳定可靠,可以利用标记进行物种的遗传多样性的分析。在祁连山脉随着海拔的升高呈现出锦鸡儿和山生柳丛生的情况,个体数较多也有利于传粉和繁殖,干扰少从而资源保护很好,山生柳自身在恶劣的环境下积累了较多的遗传变异,以适应各种环境变异,例如随着海拔的升高山生柳叶片蜡质增多,叶片变小而厚等。上述结果均表明,群体分布的海拔和纬度差异,一定程度上造成了天然山生柳的分化。同时在本次研究中,也存在一定的限制性因素,由于取样范围有限,今后的研究中应扩大采集样地,如甘肃省的山丹、苏南、榆中、青海和四川[27],力求进一步揭示山生柳种群生态学特征及其遗传多样性。
结合本研究的结果建议从以下几方面对山生柳资源进行保护:1)就地保护好现有资源,禁止破坏生境,防止过度的放牧导致山生柳锐减,维护好小环境,建立自然保护区,对山生柳进行监护。2)今后扩大采样范围,从分子方面探讨山生柳遗传漂变对其分布的影响。进一步揭示山生柳的遗传多样性。3)利用组织培养和扦插繁殖扩大其栽培面积,最大效益的实现其经济,生态价值。
[1] Rafalski J A.Vogel J M,Morgante M,et al.Generating and using DNA markers in plants[A].Birren B,Lai E.Nonmarnmalian Genomic Analysis.A Practical Guide[C].San Diego:Academic Press,1996:75-134.
[2] Martin B,Friedrich U H,Melchinger A E.Genetics similarities among winter wheat cultivars determined on the basis of PFLPs,AFLPS and SSRS and their use for predicting progeny variance[J].Crop Science,1999,39(3):228-237.
[3] Powell W,Morgante M,Andre C,et al,The compassion of RFLP,RAPD,AFLP and SSR (microsatellite)markers for germplasm analysis[J].Molecular Breeding,1996,5(2):225-238.
[4] 车永和,李洪杰,杨艳萍,等.沙生冰草遗传多样性的SSR分析[J].麦类作物学报,2008,28(1):35-40.
[5] 魏臻武.利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱[J].草业学报,2005,13(3):62-67.
[6] 王印肖,徐秀琴,韩宏伟.分子标记在品种鉴定中的应用及前景[J].河北林业科技,2006,9(2):46-49.
[7] Kijas J M H,Fowler J C S,Thmas M R.An evaluation of sequence tagged microsatellite site markers for genetic analysis within cirtrus and related species[J].Genome,1995,38(2):349-355.
[8] Szewc MoFadden,kresvich A S,Bliek S M,et al.Identification of polymorphic,conserved simple sequence repeats(SSR)in cultivated Brassicaspecies[J].Theoretical Applied Genetics,1996,93(4):534-538.
[9] 王芳,陈文业,才让卓玛,等.高寒区山生柳硬枝扦插灰色系统理论分析研究[J].草业科学,2010,27(9):86-90.
[10] 吴海艳,马玉寿,王彦龙,等.黄河源区山生柳灌丛草甸植物群落多样性及植物量组成[J].草业科学,2008,25(5):55-59.
[11] 李毅,胡自治,王志泰.东祁连山高寒地区山生柳种群分布格局研究[J].草业学报,2002,11(3):49-54.
[12] 王志泰.东祁连山高寒阴湿地区山生柳种群年龄结构和空间分布格局[D].兰州:甘肃农业大学,2001
[13] 常宏,王汉宁,张金文,等.玉米品种真实性和纯度鉴定的SSR标记多重PCR体系优化[J].草业学报,2010,19(2):204-211.
[14] 何庆元,吴萍,张晓红,等.不同秋眠性苜蓿SRAP体系优化及遗传多样性分析[J].草业学报,2011,20(2):201-209.
[15] 贺欣,刘国道,刘迪秋,等.利用ACGM和EST-SSR标记对云贵高原野生山蚂蝗属种质的遗传多样性分析[J].草业学报,2008,17(6):102-111.
[16] 乔岩,王汉宁,张成,等.玉米胚乳突变基因ae连锁累赘的SSR分析[J].草业学报,2011,20(1):140-147.
[17] 高志红,章镇,韩振海.SSR技术及其在果树上的应用[J].果树学报,2002,19(5):281-285.
[18] 王红梅,张正英,陈玉梁.SSR标记技术及其在植物遗传学中的应用[J].西北师范大学学报,2003,18(1):113-116.
[19] 张立荣,徐大庆,刘大群.SSR和ISSR分子标记及其在植物遗传育种研究中的应用[J].河北农业大学学报,2002,25(1):91-94.
[20] 郭军,寿森炎,卢钢,等.DNA分子标记技术在品种鉴定和纯度分析上的应用[J].种子科技,2000,19(5):218-219.
[21] Liu Y,Chen H Y,Wei Y T,et al.Construction of a genetic map and localization of QTLs for yield traits in tomato by SSR markers[J].Progress in Natura Science,2005,15(9):793-797.
[22] 张颖娟,高瑞霞,李青丰.不同干扰生境中荒漠小灌木红砂种群遗传多样性研究[J].干旱区资源与环境,2008,22(30):147-151.
[23] Wright S.The shifting balance theory and macroevolution[J].Annual Review of Genetics,1982,16(1):1-19.
[24] 张妙青,王彦荣,张吉宇,等.垂穗披碱草种质资源繁殖相关特性遗传多样性研究[J].草业学报,2011,20(3):182-191.
[25] 谢文刚,张新全,马啸,等.中国西南区鸭茅种质遗传变异的SSR分析[J].草业学报,2009,18(4):138-146.
[26] 王普昶,赵丽丽,易津,等.内蒙古野生华北驼绒藜种群遗传多样性和遗传分化研究[J].草业学报,2011,20(4):287-292.
[27] 冯自诚,徐梦龙.甘南树木图志[M].兰州:甘肃科学技术出版社,1993.
