五节芒表型性状和SSR标记遗传多样性分析
2012-08-20薛德肖亮艾辛邓念丹蒋建雄覃静萍陈智勇刘树玲易自力
薛德,肖亮,艾辛,邓念丹,蒋建雄,覃静萍,陈智勇,刘树玲,易自力
(湖南农业大学生物科学与技术学院,湖南 长沙410128)
五节芒(Miscanthus floridulus)系禾本科(Poaceae)芒属(Miscanthus)的一个主要种,主要分布于亚洲东南部太平洋诸岛至波利尼西亚等地区,在中国大陆主要分布于安徽、湖北、贵州、福建、江苏、广东、广西、江西、湖南、海南等省[1]。早期关于五节芒的研究,主要集中在形态学分类、生物学和生态学特性、细胞学特征及生产应用[1-12]等方面,近年来,由于五节芒具有生物质产量高、燃烧充分、灰分低等特性被认为极具开发潜力的能源植物而引起全世界广泛的关注[2]。作为能源植物资源,五节芒遗传多样性研究是其开发和利用的基础。近期已有一些关于五节芒遗传多样性方面的研究结果发表,但仅限于利用分子标记对局部地区五节芒进行遗传多样性分析[13,14]。五节芒在自然界分布广、易杂交,造成其遗传背景复杂,利用不同标记对全国范围内的五节芒进行遗传多样性评价,有利于更准确地揭示其遗传变异情况。因此,本研究利用表型性状结合SSR分子标记对采自中国各地的53份五节芒种质资源的遗传多样性进行评价,以揭示五节芒种群中的遗传变异度,为五节芒种质资源的合理保护和利用提供理论依据。
1 材料与方法
1.1 供试材料
本项目组曾对中国的五节芒野生种质资源的分布状况进行了系统的调查,并从不同地区收集了202份五节芒种质资源,保存在湖南农业大学芒属植物种质资源圃内,并于2008年至2010年进行了3个年份的表型性状测量。本研究从中选取53份材料进行表型性状和SSR标记遗传多样性研究。在SSR标记分析中加入2份南荻(M.lutarioriparius)和2份芒(M.sinensis)等近缘种作为外类群,供试材料见表1。
1.2 表型性状调查与分析
表型性状调查和数据采集方法参考《牧草种质资源描述规范和数据标准》[15]进行,每份材料随机取5个单株进行测量,共测量25个表型性状。包括株高(plant height)、旗叶长(flag leaf length)、旗叶宽(flag leaf width)、最大叶长(largest leaf length)、最大叶宽(largest leaf width)、叶片数(leaf number per tiller)、节数(node number per tiller)、第1节宽边直径(first node long axis)、第1节窄边直径(first node short axis)、单茎干重(dry weight per tiller)、含水量(moisture content)、花序长(panicle length)、主轴长(panicle main axis length)、一级花序数(first-class branch number of panicle)、二级花序数(second-class branch number of panicle)、三级花序数(thirdclass branch number of panicle)、芒长(awn length)、基盘毛长(callus hair length)、颖长(grain length)、颖宽(grain width)、分蘖数(stem number per plant)、整株干重(dry weight per plant)、基部周长(basal circumference)、出苗-始花天数(days to 10%flowering)、出苗-种子成熟天数(days to seed maturity)。

表1 供试材料Table 1 Plant materials for this study

续表1 Continued
1.3 SSR分子标记分析
1.3.1 总DNA提取 提取基因组总DNA所取材料均为刚长出的幼叶,采用改良CTAB法制备模板DNA,琼脂糖凝胶电泳检测其质量和浓度,并稀释到20ng/μL,冷藏备用。
1.3.2 PCR扩增 本研究中选用了33对玉米(Zeamays)SSR引物和甘蔗(Saccharumofficinarum)ESTSSR引物,其中玉米SSR引物为Sigma-Aldrich产品(St.Louis,MO USA),而甘蔗EST-SSR引物序列由美国Illinois大学Erik Sacks博士提供,由北京奥科生物技术有限公司合成(表2)。PCR扩增在Biometra Tgradient PCR仪上进行。SSR-PCR反应体系为15μL,含有10×PCR buffer 1.5μL、25mmol/L MgCl21.5μL、Primer 1.2μL、10mmol/L dNTPs 0.3μL、20ng/μL模板 DNA 2μL、5U/μL Taq酶0.1μL。以上试剂均购自广州东盛生物技术有限公司。PCR反应条件为:94℃预变性5min;94℃变性1min,52~62℃退火30s,72℃延伸1min,35个循环;72℃延伸7min。PCR产物经12%非变性聚丙烯酰胺凝胶电泳,银染显色后拍照。
1.4 数据处理
采用SPSS 18.0软件进行表型性状数据的方差分析、主成分分析(PCA)和聚类分析(UPGMA)。将SSR标记清晰可辨的电泳条带用于统计分析,在相同迁移率上,有扩增带的赋值为1,无扩增带的赋值为0。统计SSR扩增的条带总数和多态性条带数,计算多态性位点百分率(PPB,percentage of polymorphic bands),其中,PPB=NPB/TNB,式中,NPB指多态性条带数(NPB,number of polymorphic bands),TNB指扩增总条带数 (TNB,total number of bands)。采用 POPGENE version 1.31软件计算 Shannon指数(I,Shannon’s information index,Lewontin[1972])、基因多样性指数(H,Nei’s[1973]gene diversity)、有效等位基因数(Ne,effective number of alleles),并计算引物多态性信息含量(PIC,polymorphism information content)。利用 NTSYS pc 2.1软件计算SSR的遗传相似系数,并利用UPGMA法进行聚类分析,绘制树状聚类图。
2 结果与分析
2.1 表型性状分析
2.1.1 表型性状变异分析 对五节芒种质资源的25个表型性状进行统计分析结果表明(表3),性状间变异系数的平均值为32.61±18.11,变化范围为6.53(苗-种子成熟)~69.82(整株干重)。其中,变异幅度较大且变异系数在60%以上的性状有3个:整株干重(69.82%)、三级花序数(65.78%)、二级花序数(64.76%)。25个表型性状中整株干重变异最大,说明五节芒在生物质产量上存在较大变异。三级花序数和二级花序数变化次之,说明五节芒花序分枝数适合作为一项分类依据来区分种内不同种质。25个表型性状中变异系数最小的3个为:含水量(10.46%)、出苗至开花天数(6.98%)和出苗至种子成熟天数(6.53%)。五节芒含水量平均值达到54.59%,且种群内变化幅度较小,印证了五节芒是宿根型常绿草本的生物特性。不同采集地纬度差别较大的五节芒野生种质被移栽到同一地点后,通过观察发现它们的生育期基本保持一致,集中在每年6、7月份开花。这一现象说明五节芒不易受光温等环境因素的影响,为人工杂交育种提供了便利。除此之外,与产量密切相关的性状如分蘖数(55.01%)、单茎干重(46.67%)和基盘周长(46.61%)也是变化较大的性状,这些性状的变化幅度大说明五节芒的产量及其产量构成因子的可塑性强,通过杂交育种和合理的栽培管理措施能达到理想的选择效果。

表3 五节芒种质资源表型特征及变异Table 3 Morphological characteristics and variations in accession of M.floridulus
2.1.2 基于表型性状的主成分分析与聚类分析 主成分分析表明(表4)特征值大于1的前7个主成分的累计贡献率为74.908%。其中,第1主成分独立贡献率为13.909%,因子载荷最大的性状是第1节宽边直径(0.890)和第1节窄边直径(0.885);第2主成分独立贡献为12.710%,因子载荷最大的性状是单株干重(0.872)、分蘖数(0.845)和基部周长(0.775)。第3主成分独立贡献率12.538%,因子载荷最大的性状为三级花序数(0.829)、二级花序数(0.816)和一级花序数(0.759);第4主成分独立贡献率10.881%,因子载荷最大的性状为花序长(0.846)和主轴长(0.788);第5主成分独立贡献率为9.244%,因子载荷最大的性状是旗叶长(0.864)和旗叶宽(0.717);第6主成分独立贡献率为9.083%,因子载荷最大的性状是基盘毛长(0.792)、芒长(0.761)、颖长(0.609)和颖宽(0.555);第7主成分独立贡献率为6.544%,因子载荷最大性状仅含水量(-0.825)。这7个主成分中,第1主成分由茎粗性状解释,第2主成分由产量及其构成因子解释,第3主成分由花序性状解释,第4主成分由生育期性状解释,第5主成分由旗叶性状解释,第6主成分由小穗性状解释,第7主成分由含水量解释。前3主成分解释力最高,包括产量构成因素及花序形态两类性状,与性状变异系数所反映的情况基本吻合。
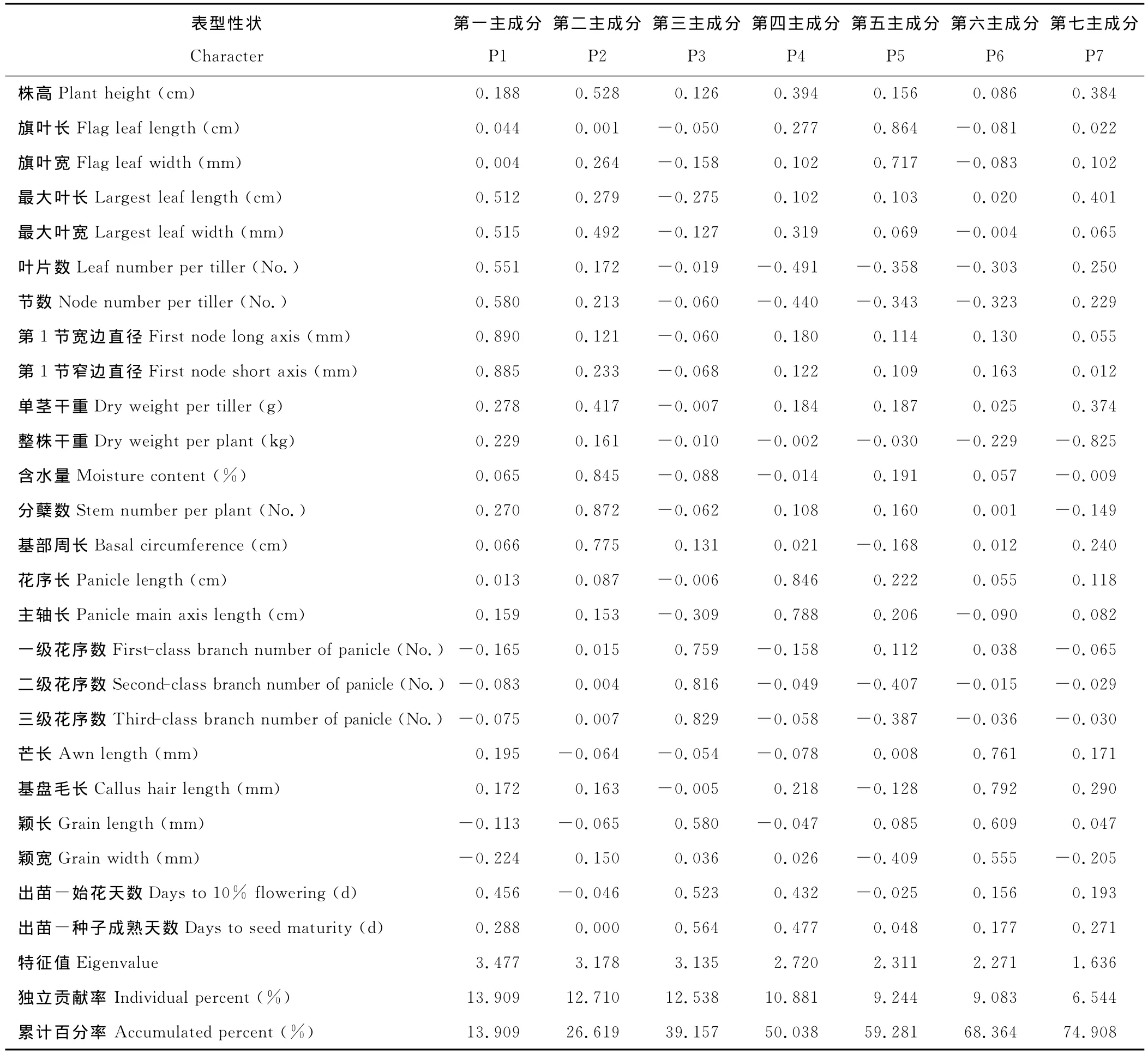
表4 五节芒表型性状前7个主成分的特征量和贡献率Table 4 The component scores coefficient matrix,eigenvalue and contributive percentage of principal of M.floridulus

图1 53份五节芒表型性状的聚类分析Fig.1 Dendrogram of 53 M.floridulus derived by UPGMA from the phenotype data
基于表型性状的聚类结果(图1)表明,53份五节芒可划分为3大类群:第Ⅰ聚类组只有1份材料,出苗-开花天数为117d,属于迟花类型,无2级以上花序,花序持久小穗部分易脱落;第Ⅱ聚类组包括6份材料,出苗-开花天数在91~100d,属于中花类型,2级以上花序数少,花序能持久但小穗易脱落;第Ⅲ聚类组包括46份材料,其出苗-开花的天数为85~90d,属于早花类型,花序形态为2级以上花序数多,花序易断小穗易脱落。
2.2 SSR标记分析
2.2.1 SSR标记的多态性分析 33对SSR引物对53份五节芒进行PCR扩增,部分材料的扩增图谱如图2所示,其中26对引物具有多态性。26对SSR引物扩增结果见表5。26对SSR引物共扩增出81条DNA带,平均每对引物扩增3.12条DNA带,各引物扩增出的条带数在1~8。多态性条带74条,平均每对引物2.85条,引物的平均多态性比率(PPB)为91.36%。不同的引物所揭示的供试材料的多态性信息含量(PIC)范围为0.086~0.374,平均为0.245。结果表明SSR分子标记在五节芒中具有良好的多态性,可以用于五节芒种质间遗传多样性分析。各引物所解释的遗传多样性存在一定的差异,53份五节芒遗传多样性指数在0.061 1~0.491 2,平均为0.258 7,有效等位基因数在1.064 8~1.965 4,平均为1.417 2,Shannon信息指数为0.126 6~0.684 3,平均为0.400 4,表明53份五节芒间遗传分化丰富(表5)。
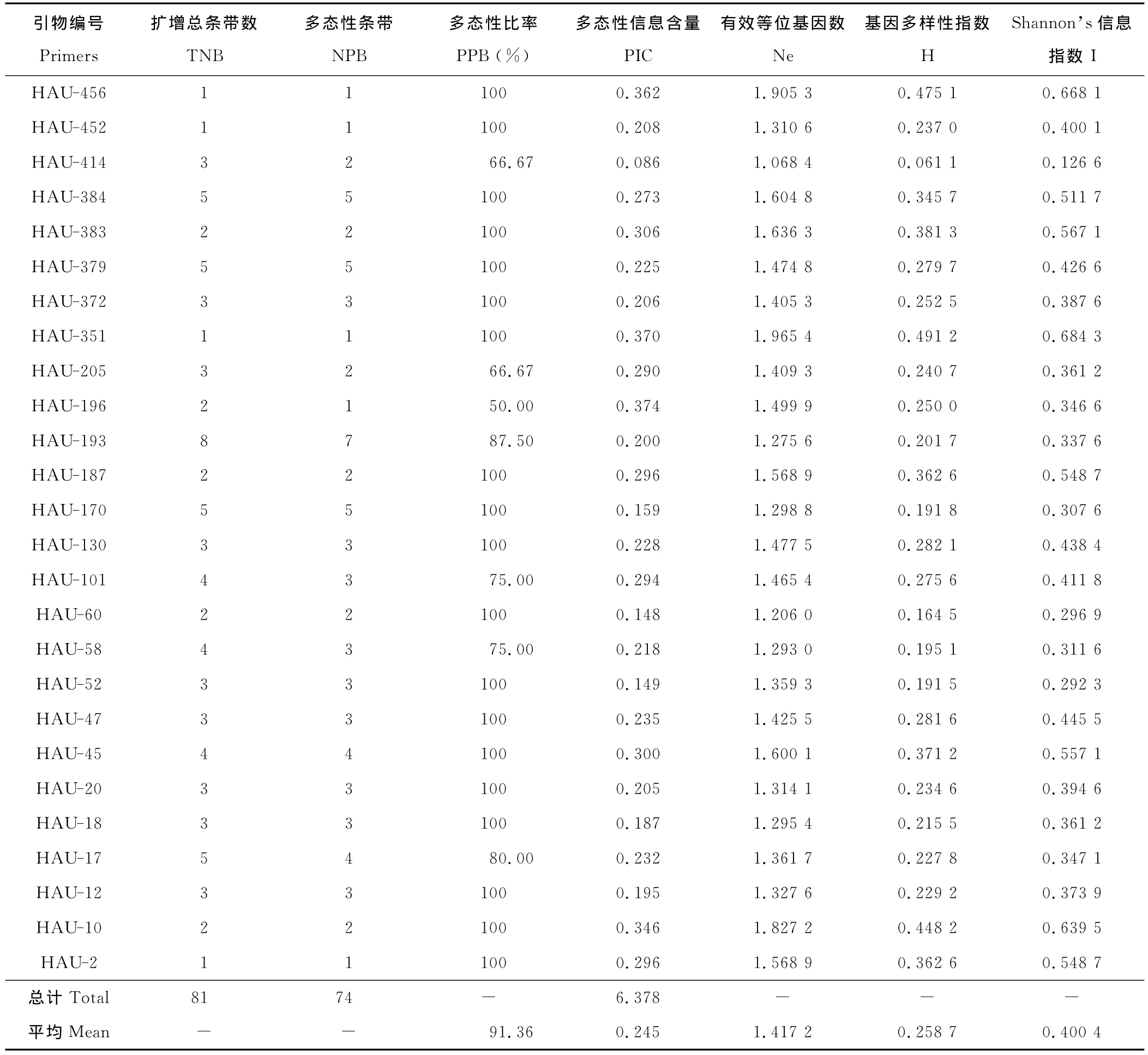
表5 SSR引物的多态性Table 5 The polymorphism of SSR primers
2.2.2 基于SSR标记的遗传相似性和聚类分析 对扩增结果,计算其相似性系数和遗传距离。结果表明,53份五节芒遗传相似性系数为0.693 2~0.965 9,变幅为0.272 7,其遗传距离为0.030 1~0.303 9,变幅为0.273 8。其中,采自贵州雷山(7、8)2份材料之间的遗传相似性系数最大(0.965 9),其遗传距离最近(0.030 1),表明这2份材料亲缘关系很近;采自江西南昌(33)与采自安徽金寨(43),相似性系数最小(0.693 2),其遗传距离最远(0.303 9),表明这2份材料之间亲缘关系较远。分析结果表明,供试53份五节芒之间差异明显,具有相对较远的亲缘关系。
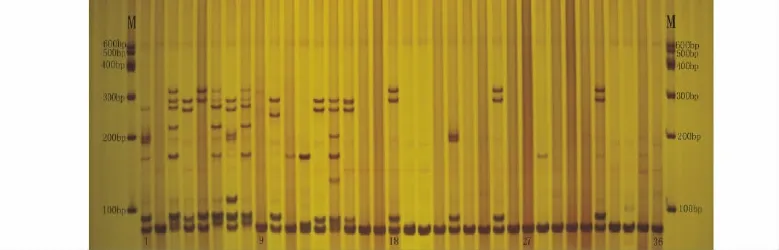
图2 HAU-12扩增产物部分电泳图Fig.2 An amplification profile using SSR primer pair HAU-12

图3 53份五节芒SSR标记的UPGMA聚类分析Fig.3 Dendrogram of 53 M.floridulus derived by UPGMA from SSR marker
2.2.3 基于SSR标记的聚类分析 基于遗传相似性系数,利用UPGMA法(非加权类平均法)构建了53份五节芒材料间的聚类图(图3)。在相似性系数为0.79的水平上,可将供试材料分为8个聚类组。其中,第Ⅰ、Ⅱ聚类组分别为2份南荻和2份芒,为外类群。第Ⅲ聚类组有2份材料,分别采自江西修水(9)和安徽金寨(43)。第Ⅳ聚类组中包括2份材料,分别采自福建宁德(47)和安徽繁昌(39)。第Ⅴ聚类组中包括3份材料,分别采自浙江洞头(6)、福建福安(49)和浙江金溪(53)。第Ⅵ聚类组中只有1份材料,采自安徽金寨(42)。第Ⅶ聚类组中包括2份材料,分别采自广西贺州(2)和湖南郴州(20)。其余的43份材料聚为第Ⅷ聚类组。对第Ⅷ聚类组的43份材料进行分析,在相似性系数为0.84的水平上,43份材料可分为6个亚组。A亚组中共有5份材料,其中3份采自湖南(11、19、32),1份采自广西(1),1份采自江苏(19)。B亚组中包括15份材料,其中3份采自贵州(5、7、8),3份采自广西(24、29、27),2份采自广东(41、40),2份采自福建(46、51),2份采自湖北(45、48),2份采自江西(31、33),1份采自浙江(4)。C亚组中包括10份材料,其中5份采自湖南(10、25、21、12、14),3份采自江苏(15、16、17),1份采自福建(52),1份采自安徽(44)。D亚组中只有1份材料,采自湖北黄石(30)。E亚组包括8份材料,其中2份采自广西(3、28),2份采自福建(38、50),3份采自广东(34、37、36),1份采自湖北(35)。F亚组包括4份材料,其中3份采自江西(13、22、26),1份采自陕西(23)。聚类结果显示,不同地区的材料具有一定的相似性,聚为一组。相同地理来源的材料遗传变异较大,供试材料与其最初的地理来源及地理分布并不存在明显的相关性。
3 讨论
本研究利用表型性状和SSR标记研究了53份五节芒的遗传多样性。结果表明,这53份五节芒在表型性状水平和DNA分子水平上均具有丰富的遗传多样性。表型性状是基因和环境共同作用的结果,本研究将不同地理来源的五节芒种植于同一地点(湖南农业大学芒属植物种质资源圃),使其生长在相同生境下,消除环境饰变的影响,以了解由基因决定的表型性状的变异情况。但基于表型性状数据的聚类结果与SSR标记聚类结果并不完全一致。造成这一结果的原因可能是:1)表型性状的检测水平有限,特别是一些数量性状呈连续变化,很难将不同的材料分类。2)表型性状包括形态性状、生理性状、生殖性状等方面,范围十分广泛,本研究所选取的25个表型性状,只能在一定程度上揭示其表型多样性。3)本研究所选SSR引物并不能揭示整个基因组的变异情况,且有些发生在DNA水平的变异不一定造成表型性状的改变,比如内含子的变异。53份五节芒遗传相似性系数在0.693 2~0.965 9,遗传多样性指数 H=0.258 7,Shannon信息指数I=0.400 4。结果表明,SSR分子标记可用于五节芒遗传多样性分析,53份五节芒在DNA水平上具有丰富的遗传多样性。
SSR分子标记因其具有大量的等位差异,多态性十分丰富,目前已广泛应用于多种植物的遗传多样性研究中[16-22]。而且SSR标记具有一定的通用性,Peakall等[23]研究了31对大豆(Glycine max)SSR 引物在属内和属间的通用性,结果表明SSR引物通用性仅限于属内种间和亲缘关系较近的属间。本研究中所选33对玉米和甘蔗SSR引物中有26对在五节芒中有多态性。26对多态性引物共扩增81条DNA带,平均每对引物扩增3.12条DNA带,其中多态性条带74条,多态性比率为91.36%,多态性信息含量(PIC)范围为0.086~0.374,平均为0.245。表明玉米和甘蔗SSR引物在五节芒中有较高的通用性。
刁英等[13]曾对ISSR和SRAP两种分子标记在五节芒中的分析效率进行了研究,两种标记的遗传多样性指数、Shannon信息指数、多态条带比率分别是0.297 4、0.452 5、95.15%和0.186 6、0.301 8、84.97%。吴安迪等[14],刁英等[13]均利用ISSR分子标记分别对五节芒进行分析,获得的五节芒遗传相似性系数分别为0.467 3~0.831 8和0.67~0.95。以上结果表明,如果供试材料不同或者所用遗传标记不同,所获得的五节芒遗传多样性的结论会存在一定的差异。因此,为更准确地了解五节芒的遗传变异情况,应用不同的遗传标记对五节芒进行分析是有必要的。
[1] Chen S L,Renvoize S A.Miscanthus Andersson.Flora of China(Vol.22)[M].Beijing:Science Press,and St.Louis:Missouri Botanical Garden Press,2006:581-583.
[2] 宁祖林,陈慧娟,王珠娜,等.几种禾本热值和灰分动态变化研究[J].草业学报,2010,19(2):241-247.
[3] 陈慧娟,张卓文,宁祖林,等.施肥对五节芒热值和表型性状的影响[J].草业科学,2009,26(8):63-67.
[4] 陈少风,何俊,周朴华,等.芒和五节芒的核型研究[J].江西农业大学学报,2008,30(1):123-126.
[5] 秦建桥,夏北成,赵鹏.五节芒不同种群对Cd污染胁迫的光合生理响应[J].生态学报,2010,30(2):288-299.
[6] 迟光宇,刘新会,刘素红,等.大坞河流域重金属污染与五节芒光谱效应关系研究[J].生态环境,2005,14(4):549-554.
[7] 王江,张崇邦,常杰等.五节芒对重金属污染土壤微生物生物量和呼吸的影响[J].应用生态学报,2008,19(8):1835-1840.
[8] 张崇邦,王江,王美丽.尾矿砂堆积地五节芒自然定居对土壤微生物生物量、呼吸速率及酶活性的影响[J].植物营养与肥料学报,2009,15(2):386-394.
[9] 张崇邦,王江,柯世省,等.五节芒定居对尾矿砂重金属形态、微生物群落功能及多样性的影响[J].植物生态学报,2009,33(4):629-637.
[10] 萧运峰,高洁.五节芒的分化类型及生产性状的比较研究[J].四川草原,1998,(1):21-23.
[11] 丁明辉.五节芒栽培茶薪菇试验[J].食用菌,2009,(1):24.
[12] 刘叶高.五节芒栽培杏鲍菇等三种珍稀食用菌试验研究[J].现代园艺,2006,(7):4-5.
[13] 刁英,胡小虎,郑兴飞,等.利用SRAP和ISSR标记分析五节芒(Miscanthus floridulus)的遗传多样性[J].武汉大学学报,2010,56(5):578-583.
[14] 吴安迪,黄小龙,黄东益.利用ISSR标记分析海南岛五节芒的遗传多样性[J].中国农学通报,2011,27(24):93-97.
[15] 李志勇,王宗礼,师文贵,等.牧草种质资源描述规范和数据标准[M].北京:中国农业出版社,2005:9-38.
[16] 徐雁鸿,关建平,宗绪晓.豇豆种植资源SSR标记遗传多样性分析[J].作物学报,2007,33(7):1206-1209.
[17] Dikshit H K,Jiang T,Singh N K,et al.Genetic differantiation of Vigna species by RAPD,URP and SSR makers[J].Biologia Plantarum,2007,51(3):451-457.
[18] Ren F G,Lu B R,Li S Q,et al.A comparative study of genetic relationships among the AA-genome Oryzaspecies using RAPD and SSR makers[J].Theoretical and Applied Genetics,2003,108:113-120.
[19] Huang K H,Chiang T Y,Chiu C T,et al.Isolation and characterization of microsatellite loci from a potential biofuel plant Miscanthus sinensis (Poaceae)[J].Conservation Genetics,2009,10:1377-1380.
[20] Ma K H,Kim N S,Lee G A,et al.Development of SSR markers for studies of diversity in the genus Fagopyrum[J].Theoretical and Applied Genetics,2009,119:1247-1254.
[21] 鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析[J].草业学报,2010,19(4):122-134.
[22] 陈永霞,张新全,谢文刚,等.利用EST-SSR标记分析西南扁穗牛鞭草种质的遗传多样性[J].草业学报,2011,20(6):245-253.
[23] Peakall R,Gilmore S,Keys W,et al.Cross-species amplication of soybean(Glycine max)simple sequence repeats(SSRs)within the genus and otherlegume genera-implications for the transferability of SSRs inplants[J].Molecular Biology and Evolution,1998,15(10):1275-1287.
