Bmi-1和hTERT与乳腺癌发生发展的关系
2012-08-20吉巧红冯艳铭张朝晖徐正顺李惠翔吕新全
吉巧红,冯艳铭,张朝晖,徐正顺*,李惠翔,吕新全
(1.河南科技大学医学院 病理学与病理生理学教研室,河南 洛阳 471003;2.郑州大学基础医学院 病理学教研室,河南 郑州 450052)
Bmi-1和hTERT与乳腺癌发生发展的关系
吉巧红1,冯艳铭1,张朝晖1,徐正顺1*,李惠翔2,吕新全2
(1.河南科技大学医学院 病理学与病理生理学教研室,河南 洛阳 471003;2.郑州大学基础医学院 病理学教研室,河南 郑州 450052)
目的 探讨Bmi-1、hTERT mRNA和蛋白在人乳腺癌发生发展中的作用及其相互之间存在的关系。方法采用免疫组化方法及RT-PCR技术,分别检测56例乳腺浸润性导管癌、35例乳腺纤维腺瘤及30例正常乳腺组织中Bmi-1、hTERT mRNA及蛋白的表达情况。结果Bmi-1、hTERT mRNA和蛋白在乳腺癌组织中的表达明显高于其在乳腺纤维腺瘤及正常乳腺组织中的表达,三组间比较存在显著性差异(P<0.05)。Bmi-1和hTERT在乳腺癌中的表达呈显著性正相关(P<0.05)。结论Bmi-1、hTERT mRNA及蛋白高表达与乳腺癌的恶变演进有关。Bmi-1基因调控hTERT基因的表达,在乳腺癌的发病过程中可能有重要意义。Bmi-1、hTERT表达水平的联合检测有助于乳腺癌的早期诊断及鉴别诊断,值得进一步研究。
乳腺肿瘤;Bmi-1;hTERT;免疫组化;RT-PCR
Bmi-1基因是多梳基因(Polycomb group genes,Pcg)家族成员,其通过多种途径参与细胞调控,在部分恶性肿瘤包括白血病及淋巴瘤、结肠癌及乳腺癌中均有 Bmi-1高表达[1,2]。端粒酶的激活与细胞永生化及肿瘤发生有关[3];而端粒酶催化亚单位(hTERT)可能在端粒酶活性调节中起着重要作用[4]。目前研究发现Bmi-l的过度表达对激活hTERT的表达可能起关键作用。本研究旨在通过检测乳腺癌、乳腺纤维腺瘤及乳腺正常组织中Bmi-1和hTERT的mRNA及蛋白的表达,探讨Bmi-1与hTERT的关系及在乳腺癌发生发展中的可能作用。
1 材料与方法
1.1 材料选择郑州大学第一附属医院2008年5月-2009年7月外科手术切除的乳腺组织标本121例,患者均为女性,临床资料完整。其中56例乳腺癌患者,病理诊断均为乳腺浸润性导管癌(IDC),年龄30岁-77岁,平均59.2±12.9岁;同时收集乳腺纤维腺瘤35例;正常乳腺组织30例。所有病例术前均无化疗、放疗及免疫治疗史。
1.2 主要试剂鼠抗人Bmi-1单克隆抗体购自美国upstate公司;鼠抗人hTERT单克隆抗体购自美国Epitomics公司;SP免疫组化试剂盒购自北京中杉公司;Bmi-1、hTERT引物由上海生工生物工程公司合成,引物序列:Bmi-1(221bp):上游引物为:5’-TCATCCTTCTGCTGATGCTG-3’,下游引物为:5’-GCATCACAGTCATTGCTGCT-3’;hTERT (176 bp):上游引物为:5’-TCTGGGAGTGACAAGG-3’,下游引物为:5’-AATTAACGTCCATAGGAG -3’。
1.3 RT-PCR检测用Trizol试剂方法抽提标本总RNA。样品经琼脂糖凝胶电泳判断提取的总RNA的质量,测定其纯度及完整性。Bmi-1mRNA扩增条件:94℃预变性5min,然后94℃30s,57℃30 s,72℃40s,共30次循环,再94℃延伸5min,置4℃保存。hTERT mRNA扩增条件:95℃预变性5 min,95℃变性10s,50℃30s,72℃40s,40个循环,再95℃下延伸5min,置4℃保存。阴性对照用去离子水取代总RNA。
1.4 免疫组化染色及结果判断采用免疫组化SP法,操作严格按试剂盒说明书进行。分别行Bmi-1蛋白、hTERT蛋白免疫组化染色。每批染色均设置已知阳性对照,阴性对照用PBS替代一抗。结果判断:Bmi-1、hTERT蛋白以细胞核内呈现棕黄色或者棕褐色颗粒,也有少量胞浆内呈现棕黄色颗粒为阳性判断标准。参照Song等[5]的评分方法,高倍镜下随机取4个不同的视野,按阳性细胞所占的百分比计分:①≤10%为1分;②>10%且≤50%为2分;③>50%且≤75%为3分;④>75%为4分;同时,根据染色的强弱程度计分:①阴性染色1分;②弱染色2分;③中等强度染色3分;④强染色4分;根据二者乘积判断结果:≤4为(-);>4且≤8为(+);>8且≤12为(++);>12且≤16为(+++)。统计分析时(-)和(+)合计为阴性或弱阳性表达,(++)和(+++)合计为强阳性表达。
1.5 统计学分析数据处理采用SPSS11.0统计学软件,计量资料比较采用方差分析、线性相关分析,计数资料比较采用卡方检验,相关性检验采用Spearman等级相关分析,检验水准α=0.05。
2 结果
2.1 Bmi-1、hTERT蛋白免疫组化检测结果
2.1.1 Bmi-1、hTERT 蛋白在不同乳腺组织中的表达 乳腺IDC、乳腺纤维腺瘤、正常乳腺组织中Bmi-1、hTERT蛋白主要在细胞核内表达,少部分在细胞质表达,呈棕黄色或棕褐色颗粒(图1、2)。Bmi-1蛋白在乳腺癌组、乳腺纤维腺瘤组、正常乳腺组表达阳性率分别为84.5%、37.1%、16.7%,表达阳性率比较,差异有统计学意义(P<0.05)。乳腺癌组、乳腺纤维腺瘤组、正常乳腺组中hTERT蛋白表达阳性率为85.7%、20.0%、6.7%,三种组织表达阳性率比较,存在显著性差异(P<0.05),见表1。

图1 Bmi-1蛋白在正常乳腺组织(A)、乳腺纤维腺瘤(B)及乳腺癌组织(C)中的表达,A、B、C IHC SP×100
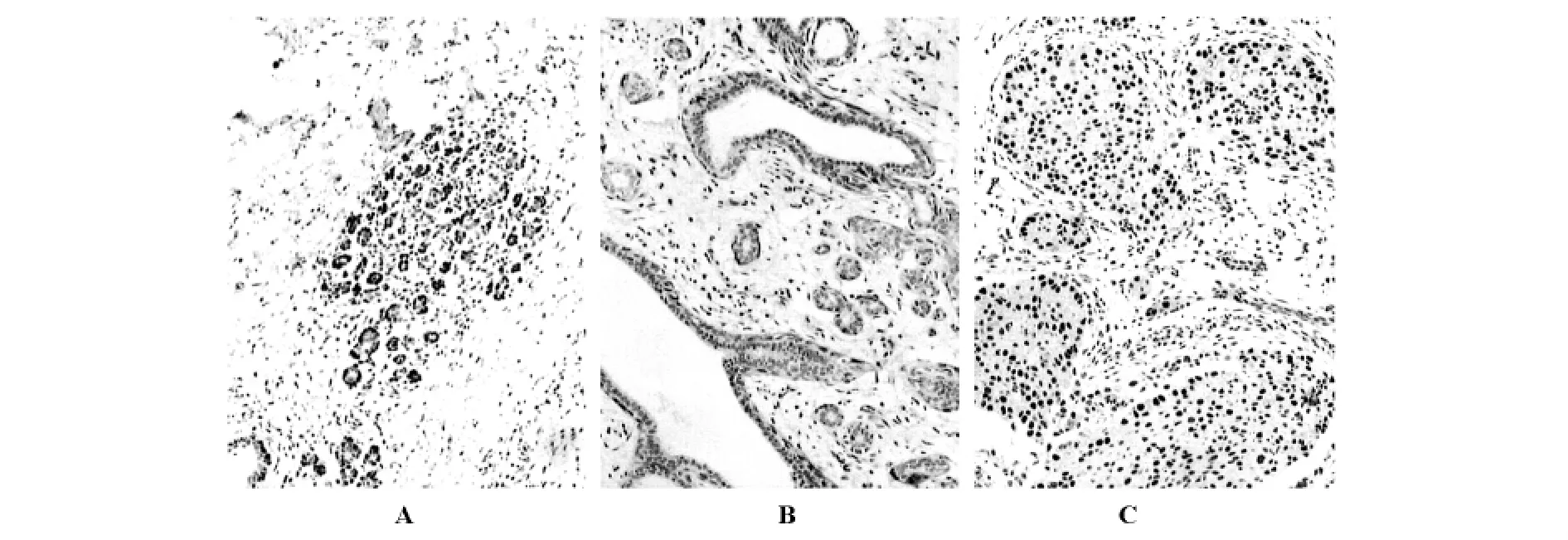
图2 hTERT蛋白在正常乳腺组织(A)、乳腺纤维腺瘤(B)及乳腺癌组织(C)中的表达,A、B、C IHC SP×100

表1 Bmi-1、hTERT蛋白在三组乳腺组织的表达阳性率比较
2.1.2 Bmi-1和hTERT蛋白在乳腺癌组织中表达的相关性分析 56例乳腺浸润性导管癌标本中,Bmi-1和hTERT蛋白的表达同为阳性的有40例,Bmi-1和hTERT蛋白的表达共同阴性的有2例,Bmi-1和hTERT蛋白在乳腺癌组织中的表达具有相关性(r=0.649,P<0.05),见表2。
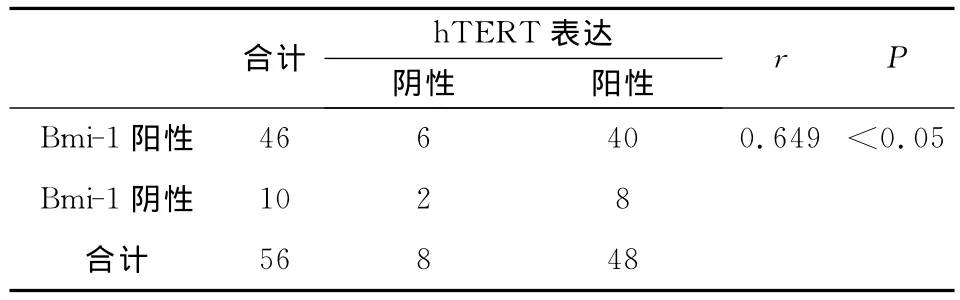
表2 Bmi-1和hTERT蛋白在乳腺癌组织中表达的相关性
2.2 Bmi-1mRNA及hTERT mRNA在不同乳腺组织中的检测结果
2.2.1 Bmi-1mRNA、hTERT mRNA 在三组乳腺组织中的表达 乳腺癌组织、乳腺纤维腺瘤组织、正常乳腺组织中Bmi-1mRNA和hTERT mRNA表达水平均存在显著差异(P<0.05),见图3,表3。
2.2.2 Bmi-1mRNA 与hTERT mRNA 在 乳 腺 癌组织中表达的相关关系 Bmi-1与hTERT mRNA在乳腺癌组织中的表达水平分别为0.897±0.115、0.923±0.067,两者在乳腺癌组织中的表达具有相关性(r=0.354,P<0.05)。

图3 乳腺癌、乳腺纤维腺瘤及正常乳腺组织中Bmi-1mRNA 、hTERT mRNA RT-PCR检测结果
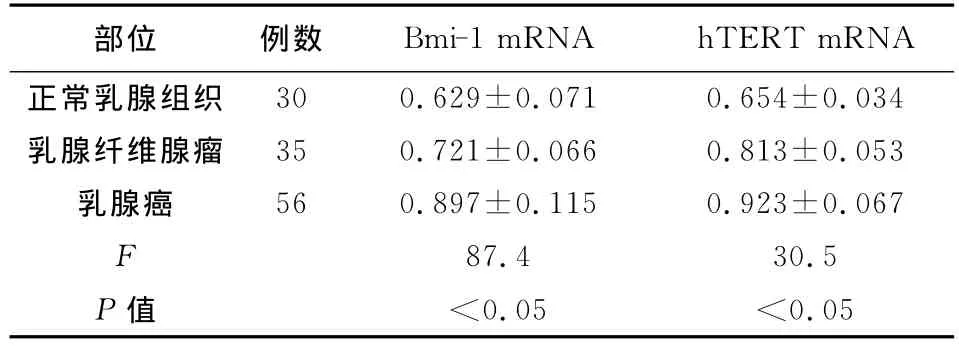
表3 三组乳腺组织Bmi-1mRNA、hTERT mRNA的表达
3 讨论
随着肿瘤分子生物学研究的进展,人们已认识到肿瘤的基因表达决定肿瘤的发生、发展和预后。B细胞特异性莫洛尼氏白血病毒插入位点1(Bmi-1)最初发现是作为一种原癌基因与另一种癌基因cmyc协同作用导致B细胞淋巴瘤的细胞转化和肿瘤形成;作为一个转录抑制因子,Bmi-1调控的下游基因包括INK4a-ARF、端粒酶逆转录酶(hTERT)和Hox基因家族[6]。Bmi-1基因主要参与干细胞包括肿瘤干细胞的自我更新、分化、稳定。近年来研究证实,Bmi-1基因作为一种原癌基因参与多种肿瘤的发生,其高表达与多种肿瘤的发生、发展、预后密切相关[1,7,8]。但其具体机制和临床意义仍存在较大的争论。
端粒(telomere)是存在于染色体末端的一种特殊结构,细胞会随着端粒的缩短而衰老以致死亡。端粒酶是维持端粒长度的一种核糖核蛋白,人端粒酶逆转录酶(hTERT)是端粒酶催化亚单位,是细胞呈现端粒酶活性的决定因素,hTERT基因的表达与端粒酶活性表达一致[9],人体的大多数正常细胞中hTERT的表达被抑制,端粒酶活性呈阴性。近年来研究认为hTERT的高表达致使端粒酶的重新被激活导致细胞无限增殖是恶性肿瘤发生的一个重要途径,可能为肿瘤的诊断提供一个有效的标志物[10]。
我们通过对人乳腺浸润性导管癌、乳腺纤维腺瘤、乳腺正常组织中Bmi-1、hTERT基因在转录水平和蛋白的表达水平进行检测分析,发现从乳腺腺泡正常上皮组织到纤维腺瘤、浸润性导管癌Bmi-1、hTERT mRNA和蛋白表达的阳性率均呈逐渐升高趋势,并且在乳腺浸润性导管癌中的表达显著高于乳腺正常上皮组织和纤维腺瘤,提示乳腺浸润性导管癌的发生可能与BMI-1、hTERT的高表达有关。我们的检测结果显示在乳腺浸润性导管癌中Bmi-1 mRNA与hTERT mRNA表达及Bmi-1蛋白与hTERT蛋白表达均呈正相关关系。这表明Bmi-1与端粒酶活性有密切联系,推断高表达Bmi-1基因可诱导下游基因hTERT的表达,激活端粒酶,促进细胞的增殖、分化,甚至发生凋亡缺失、细胞永生化引发乳腺组织上皮等的恶变,导致恶性肿瘤的发生。此与Dimri等[6]研究结果基本一致。
本研究结果表明,Bmi-1、hTERT mRNA 及蛋白的高表达可能在乳腺癌的发生、发展过程中起重要作用。Bmi-1在转录水平上调控hTERT的表达进而激活端粒酶,可能是乳腺癌发生发展的重要阶段。Bmi-1与hTERT mRNA及蛋白表达成正相关,其联合检测可能成为乳腺癌的早期临床诊断及鉴别诊断的分子标志物,进一步深入研究其上、下游作用基因和效应通路,有助于将Bmi-1、hTERT作为分子靶点推向乳腺癌基因治疗的实际应用中。
[1]Mihara K,Chowdhury M,Nakaju N,et al.Bmi-1is useful as a novel molecular marker for predicting progression of myelodysplastic syndrome and patient prognosis[J].Blood,2006,107(1):305.
[2]Kim JH,Yoon SY,Kim CN,et al.The Bmi-1oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins[J].Cancer letters,2004,203(2):217.
[3]Hahn WC,Meyerson M.Telomerase activation,cellular immortalization and cancer[J].Ann Med,2001,33(2):123.
[4]Jong HS,Park YI,Kim S,et al.Up regulation of human telomerase catalytic subunit during gastric Carcinogenesis[J].Cancer,1999,86(4):559.
[5]Song L B,Zeng MS,Liao WT,et al.Bmi-1is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells[J].Cancer Res,2006,66(12):6225.
[6]Dimri GP,Martinez JL,Jacobs JJ,et al.The Bmi-1oncogene induces telomerase activity and immortalizes human mammary epithelial cells[J].Cancer Res,2002,62 (16):4736.
[7]Saeki M,Kobayashi D,Tsuji N,et al.Diagnostic importance of overexpression of Bmi-1mRNA in early breast cancers[J].Int J Oncol,2009,35(3):511.
[8]Wang JF,Liu Y,Liu WJ,et al.Expression of Bmi-1gene in esophageal carcinoma cell EC9706and its effect on cell cycle,apoptosis and migration[J].Chin J Cancer,2010,29(7):689.
[9]Kolquist KA,Ellisen LW,Counter CM,et al.Expression of TERT in early premalignant lesions and a subset of cells in normal tissues[J].Nat Genet,1998,19(2):182.
[10]von Figura G,Hartmann D,Song Z,et al.Role of telomere dysfunction in aging and its detection by biomarkers[J].J Mol Med,2009,87(12):1165.
Study on the expressions of Bmi-1and hTERT in breast carcinoma and their significance
JIQiao-hong,FENGYanming,ZHANGZhao-hui,etal.(DepartmentofPathologyandPathophysiology,MedicalCollege,HenanUniversity ofScienceandTechnologyLuoyang471003,China)
ObjectiveTo investigate the relationship between Bmi-1,hTERT mRNA,or protein expressions in the occurrence and development of breast carcinoma.MethodsHuman breast tissue samples were obtained from 56invasive ductal carcinoma cases,35breast fibroadenoma cases,and 30normal breast tissue cases.The expressions of mRNA,protein of Bmi-1and hTERT were examined by using immunohistochemistry (IHC)and RT-PCR,respectively.ResultsBoth Bmi-1and hTERT mRNA or protein expressions were significantly higher in breast invasive ductal carcinoma than those in normal breast tissue and breast fibroadenoma(P<0.05).Moreover,there was a significant positive correlation between Bmi-1and hTERT expression in breast carcinoma(P<0.05).ConclusionA high Bmi-1and hTERT mRNA or protein expressions could be considered associated with evolution and malignant transformation of the breast tumor.And Bmi-1may play a role in the transcriptive activation of hTERT gene in breast carcinoma,which maybe has an effect on progression of breast carcinoma.Combined detection of Bmi-1and hTERT expression may be useful for differential diagnosis of malignant and benign breast lesions,which deserves further researches.
Breast neoplasms;Bmi-1;hTERT;immunohistochemistry;RT-PCR(ChinJLabDiagn,2012,16:1230)
R737.9
A
1007-4287(2012)07-1230-04
*通讯作者
吉巧红(1973-),女,硕士,讲师,主要从事肿瘤病理研究。
2011-07-01)
