猪繁殖与呼吸综合征病毒分离株的致病性研究
2012-08-16杨德康魏建忠王桂军
杨德康,魏建忠,王桂军,李 郁
(1.肥东县动物疫病预防控中心,安徽肥东 231600;2.安徽农业大学动物科技学院,安徽合肥 230036)
猪繁殖与呼吸综合征(PRRS))是由猪繁殖与呼吸综合征病毒(PRRSV)引起的猪的一种病毒性传染性疾病[1]。该病自发现以来已经给各主要养猪国家带来了巨大的经济损失。近几年,安徽省PRRSV的感染猪群以高热、呼吸困难、皮肤发红为特征,出现了高热、高发病率、高死亡率、低治愈率的“三高一低”新特点,与以前的PRRS病症相比有很大差异,为掌握PRRSV安徽分离株的致病性,感染猪的临床症状、剖检病变、病理组织学变化,本研究选用所分离的毒株进行了仔猪的人工感染试验[2]。对猪繁殖与呼吸综合征病毒进行致病性研究,为猪繁殖与呼吸综合征病毒对猪的致病机制提供理论依据,为猪繁殖与呼吸综合征病的防控提供实验依据。
1 材料
1.1 病毒
PRRSV SCH07毒株。
1.2 实验动物
来源相同的40日龄健康仔猪4头,采集血清经试剂盒PRRSV抗原和抗体检测均为阴性。
1.3 主要试剂
猪繁殖与呼吸综合征RT-PCR检测试剂盒购自北京世纪元亨动物防疫技术有限公司;猪繁殖与呼吸综合征抗体检测试剂盒购自美国IDEXX公司;琼脂糖为Sigma公司产品;其他常规试剂均为分析纯。
2 方法
2.1 病毒的增殖
将PRRSV SCH07的第15代病毒接种于生长48 h形成单层的Marc-145细胞,接种后吸附1 h,加维持液。每日观察细胞,在有80%~90%的细胞出现病变时收获病毒。
2.2 病毒半数细胞感染量测定(TCID50)
将分离病毒SCH07作10-1~10-8系列稀释,分别接种于单层Marc-145细胞96孔培养板,每个稀释度接8孔,每孔0.1 mL,37 ℃作用1 h 。每孔再加入0.1 mL维持液,同时设不接病毒的正常细胞对照,置于5%的CO2培养箱中37 ℃培养,连续观察记录细胞病变7 d,结果按Reed -Muench法计算。
2.3 攻毒试验
随机将试验猪分成实验组、阴性对照两组,每组各2头,实验组仔猪经口、鼻接种PRRSV SCH07株病毒细胞培养物, 每头5 mL;阴性对照组接种正常细胞培养物,每头 5 mL,两组隔离饲养。接种后连续观察仔猪的临床表现、测定体温,记录发病和死亡情况,分别在第3、7、10、20、30、40天各采血一次,供检测抗体。
2.4 血清中PRRSV 抗体的检测
用猪繁殖与呼吸综合征抗体检测试剂盒测定试验猪血清中PRRSV抗体,按试剂盒说明书方法进行,S/P≥0.4 为阳性,S/P<0 .4为阴性。
2.5 病料中PRRSV的检测
采集实验猪的肺、脾、肾、心、淋巴结等组织样品,经混样处理,用猪繁殖与呼吸综合征RT-PCR检测试剂盒检测PRRSV,按试剂盒说明书方法进行。
2.6 石蜡切片的制作
采集心、肺、脾、肝、肾、淋巴结等组织样品;10%福尔马林固定、石蜡包埋、切片、HE染色、光学显微镜下观察。
2.7 鉴别诊断
无菌操作挑取攻毒组死亡猪的脾、肝组织,在兔血琼脂平板上划线进行细菌分离,经37 ℃培养24 h后观察结果;对发病猪的组织病料、分离株细胞培养物、攻毒发病仔猪组织病料进行PRRSV的RT-PCR检测,按试剂盒说明书方法进行。
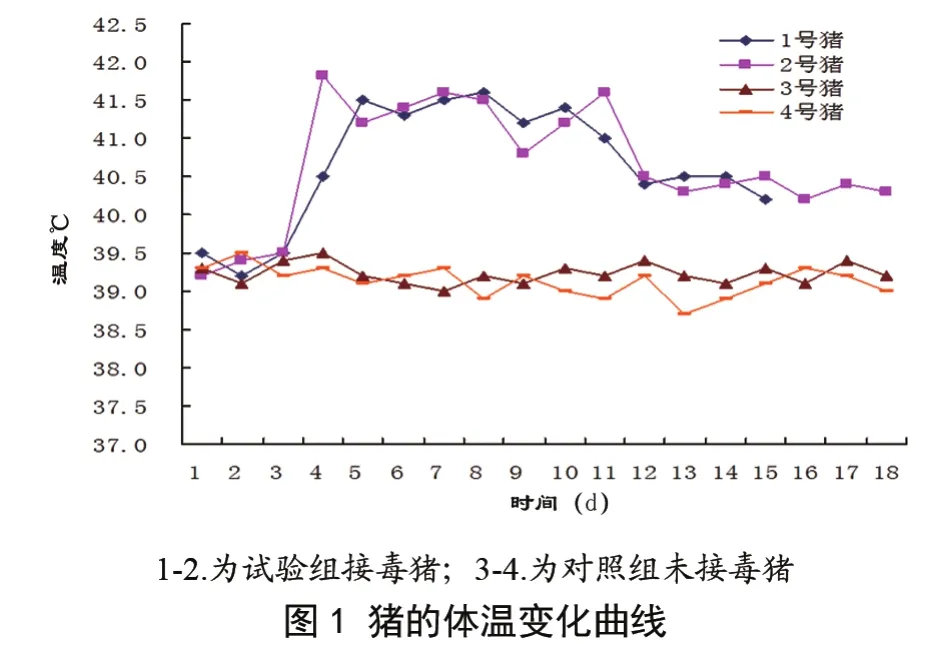
3 结果
3.1 分离病毒的TCID50测定结果
按Reed Muench法计算得出TCID50结果为104.7/0.1 mL,分离病毒在Marc-145细胞上的毒价为10-4.7TCID50/0.1 mL。
3.2 临床症状
接毒组的仔猪在接毒3~4 d后,体温升高至41 ℃以上,持续高热9~15 d(图1)。发病初期临床表现为食欲不振,精神沉郁,眼分泌物增多、有泪斑,呼吸困难、偶有呛咳,腹部皮肤发红,粪便干结,伴有间歇性腹泻,尿少而黄;后期表现为消瘦、后肢无力,喜卧,耳尖、腹下和四肢末梢皮肤发紫等症状。接毒后15 d病情严重的一头猪死亡,濒死前有肌肉震颤、四肢划水样等神经症状;另一头耐过,但生长极为缓慢,在高温、高湿的天气条件下病情出现反复,对照组无明显异常变化。
3.3 剖检病变
剖检发现仔猪肺呈暗红色,肺间质增宽明显,膈叶、心叶有散在的出血点和肉样变,肺的弹性减弱;腹股沟淋巴结、肠系膜淋巴结、肺门淋巴结肿大、出血,脾脏肿胀、切面外翻,边缘有多边形暗红色梗死灶,背面有丘疹状突起,肾脏表面有少量针尖大出血点,心包积液。其他脏器无明显肉眼病变;耐过猪第150 d宰杀,剖检可见肺呈肉样变,膈叶、心叶有灶性暗红色实变,其他脏器无明显肉眼病变(图2、图3、图4)。
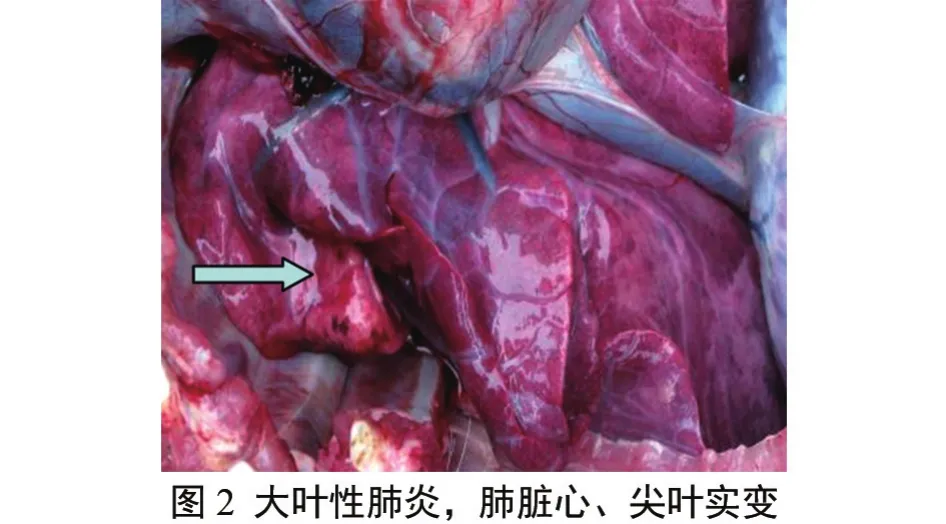
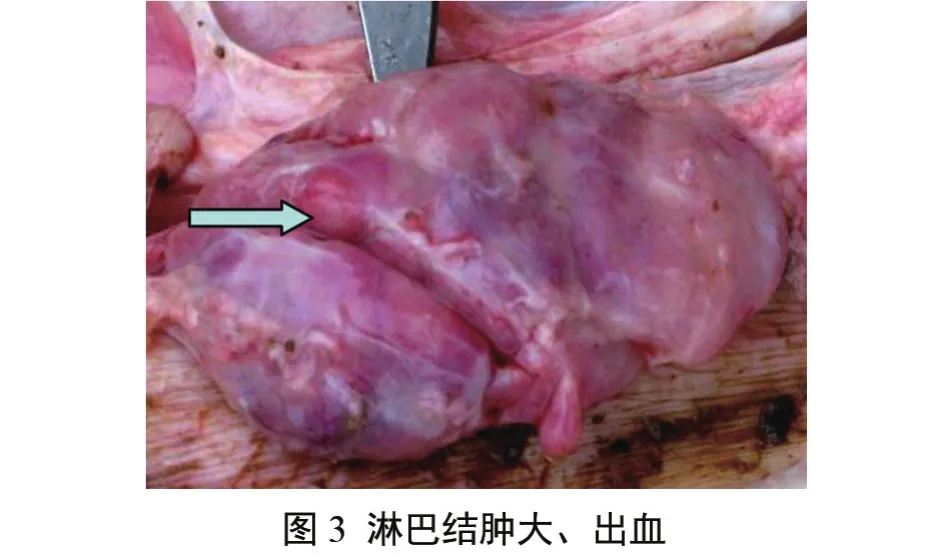

3.4 病理组织检查
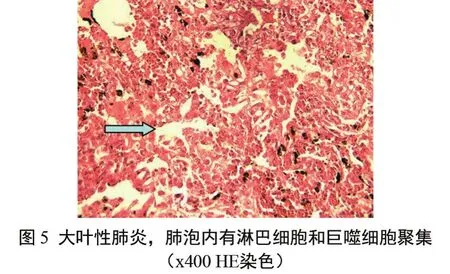
肺脏 肺组织发生弥漫性或局灶性纤维性肺炎,表现为细支气管上皮细胞肿胀、有的脱落, 管腔内渗出物中有少量脱落的上皮细胞和巨噬细胞。肺泡隔因巨噬细胞、淋巴细胞浸润及间质增生而明显增厚, 肺泡壁细胞肿胀,变圆,肺泡中充斥着大量的巨噬细胞、淋巴细胞、红细胞、脱落的上皮细胞、含铁血黄素颗粒及粉红色炎性渗出物,局部肺泡出现几个肺泡相互融合, 形成肺气肿[4](图5)。
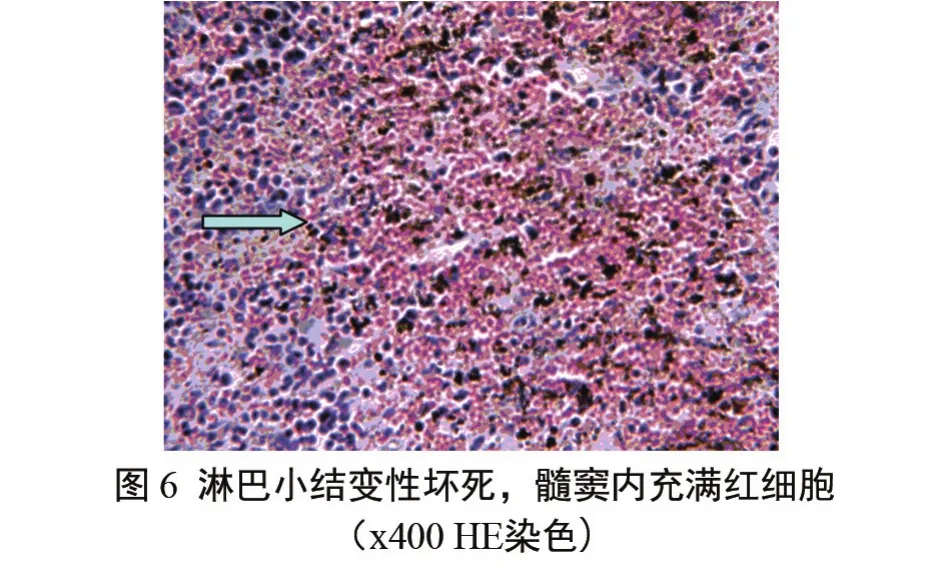
淋巴结 皮质内淋巴小结固有结构遭受破坏,界限不清楚,淋巴细胞变性坏死 ,淋巴结髓质界限不清晰,细胞排列松散。髓质部有出血现象、髓窦里充满红细胞,髓索有炎性细胞浸润(图6)。
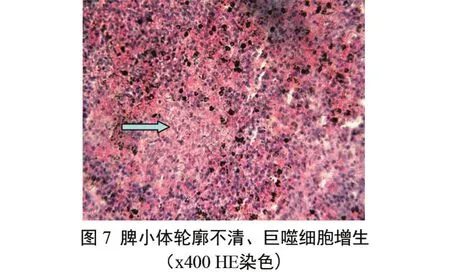
脾脏 脾小体轮廓不清,淋巴细胞和网状细胞崩解、碎裂,在白髓和红髓均可见红细胞蓄积和巨噬细胞增生,脾索肿胀、细胞变性、坏死。部分脾脏内可见脾小体中心坏死、巨噬细胞、大量网状细胞增生和含铁血黄素颗粒沉着(图7)。
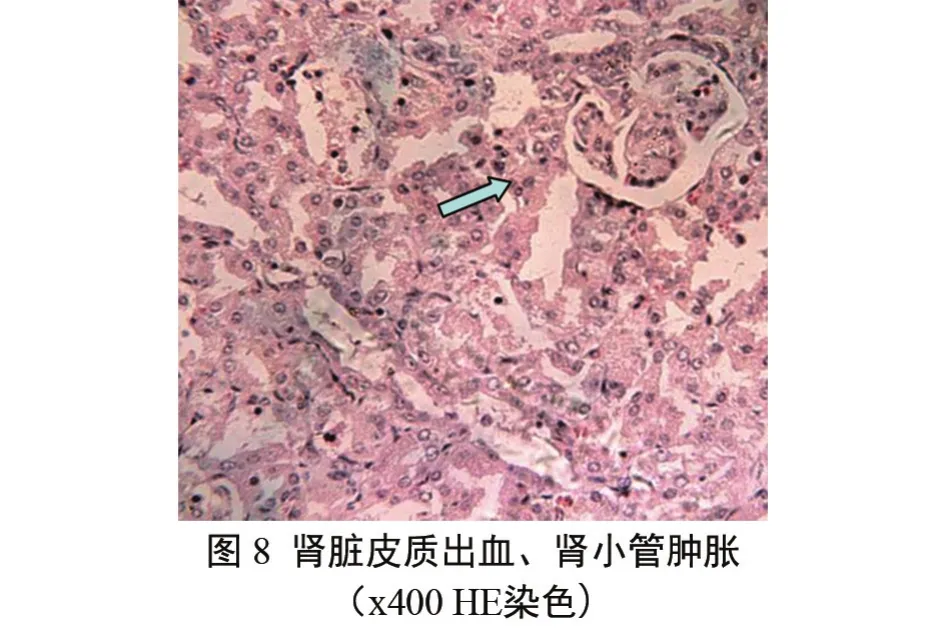
肾脏 皮质出血,肾小球肿胀,肾小管肿胀,上皮细胞颗粒性变性,致使管腔狭窄;集合管尿潴留,管腔增大,肾小球周围和肾曲管之间的间质中有大量淋巴细胞和少量巨噬细胞浸润(图8)。
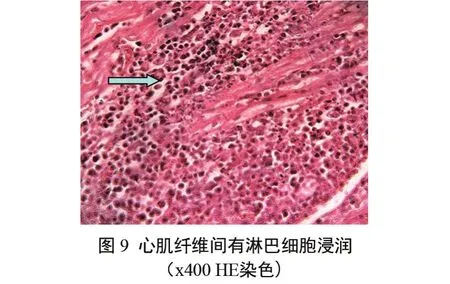
心脏 局部心肌纤维间有红细胞渗出、巨噬细胞和淋巴细胞浸润(图9)。
3.5 抗体检测结果
接毒组在第7天血清中首次检测到抗体,在第40天的血清中仍能检测到抗体;对照组一直为阴性(表1)。
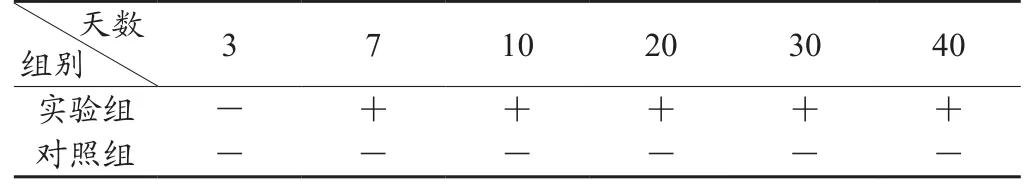
表1 接毒组血清中PRRSV抗体检测结果表
3.6 RT -PCR鉴定结果
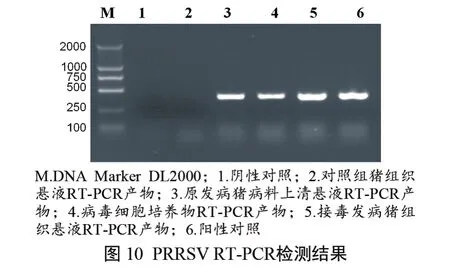
对发病猪的组织病料、分离株细胞培养物、攻毒发病仔猪组织病料进行PRRSV的RT-PCR检测,产物经琼脂糖凝胶电泳检测,均可扩增出约400 bp大小的条带 ,与阳性对照相符;阴性对照未见条带(图10)。
3.7 鉴别诊断结果
血平板上未见有任何细菌生长 猪瘟病毒、猪圆环病毒的RT-PCR检测为阴性,说明试验猪没有继发感染。
4 讨论
经典的PRRSV 主要是引起妊娠母猪流产、死胎、木乃伊胎等繁殖障碍和仔猪的呼吸道症状,但2006年以后国内暴发的病例中出现许多成年猪死亡的病例[3]。本试验所用的SCH07毒株根据基因测序结果为美洲型PRRSV变异株,致病性试验结果表明该毒株第15代细胞培养物能够引起仔猪明显的PRRS临床症状和剖检病变:出现持续高热、猪体温升高持续15~18 d,发病猪耳根、腹部皮肤发红、呼吸困难的症状,剖检肺脏和脾脏都有明显的病变。发病率达100%;死亡率为50%,且从攻毒后死亡试验猪的肺脏和耐过试验猪的血清中均可检测到PRRSV变异株。本试验结果与近期报道的高致病性PRRSV变异株人工感染猪的试验结果基本一致,但与国内早期的PRRSV人工感染试验的临床症状不明显和不引起死亡的结果有一定区别,说明变异株致病性增强,且发病情况可能与饲养环境有一定关系,不利环境可能会诱发其发病[4]。
本试验的病理组织学观察发现,PRRS的主要病变在肺脏、脾脏和淋巴结。肺脏出现以肺泡膈增宽和伴有巨噬细胞增生为特点的间质性肺炎,这可能是试验猪出现呼吸困难的直接原因之一[5-7]。通过病理组织学观察我们发现病猪全身淋巴结、脾脏的淋巴组织严重出血、坏死严重,验证了PRRS是免疫抑制性疾病,会造成机体细胞免疫机能降低,易导致继发感染其他疾病[8-10]。
目前,PRRS的治疗还没有特效药物,其防控主要依赖免疫疫苗,在生产实践中,用PRRSV疫苗的免疫效果不是很理想,可能与PRRS是免疫抑制性疾病,或者是猪群本来就存在其他免疫抑制性疾病的隐性感染,免疫系统受到破坏有关,但本研究在实验过程中发现:在接毒后第15 d,用相同毒价、方法和2倍剂量对耐过猪重新接毒一次,两天后,接毒猪只表现出轻微的症状,后逐渐康复。说明耐过猪体内的抗体水平已能抵御强毒的侵袭,因此,预防该病所选用的疫苗株和当地流行毒株基因组的吻合率,应引起重视。
[1] Wensvoort G,Tepstra C,Pol J M A, et al. Mystery swine disease in The Netherlands: the isolation of Lelystad virus[J]. Vet Q,1991,13(3):121-130.
[2] 斯特劳B E,阿莱尔S D,蒙加林W L,等.猪病学[M].赵德明,张仲秋,沈建忠,译.9版.北京:中国农业大学出版社,2008.
[3] 童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合症病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报,2007,29(5):323-327.
[4] 宁宜宝,郑杰,张纯萍,等.我国南方猪高热病的研究(Ⅱ)—猪繁殖与呼吸障碍综合征病毒的分离、鉴定和致病性测定[J].中国兽药杂志,2007,41(1):14-18.
[5] 白挨泉,刘为民,王晓清.猪繁殖与呼吸系统综合症的组织病理学研究[J]. 中国畜牧兽医,2005,35(7):54-56.
[6] 丁伯良,桑传兰,鄢明华,等.猪繁殖与呼吸综合征病毒SJ 株(天津分离株)感染仔猪的病理学[J]. 中国兽医学报,2005, 25(5): 456-459.
[7] 赵素微,王凤龙,冯专照,等. 猪繁殖与呼吸综合征自然病例病理学研究[J].内蒙古农业大学学报,2007,29(1):20-23.
[8] 张妙红,曾德年,雷红宇,等.高致病性猪繁殖与呼吸综合征病猪的病理学观察[J].畜牧与兽医,2008,40(5):82-84.
[9] 高娃,祝永华,郭龙宗,等,从病理组织学再看“猪高热病”[J].猪业科学,2007,24(7):80-81.
[10] 温永俊,吴国军,蔡雪辉,等. 猪圆环病毒和猪繁殖与呼吸综合征病毒混合感染对仔猪致病性的评估[J]. 中国预防兽医学报,2007,29(5),336-340.
