关节软骨冻结过程热膨胀行为的实验研究
2012-08-13孙慧君
胥 义 孙慧君 吕 娅
(上海理工大学生物系统热科学研究所,上海 200093)
引言
关节软骨能为关节活动提供低摩擦、低磨损和吸收力学冲击等重要功能,但由于关节软骨没有血管、神经和淋巴管提供营养,其自身修复能力很差,所以一旦损伤后,常常引发各种关节疾病,严重影响着人们的生活质量[1]。软骨移植是修复关节软骨损伤的一种非常可靠的治疗手段,而有限的关节软骨供体来源及其保存问题,一直是制约关节软骨移植手术得以推广的主要原因[1]。近年来,国内外许多学者都在探索关节软骨的低温保存技术[2-7],期望能成功建立关节软骨低温保存组织库,为临床应用提供丰富的材料来源,同时也便于医生有足够的时间,进行术前更准确的尺寸和形状匹配以及充分的病毒学和细菌学检测等工作[8]。
但有研究发现,低温冷冻软骨移植后出现了软骨组织纤维化[9]、软骨基质断裂以及机械力学性能显著降低[10-11]等问题。从现有的文献调研来看,有关关节软骨低温保存过程中的生物力学性能变化的研究还很少,对其生物力学性能的低温损伤机理至今不明确,这也是目前关节软骨组织尚未完全成功保存的重要原因之一。事实上,在对其他生物组织材料进行低温保存时,常常也会观察到低温断裂现象[12-14]。现已明确造成生物材料低温断裂的主要原因是:由于生物材料中富含水分,在冻结过程中要发生较大体积膨胀率(一般认为纯水的冻结膨胀率约为9%[17]),材料外表面首先冻结,随着温度继续降低,材料内部也会随之冻结膨胀,但由于受到外部已冻结固相的限制其膨胀,在材料内部产生较大的热应力,当该应力得不到及时释放时,必然导致生物材料宏(微)观损伤[15]。
因此,系统研究生物材料冻结过程的热膨胀行为,对于生物材料低温冻结时的力学性能认识是至关重要的。本研究探讨降温速率和低温保护剂对软骨在冻结过程热膨胀行为的影响情况,这将非常有助于深入认识关节软骨低温保存过程中的生物力学性能损伤机理,探索关节软骨在这一温区可能发生断裂的原因。
1 材料与方法
1.1 实验材料
选取上海本地成年猪,取整根有两瓣半月板覆盖白色软骨的猪大骨。用手术剪将半月板剪去,并用专用工具(冲头)制备直径为5 mm的软骨测试样品。用格林氏液将样品表面的滑液冲洗掉,再分别置于体积浓度为10%、30%、60%的低温保护剂(二甲基亚砜、甘油和1,2丙二醇,均为分析纯,上海国药集团化学试剂有限公司)中进行2.5 h的充分渗透,即用低温保护剂将软骨内的水分充分置换,并存于4℃冰箱贮存以备实验时取用。
1.2 测试方法
1.2.1 含水量的测试
采用医用真空干燥箱(DZF系列真空干燥箱,上海华连医疗器械有限公司),在进行真空干燥前,务必用滤纸将样品表面的水分吸干,真空度为50 Pa,温度50℃,连续干燥6 h。并用天平精确称量样品干燥前后重量,按如下公式计算:
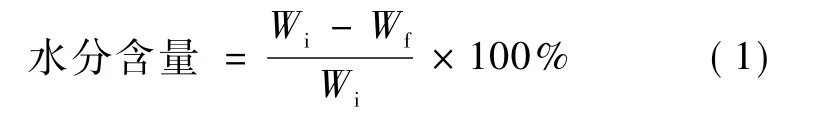
式中,Wi为样品初始重量(g);Wf为样品干燥后的重量(g)。
1.2.2 热应变的测试
用热机械分析仪 (TMA Q400,TA,USA)作为测试仪器(压缩模式)。测试方法如下:(1)将直径为5 mm、厚度为3~4 mm的样品置于压缩夹具中心位置;(2)关闭炉盖,将炉腔体冷却至0℃;(3)加载微小载荷0.005 N,以确保样品与夹具充分接触,但又不至于造成样品变形,读取此时样品的厚度为初始厚度;(4)以一定的降温速率进行程序降温至-100℃,记录整个过程样品厚度的变化。热应变值可以按下式计算获得:
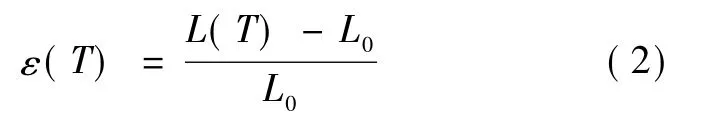
式中,L0为样品初始厚度 (mm);L(T)为样品在降温过程中的厚度 (mm);ε(T)为样品热应变。
为确保实验数据的可靠性,所有实验做3次平行样,并取平均值。
1.2.3 冻结相变过程最大热应变变化值的确定
如图1所示,图中为样品热应变实验曲线,随着温度降低到A点时,热应变突然增大,此时开始发生冻结相变过程,达到B点时,热应变值达到最大,随着温度的继续降低,热应变则会逐渐减小。根据生物材料冻结特点,可以认为从A点到B点的过程即为冻结相变过程,且这两点之间所经历的时间亦为这一相变过程时间。因此,所讨论冻结相变过程最大热应变变化值为实验曲线中A、B两点对应的热应变值之差,即


图1 样品冻结过程热应变曲线Fig.1 Thermal strain curve of sample during freezing
2 实验结果
2.1 取样位置对冻结过程热膨胀的影响
关节软骨表面呈球面分布,关节软骨的厚度以及主要基质含量在不同的部位是不均匀的,这种差异可能是由关节不同部位所受负荷不同而造成的[16]。因此,可以推断:完整关节软骨在进行冻结保存时,可能会由于其中水分等分布不均匀,而影响关节软骨冻结热膨胀(或收缩)效果,而最终引起关节软骨内热应力分布不均。为了验证这个推测,分别测试了关节软骨不同部位处的热应变变化值,以及对应的水分含量。
图2所示为关节软骨表面不同取样位置示意图,图3为样品经过3℃/min降温时的冻结过程热应变曲线。从图3中可以看出,随着温度的降低直到初始冻结温度(大约在 -23℃至 -28℃之间),所有样品都有较为明显的热应变减小过程。当达到初始冻结温度后,热应变均在极短的温度范围内陡然增大,之后随着温度的进一步降低,热应变又较缓地线性减小。
表1对比了不同取样位置样品在冻结相变过程中热应变变化值,以及相对应的水分含量值。很明显,从不同位置取样的样品含水量差异性较大,且样品冻结过程的热应变变化值与样品的含水量有密切关系。中心区域Ⅴ的含水量最低(约为70%),其对应的热应变变化值为3.20%,而内、外侧(即Ⅳ、Ⅲ)区域含水量最高(约为79%),其对应的热应变变化值也最大,达到5.10%左右,前、后侧(即Ⅰ、Ⅱ)的含水量和最大热应变变化值均居于中等水平。

图2 关节软骨表面取样位置示意图(Ⅰ,Ⅱ分别为前后侧;Ⅲ,Ⅳ分别为内外侧;Ⅴ为中心区域)Fig.2 Sampling location on the articular cartilage surface.Ⅰ, Ⅱ are front side and backside zones.Ⅲ,Ⅳ are inside and outside zones.Ⅴ is central zone

图3 不同取样位置样品的冻结热应变Fig.3 Thermal strain of specimens extracted from five distinct zones of cartilage surface

表1 不同取样位置样品的含水量以及冻结过程最大热应变变化值Tab.1 Water content,maximal thermal strain change value during freezing phase change of samples from five distinct zones
2.2 降温速率对冻结过程热膨胀的影响
图4是降温速率对关节软骨冻结过程热应变的影响。从图中可以明显看出,在冻结相变发生前,降温速率越慢,热应变减小幅度越大。而从表2可以看出,降温速率越快,其冻结过程最大热应变变化值越大,所对应的时间越短,例如,5℃/min时的最大热应变变化值5.39% ±0.05%是1℃/min(最大热应变变化值为3.73% ±0.06%)的1.45倍,但后者所需时间是前者的3倍。但在冻结相变结束后,3种降温速率下的热应变均呈平行直线缓慢较小,没有大的差异性。
2.3 低温保护剂对冻结膨胀的影响
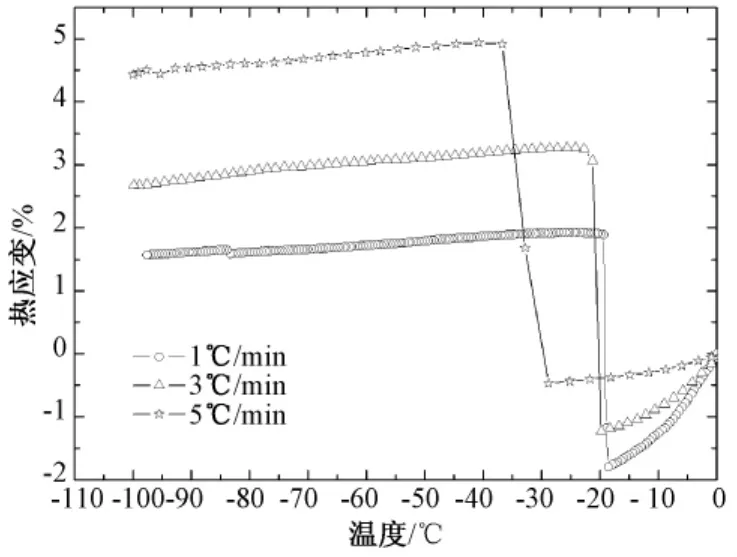
图4 降温速率对热应变的影响Fig.4 Thermal strain as affected by freezing rates

表2 不同降温速率和不同低温保护剂浓度时的相变温度、最大热应变变化值及其对应的时间间隔Tab.2 Phase change temperatures,maximum change value of thermal strains and corresponding time for reaching the phase change under different freezing rates and CPA concentrations

图5 二甲基亚砜浓度对热应变的影响Fig.5 Thermal strain as affected by different DMSO concentrations
图5给出了样品经过不同二甲基亚砜浓度处理后的冻结过程热应变变化情况(降温速率为3℃/min)。从图中可以发现,与新鲜关节软骨相比,二甲基亚砜能够显著抑制其冻结过程的热膨胀,而且二甲基亚砜浓度越高,这种抑制越明显。特别是当二甲基亚砜浓度足够高时,如达到60%(v/v),整个降温过程的热应变呈线性下降,不再出现热膨胀突变现象。从表2中还可以看出,随着二甲基亚砜浓度的增加,冻结相变膨胀量越小,例如30%(v/v)二甲基亚砜的热膨胀量只有新鲜软骨冻结膨胀的40%左右,但它对应转变时间却是后者的5.25倍。另外,从图5和表2中均可发现,一旦样品经过二甲基亚砜保护后,其初始冻结温度也会随其浓度增大而减小,这是符合稀溶液依数性质的[17]。
图5 对比了 Jimenez Rios[20]的研究结果,该文献测量了血管材料经过7.05 M二甲基亚砜(相当于50%~60%(v/v)二甲基亚砜)保护后的降温过程热应变变化情况。他们认为此浓度下的生物材料冻结过程不再有冰晶出现,可以实现玻璃化保存,因而其降温过程的热应变呈线性减小。

图6 低温保护剂种类对热应变的影响。(a)10%(v/v);(b)30%(v/v);(c)60%(v/v)Fig.6 Thermal strain as affected by different CPAs.(a)10%(v/v);(b)30%(v/v);(c)60%(v/v)
图6比较了二甲基亚砜、甘油、1,2丙二醇等3种低温保护剂在不同浓度下对关节软骨降温过程热应变的影响。结合表2来看,甘油和丙二醇也是随着浓度增大,其最大冻结膨胀形变量减小,以及其初始冻结温度降低,这与二甲基亚砜的趋势是一样的。且达到60%(v/v)时,均无冻结热膨胀突变现象。但与二甲基亚砜不同的是:在低浓度区域,这两者对关节软骨冻结膨胀的抑制效果较小,例如10%(v/v)和30%(v/v)时,这两者的最大热应变变化值分别是4.20%±0.02%和3.10%±0.10%以及4.50% ±0.10%和2.90% ±0.10%,均大于二甲基亚砜(分别是3.22% ±0.07%和2.53% ±0.08%)。
3 讨论
图3中热应变随着温度降低而减小,直到温度降至初始冻结温度后,热应变均在极短的温度范围内陡然增大,之后随着温度的进一步降低,热应变又较缓地线性减小。对于这一现象解释如下:相变前的热收缩由于软骨内各基质分子(如水分子、胶原蛋白等)之间距离随着温度降低而导致的宏观收缩现象;但当温度降低至初始冻结温度时,热应变突然增大,这主要是因为样品中自由水快速转变冰晶膨胀所致;而随着温度的继续降低,其热应变值继续缓慢减小,这也是由于冷冻关节软骨中被固化基质分子之间距离随温度降低而收缩所致。而表1的结果表明,关节软骨表面因长期所受不均匀负荷,造成不同区域的含水量有较大差异,在进行完整关节软骨低温冻结保存时,不可避免地存在非均匀热膨胀现象,很可能导致完整关节软骨内部热应力的产生,并损伤关节软骨中的胶原纤维等成分,这或许是完整关节软骨至今未能得以成功保存的重要原因。有关这一结论,还需要更进一步的形态学观察验证。
至于降温速率对冻结相变发生前的热应变减小与降温速率呈负相关关系的主要原因是:在冻结发生前,关节软骨中的水分子虽然受降温的影响而缩短彼此间的距离,但它们同时又受到蛋白多糖、胶原纤维以及电荷的共同作用,表现出典型的粘弹性特点,存在应变松弛现象,从而抑制这种水分子之间距离减小的趋势;特别是当快速降温时,达到冻结相变点温度的时间更短,水分子之间的距离还没有来得及减小到稳定状态,就发生了冻结相变过程,因而冻结发生前的热收缩越小。而表2中表明:降温速率越快,其冻结过程最大热应变变化值越大,其所对应的时间越短。据此可以推测:当关节软骨经历快速降温时,其较大的热膨胀必然产生较大的热应力,但在短时间内又无法释放这些热应力,必将导致关节软骨内部基质(如胶原纤维)的微结构损伤,甚至带来宏观低温断裂现象。
从表2中还可以看出,随着二甲基亚砜浓度的增加,冻结相变膨胀量越小,这说明经过较高浓度二甲基亚砜保护后的关节软骨,在冻结过程中产生较小的热应力,对关节软骨内部胶原纤维等基质造成的微观损伤较小,从而起到保护的作用。特别是当采用60%(v/v)二甲基亚砜作为低温保护剂时,其降温过程不再出现热膨胀突变现象的原因,就是实现了关节软骨的玻璃化保存,避免了冰晶产生和生长所带来的热膨胀。因此,高浓度低温保护剂对于关节软骨基质的力学性能保护是非常有益的,但是,高浓度低温保护剂可能也会对关节软骨细胞以及其他活性物质造成不可逆损伤,这个问题还需要进一步探索。
从图6和表2可以看出,二甲基亚砜、甘油、1,2丙二醇三种低温保护剂在不同浓度下对关节软骨降温过程热应变有不同程度的影响,要采用低浓度低温保护剂时,选择二甲基亚砜更适合,但这3种保护剂在高浓度区域的保护能力没有太大差别。
4 结论
采用热机械分析仪TMA,研究了猪关节软骨从0~100℃范围内降温过程热膨胀行为,得出以下结论:
1)关节软骨表面不同区域的含水量有较大差异,在进行完整关节软骨低温冻结保存时,不可避免地存在非均匀热膨胀现象,很可能导致关节软骨内部热应力的产生,并损伤关节软骨中的胶原纤维等成分,这很可能是完整关节软骨至今未能得以成功保存的重要原因。
2)当降温速率较大时,突变前后的应变差较大,这说明,低温膨胀可能造成关节软骨内部组织损伤,由于膨胀所产生的应力来不及释放,可能会带来严重的低温断裂问题,因此慢速降温可能更适合于关节软骨的低温保存。
3)高浓度低温保护剂对于关节软骨基质的力学性能保护是非常有益的,但是,高浓度低温保护剂可能也会对关节软骨细胞以及其他活性物质造成不可逆损伤,这个问题还需要进一步探索。此外,使用低浓度低温保护剂时,与甘油和丙二醇相比,二甲基亚砜更适合保护关节软骨。
[1]卫小春.关节软骨[M].北京:科学出版社,2007:120-154.
[2]Seddighi MR,Griffon DJ,Schaeffer DJ,et al.The effect of chondrocyte cryopreservation on cartilage engineering [J].The Veterinary Journal,2008,178(2):244-250.
[3]Pegg DE, Wusteman MC, Wang LH.Cryopreservation of articular cartilage.Part 1:Conventional cryopreservation methods[J].Cryobiology,2006,52(3):335-346.
[4]Song YC,An YH,Kang QK,et al.Vitreous preservation ofarticular cartilage grafts[J].J Invest Surg,2004,17(2):65-70.
[5]Leila L,Ken F,McGann LE,et al.Cryopreservation of porcine articular cartilage:MRI and biochemical results after different freezing protocols[J].Cryobiology,2007,54(1):36-43
[6]陈百成,陈竞清,高石军,等.低温保护冻存的异体骨软骨移植修复关节软骨缺损的研究[J].中国骨肿瘤骨病,2003,2(6):336-339.
[7]李军政,成诗银,崔鹏程,等.深低温冻存软骨细胞构建组织工程化软骨[J].中国误诊学杂志,2004,4(10):1587-1589.
[8]曹谊林.组织工程学[M].北京:科学出版社,2008.
[9]Muldrew K,Novak K,Studholme C,et al.Transplantation of articular cartilage following a step-cooling cryopreservation protocol[J].Cryobiology,2001,43(3):260-267.
[10]Kubo,T,Arai Y,Namie K,et al.Time-sequential changes in biomechanical and morphological properties of articular cartilage in cryopreserved[J].Journal of Orthopaedic Science,2001,6:276-281.
[11]Zheng,SK,Xia,Y,Bidthanapally,A,et al.Damages to the extracellular matrix in articular cartilage due to cryopreservation by microscopic magnetic resonance imaging and biochemistry[J].Magnetic Resonance Imaging,2009,27:648-655.
[12]胥义,周国燕,高才.兔主动脉冻结膨胀行为及其影响因素的研究[J].工程热物理学报,2005,26(6):1013-1015.
[13]Shi XL, Dalta AK.Thermal stresses from large volumetric expansion during freezing of biomaterials[J].Transaction of the ASME,1998,120:720-726.
[14]Xu Y,Hua TC,Sun DW,et al.Effects of freezing rates and dimethyl sulfoxide concentrations on thermal expansion of rabbit aorta during freezing phase change as measured by thermo mechanical analysis[J].Journal of Biomechanics,2007,40:3201-3206.
[15]Rabin Y,Steif PS.Thermal stress modeling in cryosurgery[J].International Journal of Solid and Structures,2000,37:2363-2375.
[16]Wang CCB,Chaine NO,Hung CT,et al.Optical determination of anisotropic material properties of bovine articular cartilage in compression [J].Journal of Biomechanics,2003,36:339-353.
[17]华泽钊,任禾盛.低温生物医学技术[M].北京:科学出版社,1994.
[18]Rubinsky B,Cravalho EG,Mikic B.Thermal stresses in frozen organs[J].Cryobiology,1980,17:66-73.
[19]Hua TC,Xu HY,Zhou GY.Analyses of thermal stress and fracture during cryopreservation of blood vessel[J].Science in China(Series E),2001,2:170-176.
[20]Jimenez Rios JL,Rabin Y.Thermal expansion of blood vessels in low cryogenic temperatures PartⅡ:Vitrification with VS55,DP6,and 7.05 M DMSO [J].Cryobiology,2006,52:284-294.
