HA混合生物玻璃制备TCP陶瓷支架及其性能的研究
2012-08-13郑卫
郑 卫
(温岭工业园区管委会,温岭 317500)
引言
在过去的十年里,骨组织工程学已经成功作为处理骨修复的一种重要方法[1]。磷酸钙陶瓷与骨骼成分相似且具有优良的生物特性,包括生物兼容性、骨传导性、骨诱导性,被作为骨骼修复的重要材料而广泛应用[2]。但是羟基磷灰石(hydroxyapatite,HA)的力学性能制约了其在骨修复中的应用[3-4]。有资料表示,在陶瓷支架中加入少量纤维,或者混合其他生物材料能增加原来陶瓷的力学性能[5],因此人们开始尝试在HA里面加入生物玻璃来提高HA的力学性能[6]。实验结果表明,生物玻璃能大大提高HA的力学性能,因为其能在烧结过程中液化修补多孔支架裂痕[7]。同时,当生物玻璃的量为2.5~5%时(质量比),在一定温度下烧结,HA支架中会有磷酸三钙(tricalcium phosphate,TCP)出现[8-9],而烧结温度和生物玻璃的量正是控制HA转化成TCP的关键因素。Nezahat等人[3]在文献中指出当HA加入5%生物玻璃时,在烧结过程中会有很多相位变换,而TCP就是其中之一。磷酸三钙以其良好的生物活性与生物可降解性,在骨组织工程学中的应用逐渐得到重视。但TCP制作较HA复杂,因此笔者以HA与生物玻璃为原材料制作TCP支架,不但减少TCP制作的繁冗工序,而且以此方法制得的TCP支架的力学性能将远远超过以粉末制得的TCP支架。而生物玻璃与羟基磷石灰的混合比以及灼烧陶瓷的温度是制作TCP支架的关键环节。
1 材料和方法
1.1 材料
采用塑料制作8 cm×8.5 cm×8.5 cm陶瓷支架的牺牲支架,塑料支架的熔点为105℃[10]。支架中每根管的直径为1 mm,两管间的空隙设计为1.5 mm(图 1)。
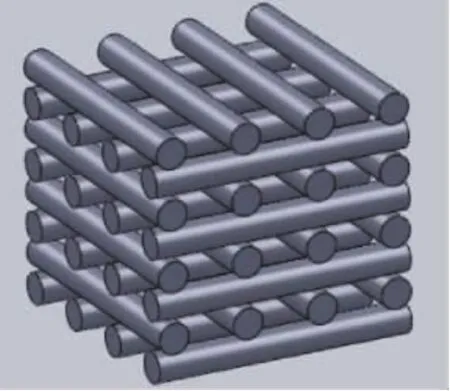
图1 大管支架3D成型图Fig.1 3 D macro-tube scaffold
在生物玻璃与HA混合溶液中,加入一定量的聚乙烯醇(PVA)和磷酸三乙酯(TEP),最后加入少量水使之成为粘稠状,并搅拌1 h使混合物均匀混合。将塑料支架放入蜡溶液中,接着放入 HA/Bioglass混合物中等充分浸透并干燥后,在1400℃下灼烧3 h而制得 TCP生物陶瓷支架,其中PVC、TEP、塑料支架都会在高温下分解。表1是为了研究不同含量的混合物(生物玻璃/HA)在不同温度下烧结所得的支架的成分。实验中所用试剂为Sigma公司产品。

表1 不同生物玻璃的含量在不同温度下烧结Tab.1 Different sintering temperature and the bioglass additions
1.2 支架的表征
1.2.1 支架的孔率
孔隙率的计算可用以下公式[11]:体积密度(ρB)=样品的质量除以样品的体积;TCP理论密度(ρ0)=2.7 g/cm3;相对密度 =(ρB/ρ0) ×100%;孔隙率=100%-相对密度。
1.2.2 支架的收缩率
支架的收缩率可以用以下公式计算:支架收缩率=(O-F)/O;其中O为原来支架的长度;F为烧结后支架的长度。
1.2.3 微量分析
X射线衍射(X-ray diffraction,XRD)用于鉴定陶瓷支架的结晶相。电子显微镜(scanning electron microscopy,SEM)用于观察支架的显微结构、微孔分布以及细胞生长。能谱仪(energy dispersive spectroscopy,EDS)用于分析支架表面生成新物质的化学成分。
1.2.4 力学性能测试
耐压强度是模型测力的一个最主要参数。测力仪器为 Hounsfield Testing Machine(Model:H10K/M527,UK),而之前被切碎用于观察的模型不能再用。将橡胶垫置于模型两端使其均匀受力,测力器以0.5 mm/min速率压下。
1.2.5 模拟体液分析
模拟体液(simulated body fluid,SBF)的制备是根据Kokubo的文献[12]。表2为模拟体液中各微量元素的含量与真正血液中微量元素的含量。
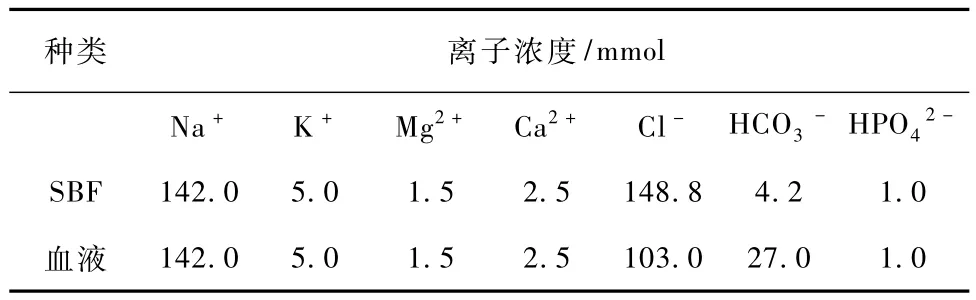
表2 SBF与血液中各微量离子的含量Tab.2 Ion concentrations of SBF and human blood plasma
支架将会被浸泡在37℃的模拟体液中21 d,每隔7 d更换新的SBF。样品的质量与SBF的体积比(mg/ml)为3∶5。21 d之后,将样品拿出 SBF,在室温下用去离子水清洗,最后进行SEM观察。
1.2.6 生物实验
将支架切碎,取小块(约1 mm3)浸入细胞培养基里(dulbecco's modified eagle medium DMEM),每个培养基内有约1×105个骨髓干细胞,在37℃,5%CO2下存放一个星期。7 d后,经过一系列的处理,最后用超临界点烘干机烘干后进入电镜观察阶段。MTT实验是为了观察细胞的增殖情况,实验中分成两组,一组的培养基里细胞和支架同时存在;作为比较,另外一组的培养基里只有细胞。
2 结果与讨论
2.1 支架成分确定与显微结构
从表3中可以看到,将20%的生物玻璃加入HA中,经过1400℃的灼烧,能获得TCP陶瓷支架。当温度没有达到1400℃或者生物玻璃与HA的成分比不够的时候,HA在生成TCP的同时,也转化生成了其他磷酸钙盐。
在烧结过程中,不同相的产生是根据温度和时间的变化。当温度在850~1200℃时,HA会经历以下的变化[14-15]:
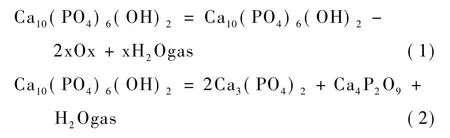
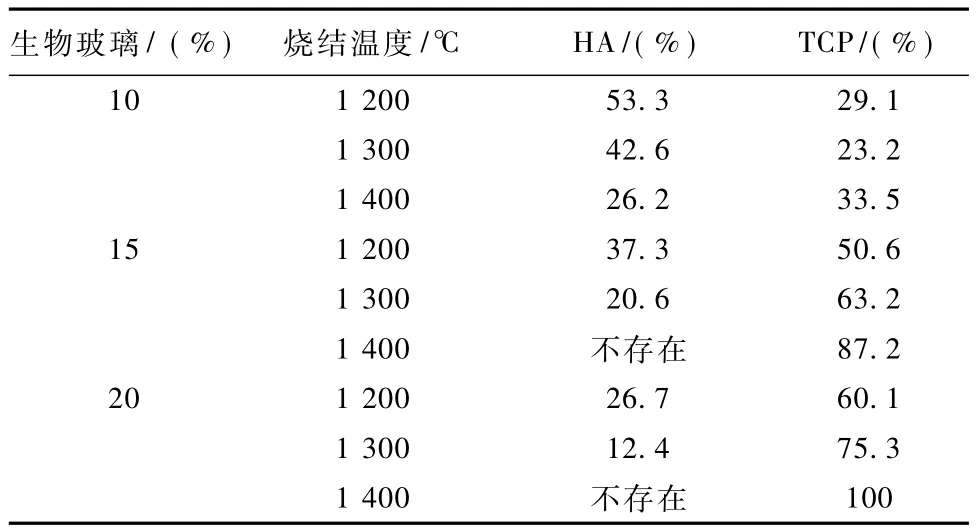
表3 X衍射分析,当HA加入不等量生物玻璃后在不同温度烧结后下支架的成分Tab.3 XRD phase analysis data for composites of HA with the addition of 10,15,and 20wt%bioglass
当温度上升到1400℃时形成的磷酸钙盐会进一步生成Ca3(PO4)2(TCP),但是大多数都是α相,而当支架降温的时候α-TCP会变成β-TCP。同时有资料显示,由于弹性应变α相也会保留在相变过程中[16]。因此,最后得到的TCP支架同时含有 α-TCP与β-TCP,这可以用X射线衍射分析证明(图2)。
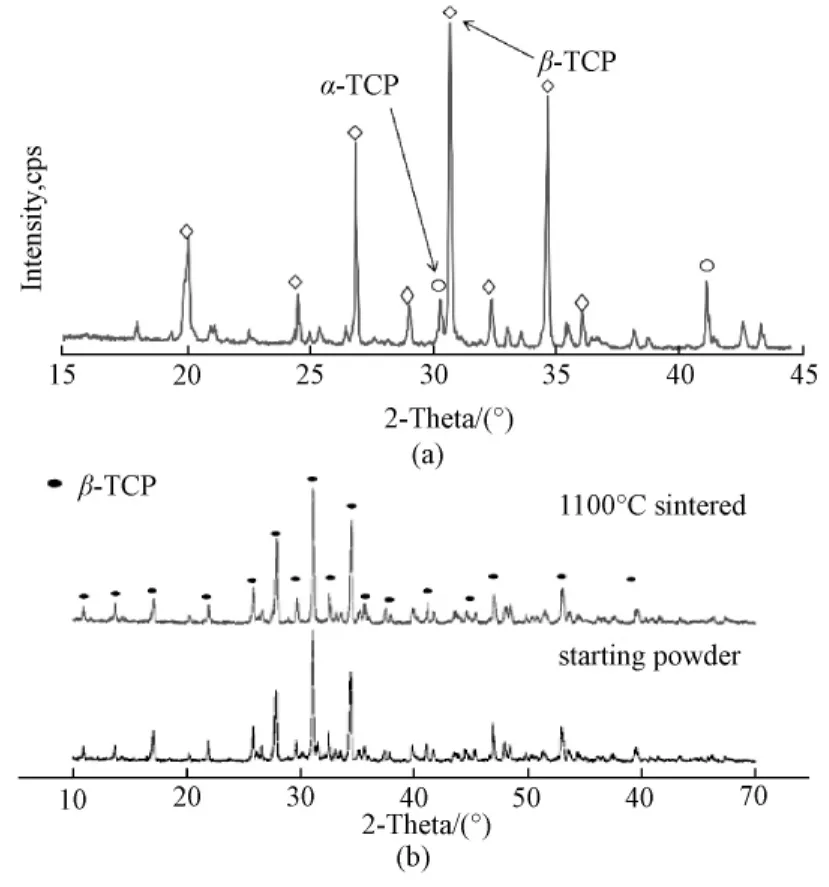
图2 TCP的衍射分析图。(a)用此方法制得TCP衍射分析(大部分为β-TCP);(b)β-TCP粉末在烧结前(下)后(上)的衍射分析[13]Fig.2 Comparison of XRD patterns.(a)XRD pattern for a sintered porous calcium phosphate(mainly β-TCP)sample;(b)XRD patterns of β-TCP starting powder and sintered body[13]
在图3中可以看到,支架上还有一些不规则的裂痕和小孔。孔产生的原因有4点:(1)难以确定支架内部是否灌实;(2)蜡的升华;(3)陶瓷晶粒的局部团聚;(4)根据化学反应式(1)和式(2),HA分解有少量水蒸气产生。
裂纹的出现是由于陶瓷晶体的团聚产生,加上ABS塑料在高温下膨胀。蜡的预涂层是为了给ABS塑料的膨胀提供空间,只是预防措施,而不能避免其膨胀,所以在烧结过程中,ABS塑料的膨胀,其力会作用在陶瓷上。同时,在高温下陶瓷会出现收缩现象,两作用力下产生裂纹。

图3 多孔大管支架电镜观察Fig.3 Overview of the macro-tube TCP scaffold
3.2 支架的收缩率与孔隙率
烧结后支架的孔隙率大约为63%,大管是主要造成孔隙率较高的原因。支架的收缩率为28%,其原因在于混合陶瓷会在800℃开始形变收缩,从800℃到1150℃的之间的形变率超过25%,在1150℃后陶瓷基本不发生变化,而随着温度的上升,陶瓷晶粒的增大会引起支架小幅变化。一般情况下,孔隙率的提高会影响支架的力学性能,直接用TCP粉为原料,同样的成形和升温条件下制备多孔TCP块体,在孔隙率相近的情况下,其抗压强度比较本实验方法制备的块体低。生物玻璃在烧结过程中起了重要的作用,首先,作为反应物与HA反应生成TCP,使晶体结构发生改变,晶粒重排,使产物强度提高。

图4 以HA/生物玻璃制得TCP的微观结构。(a)800倍;(b)1600倍Fig.4 SEM micrograph of a fracture surface of the porous TCP showing the presence of micro-pores.(a)800×;(b)1600×
其次从图4可以观察到以HA/生物玻璃为原材料所制备的TCP多孔支架,表面的孔相对以TCP粉末制得的支架的孔(见图5)较少,其原因是生物玻璃在700℃开始融化,随着温度升高生物玻璃液相附在支架表面,填补了部分空隙,使晶体粘接在一起,在烧结后以 TCP晶体附在支架表面,增强了支架的机械强度。

图5 以TCP粉末制得的TCP微观结构Fig.5 TCP microstructure,depicting pore size and surface area[17]
3.3 多孔支架的力学测试
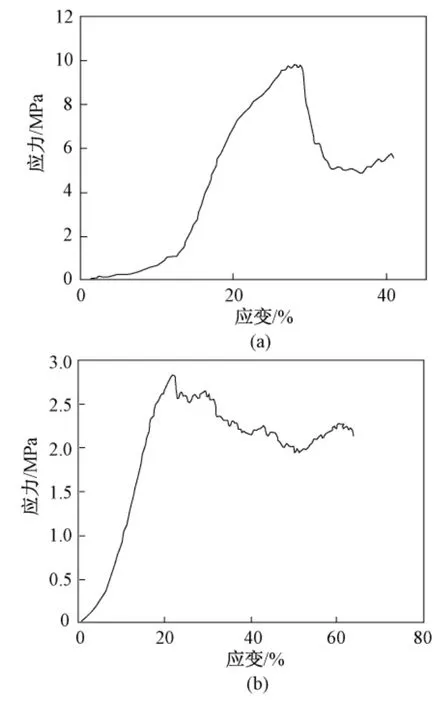
图6 支架的受力曲线图。(a)用HA/生物玻璃制得的TCP支架;(b)用TCP粉末制得的TCP支架Fig.6 Compressive stress-strain curve.(a)Sintered HA/Bioglass made porous TCP sample;(b)Sintered TCP powder made porous TCP sample
图6(a)是用HA与生物玻璃混合制得的多孔TCP支架受力曲线,图中可以看到,支架最大可承受的压强为9.98 Mpa;图6(b)为直接用TCP粉末制得支架曲线,此曲线是多孔结构中典型的脆性破坏曲线,其受压强度为2.96 MPa。表4为正常人体骨骼的骨密质与骨松质的各项参数,可以发现用本实验方法制得的TCP支架虽然没有达到骨密质的强度,但已经可以作为骨松质的替代材料,而孔隙率(63%)也已满足骨松质的要求。因此,此法制得的支架具有良好应用前景。

表4 骨骼的各项基本参数Tab.4 Summary of mechanical properties and porosity of human bone
3.4 支架在模拟体液中的情况
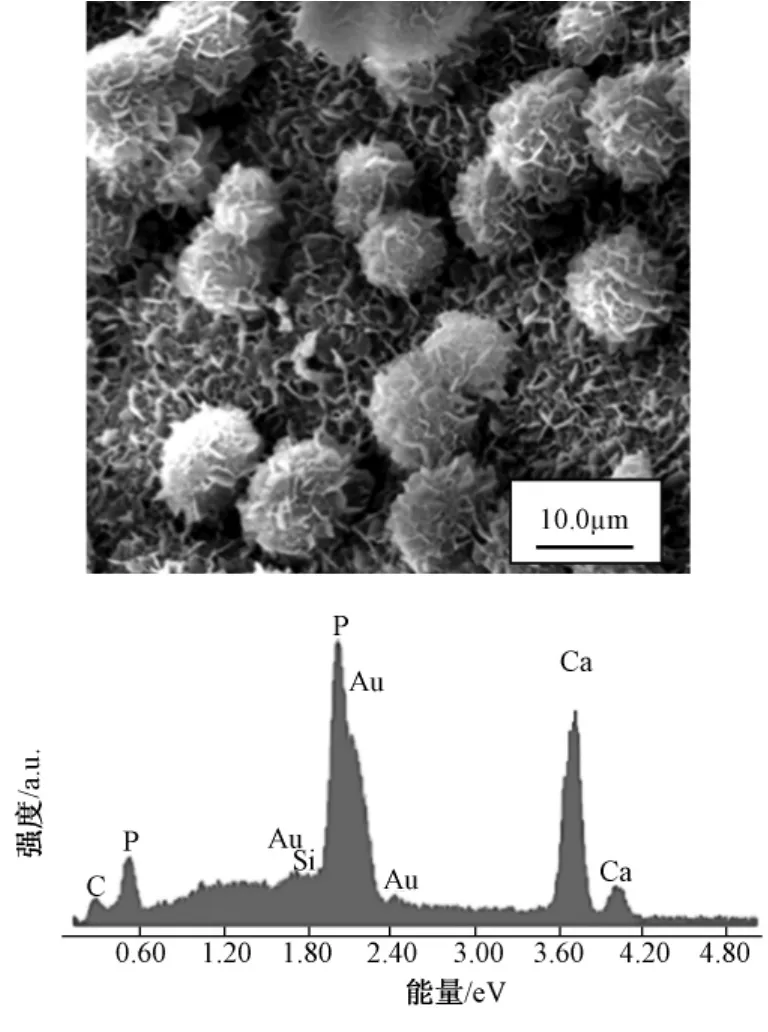
图7 支架在SBF溶液中浸泡21 d后实用电子显微镜观察与支架表面EDS分析。(a)放大4000倍(b)支架表面EDS分析Fig.7 SEM image of the scaffold after soaking in SBF for 21 days(a)4000×;(b)EDS spectra of the surfaces of TCP
图7a是支架在模拟体液(SBF)里浸泡了21天后的结果。在显微镜中可以发现支架表面已变得粗糙,同时可以发现一些小圆球在支架上生成。为了研究这些小圆球的化学成分,对支架表面又进行了能谱分析。分析后的结果见图6(b),从图中可以看到,这些圆球上含有大量的 P、Ca,而且他们原子成分比大约为1.65,这个特征同样在HA里能发现,因此可以证明此小球为 HA;而只有高生物活性的材料在模拟体液中才能生成 HA[25];因此可以断定用上述办法制得的TCP支架拥有很高的生物活性。
3.5 生物实验
3.5.1 细胞生长观察
将支架浸入含有骨髓干细胞的悬浮液(dulbecco's modified eagle medium,DMEM)中,可以发现,可见部分细胞粘附在材料表面,细胞的长势良好,形态非常正常,呈现了良好的生物相容性。同时也出现了一些圆球状晶状体,经材料表面沉积物的EDS分析此为磷酸钙盐。它对骨的形成和生长非常有利,此现象也证明了材料的生物学性能良好(图8)。
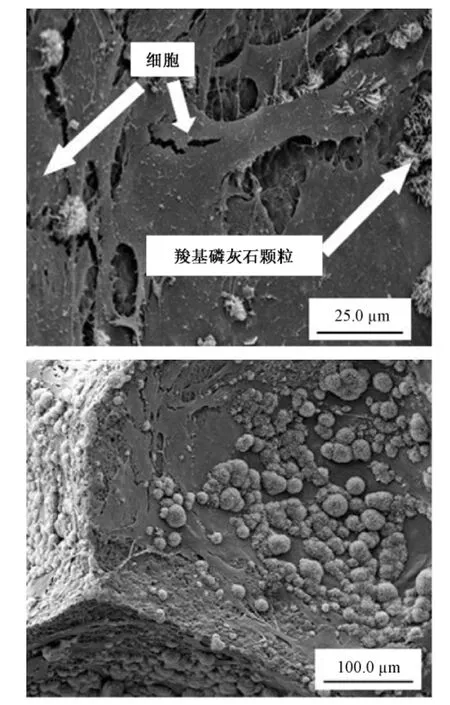
图8 细胞在TCP支架上的生长状况。(a)2000倍;(b)500倍Fig.8 SEM micrograph shows the attachment of the cells on TCP ceramic strut surface.(a)2000×;(b)500×
经过分析,有两种可能会导致这样的情况发生,首先是这个溶液含有牛血清,里面含有一定的与SBF相同的离子,其次TCP支架在培养基中也慢慢释放出P、Ca离子,形成了SBF溶液,支架在浸放了21 d后,表面出现磷酸钙盐晶体。为了研究此晶体的形成与细胞的关系,作为比较,将支架浸入无细胞的培养基内,经过21 d的浸泡,在没有细胞的情况下,此晶体同样会出现(图9)。因此,磷酸钙盐晶体的形成与细胞的存在没有关系。

图9 TCP支架在培养基里浸泡后Fig.9 SEM micrograph showed the TCP ceramic scaffold immersed into the medium without cell
3.5.2 细胞增殖实验
用甲基偶氮唑蓝(MTT)比色法检测细胞增殖抑制情况是评价材料有无毒性的一个重要手段,图9为通过9 d的培养细胞的增殖情况,在阴性对照组中,培养基里有同样数量的细胞,在同样的环境条件生长。在图中可以看到通过9 d的培养,两组细胞都有明显的增长,但是在前6 d有TCP组的增长速率明显快于对照组,而6 d后细胞增长速率大致相同。因此,用上述办法制得的TCP不但没有毒性,而且展示了良好的生物相容性。
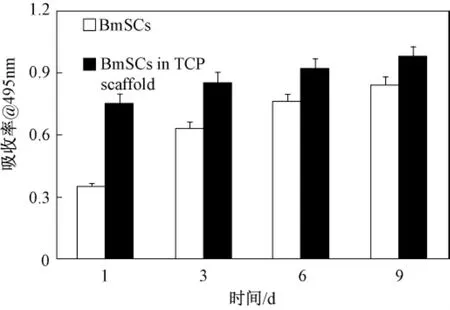
图10 细胞增殖实验结果,误差线为平均值±标准偏差,n=3Fig.10 MTT assay for proliferation of hBMSCs and hBMSCs combined with TCP scaffolds at different incubation periods under the same culture condition.Error bars represent mean±SD for n=3
4 结论
较之用TCP粉末直接制得的TCP支架,以HA与生物玻璃为原材料制得的TCP陶瓷支架不仅具有良好的力学性能,更接近正常骨骼所需要的强度,而且该支架材料能促进细胞增殖,观察细胞长势良好,表现出良好的生物相容性,用HA和生物玻璃来制作TCD支架是将来骨修复的一个重要研究方向。
[1]Cao Y,Croll TI,Lees JG,et al.Scaffolds,stem cells,and tissue engineering: A potent combination [J]. Journal of Chemistry,2005,58(10):691-703.
[2]Marra KG,Szem JW,Kumta PN,et al.In vitro analysis of biodegradable polymer blend/hydroxyapatite composites for bone tissue engineering[J].Journal of Biomedical Materials.1999,47(3):324-335.
[3]Nezahat K,Cuneyt A.Synthesis of calcium hydroxyapatite tricalcium phosphate(HA/TCP)composite bioceramic powders and their sintering behavior[J].J Am Ceram.Soc,1998,81(9):2245-2252.
[4]Jarcho M.Clinical orthopaedics and related research[J].Clin Orthop Rel Res,1981,157(187):259-278.
[5]Halouani R,Bernache AD,Champion E,et al.Microstructure and related mechanical properties of hot pressed hydroxyapatite ceramics [J]. Journal of Material Science: Materials in Medicine,1994,5:563-568.
[6]Santos JD,Reis RL,Monteiro FJ,et al.Liquid phase sintering of hydroxyapatite by phosphate and silicate glass additions:structure and properties of the composites[J].Journal of Material Science:Materials in Medicine,1995,6:348-352.
[7]Knowles JC,Bonfield W.Development of a glass reinforced hydroxyapatite with enhanced mechanical properties and its relationship to phase changes [J].J Biomed Mat Res,1993,27:1591-1598.
[8]Santos JD, Knowles JC, Reis RL. et al. Microstructural characterization of glass-reinforced hydroxyapatite composites[J].Biomaterials,1994,15:5-10.
[9]Santos JD,Jha LJ,Monteiro FJ.In vitro calcium phosphate formation on SiO2-Na2 O-CaO-P2 O5 glass reinforced hydroxyapatite composite:a study by XPS analysis[J].Journal of Material Science:Materials in Medicine,1996,7:181-185.
[10]Plastic Properties of Acrylonitrile Butadiene Styrene(ABS).http://www.dynalabcorp.com/technical_info_abs.asp
[11]Miao X,Huang X,Yan C.Preparation and characterization of interpenetrating phased TCP/HA/PLGA composites [J].Materials Letters,2005,59:4000-4005.
[12]Kokubo T.P-rich layer formed on high-strength bioactive glassceramic A-W[J].J Biomed Mater Res,1990,24(3):331-343.
[13]Chen B,Zhang Z,Zhang J,et al.Fabrication and mechanical properties of β -TCP pieces by gel-casting method [J].Materials Science and Engineering:C,2008,28:1052-1056.
[14]Royer JC, Viguie M, Heughebaert JC. Stoichiometry of Hydroxyapatite:influence on the flexural strength [J].J Mater Sci:Mater in Med,1993,4:76-82.
[15]Wang PE,Chaki TK.Sintering behaviour and mechanical properties of hydroxyapatite and dicalcium phosphate[J].J Mater Sci:Mater in Med,1993,4:150-158.
[16]Miao X,Tan LP,Tan LS.Porous calcium phosphate ceramics modified with PLGA-bioactive glass[J].Materials Science and Engineering:C,2007,27:274-279.
[17]Evalina LB, Vikas P. Calcium phosphates as bone graft extenders[J].Orthopedics,2007,30(11):939.
[18]Keaveny T,Hayes W.Mechanical properties of cortical and trabecular bone[M]//Bone Growth.Boca Raton:CRC Press,1993:285-344
[19]Zioupos P,Currey JD.Changes in the stiffness,strength,and toughness of human cortical bone with age [J].Bone,1998,22:57-66.
[20]Sedlin E.A rheologic model for cortical bone-a study of physical properties of human femoral samples[J].Acta Orthop Scand,1965,83:1-77.
[21]Dong XN,Guo XE.The dependence of transversely isotropic elasticity of human femoral cortical bone on porosity[J].J Biomech,2004,37:1281-1287.
[22]Giesen E,Ding M,Dalstra M,et al.Mechanical properties of cancellous bone in the human mandibular condyle are anisotropic[J].J Biomech,2001,34:799-803.
[23]Rohl L,Larsen E,Linde F,et al.Tensile and compressive properties of cancellous bone[J].J Biomech,1991,24:1143-1149.
[24]Yeni Y,Fyhrie D.Finite element calculated uniaxial apparent stiffness is a consistent predictor of uniaxial apparent strength in human vertebral cancellous bone tested with different boundary conditions[J].J Biomech,2001,34:1649-54.
[25]Jun IK,Song JH,Choi WY,et al.Porous hydroxyapatite scaffolds coated with bioactive apatite wollastonite glass ceramics[J].Journal of the American Ceramic Society,2007,90:2703-2705.
