饲料中硝基呋喃类药物免疫胶体金检测试纸条的研制
2012-08-09
(北京勤邦生物技术有限公司,北京102206)
硝基呋喃类药物(Nitrofurans)是一类人工合成的具有5-硝基呋喃基本结构的广谱抗生素,主要包括呋喃唑酮(furazolidone)、呋喃西林(nitrofurazone)、呋喃妥因(nitrofurantoin)、呋喃它酮(furaltadone),主要用于敏感菌所致的细菌性痢疾、肠炎、球虫病的预防和治疗。硝基呋喃类药物具有较强的致癌、致突变、致畸等副作用,严重危害人体健康,欧盟和日本均已禁止在食品中使用硝基呋喃类药物,我国也规定在饲料生产中全面禁用[1-3]。
目前硝基呋喃类药物残留的检测方法主要有高效液相色谱法[4-5],超高效液相色谱串联质谱[6]、液相色谱-紫外法[7-8]、酶联免疫法[9-10]等,上述检测方法操作繁琐,成本高,并且需要由受过专业训练的技术人员来完成,不适合现场监控和大量样本筛查。试纸检测方法具有操作简单,检测所需时间短,携带方便,灵敏度高等优点,适合现场大量样本的快速筛查。
1 材料与方法
1.1 试剂
氯金酸、柠檬酸三钠、甲醇等化学试剂均购自北京化学试剂公司;呋喃西林、呋喃唑酮、呋喃妥因、呋喃它酮、牛血清白蛋白、卵清蛋白购自sigma公司。
1.2 仪器
磁力加热搅拌器(常州国华生产),数控切条机CT300(上海金标生产)、连续式划膜仪HM8000(上海金标生产),其余均为实验室常规仪器。
1.3 方法
1.3.1 试验动物
8周龄的雌性Balb/C小鼠。
1.3.2 硝基呋喃类药物半抗原合成
取2-醛基-5-硝基呋喃1.41 g与氨基丁酸2.0 g溶入150 ml甲醇中,加入10 ml三乙胺,室温下反应10~20 h,稀盐酸酸化,乙酸乙酯萃取,蒸除溶剂后,柱层析得到硝基呋喃类药物半抗原。
1.3.3 硝基呋喃类药物免疫抗原和包被抗原的合成
1.3.3.1 免疫抗原合成
取上述步骤得到的硝基呋喃类药物半抗原18mg,溶解于1.5 ml N,N-二甲基甲酰胺(DMF)中;取36mg碳化二亚胺(EDC)用0.2 ml水充分溶解后,加入上述DMF中,室温下搅拌24 h,得到Ⅰ液;称取OVA60mg,使之充分溶解在5.3 ml PBS(pH值7.2)中,得到Ⅱ液;将上述得到的Ⅰ液逐滴缓慢滴加到Ⅱ液中,并于室温下搅拌24 h;用0.01 mol/l PBS,4℃透析3 d每天换3次透析液,以除去未反应的小分子物质,分装,于-20℃保存备用。
1.3.3.2 包被抗原合成
取上述步骤得到的硝基呋喃类药物半抗原25mg,溶解于1.5 ml DMF中,取50mg EDC用0.2 ml去离子水充分溶解后,加入上述DMF中,室温下搅拌24 h,即可得到Ⅲ液;称取BSA 60mg,使之充分溶解在4.3 ml PBS(pH值7.2)中,得到Ⅳ液;将Ⅲ液逐滴缓慢滴加到Ⅳ液中,并于室温下搅拌24 h,用0.01 mol/l PBS 4℃透析3 d每天换3次透析液,以除去未反应的小分子物质,分装,于-20℃保存备用。
1.3.4 生产硝基呋喃类药物单克隆抗体的制备
用150 μg的硝基呋喃类药物免疫抗原与等量FCA混合制成乳化剂,颈背部皮下多点注射。二免和三免时,将FCA换成FIA剂量和方法同上,每次免疫间隔时间为2周,三免后第7 d,小鼠尾部静脉采血,室温静置1 h,4 ℃过夜,12 000 r/min离心10 min,收集血清,4℃保存,用间接ELISA法测定血清效价,待效价较高时,按照150 μg/只的剂量腹腔注射加强免疫。3 d后取小鼠脾脏进行细胞融合,以有限稀释法筛选阳性克隆,并按照常规方法制备腹水抗体,用饱和硫酸铵法纯化。用SDS-PAGE法进行纯化后的硝基呋喃类药物单克隆抗体电泳检测,浓缩胶浓度为5 g/100 ml,分离胶浓度为10 g/100 ml,浓缩胶电压为80 V,分离胶电压为100 V,结果见图1。

图1 抗体电脉鉴定
纯化的单克隆抗体经SDS-PAGE显示,在变性解链状态下有两条带,一条为轻链,位于24.5 kD处;一条为重链,位于50.0 kD处,纯度较高,浓度较大,无杂蛋白,抗体纯化效果较好。
1.3.5 免疫胶体金试纸主要反应条件的确定
1.3.5.1 胶体金的制备
用双蒸去离子水将1%氯金酸稀释成0.01%,置于磁力加热搅拌器上搅拌煮沸,每100 ml 0.01%氯金酸加入2 ml、1%柠檬酸三钠,继续煮沸,至液体呈红色时停止加热,冷却至室温后补足失水,用肉眼观察,可见胶体金溶液外观呈酒红色,均匀度较好、无杂质、透明度较高。用电镜扫描,胶体金颗粒的粒径为20 nm左右,结果见图2。
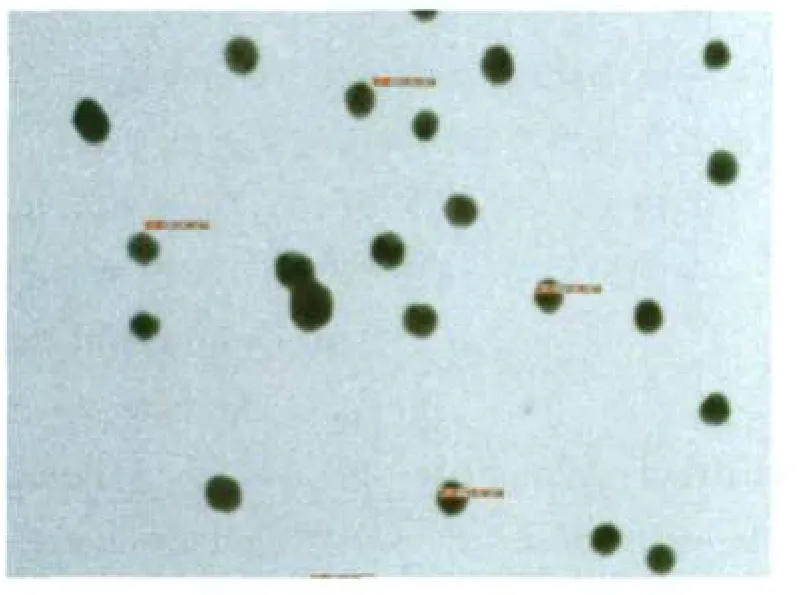
图2 胶体金电镜扫描
1.3.5.2 胶体金标记抗体
在磁力搅拌下,用0.1 mol/l碳酸钾调胶体金的pH值至8.2,按每毫升胶体金50~100 μg抗体的标准向胶体金溶液中加入硝基呋喃类药物单克隆抗体,继续搅拌混匀30 min,加入10%BSA至BSA在胶体金溶液中的终浓度为1%,静置30 min。12 000 r/min,4℃离心30 min,弃上清液,沉淀用含有0.1%牛血清白蛋白,0.08%吐温-80和0.3%吡咯烷酮的复溶缓冲液洗涤2次,用体积为初始胶体金体积1/20的复溶缓冲液将沉淀重悬,得到的金标抗体溶液,置4℃备用。将羊抗鼠二抗点样于硝酸纤维素膜上,直接与金标抗体反应,可见有明显的粉红色斑点,表明金标抗体有活性。
1.3.5.3 硝酸纤维素膜的选择
将抗原适当稀释后通过点样方式分别包被在milipore90、milipore135和mdi70三种硝酸纤维素膜上,经干燥、组装试纸条后,发现不同孔径及厂家的硝酸纤维素膜点样后,均能显色,但显色程度略有不同,milipore135显色最深,milipore90和 mdi70差别不大,milipore135层析速度较慢,不利于样本层析,milipore90试剂展开速度较milipore135快,但不及mdi70。mili⁃pore90与mdi70上检测线显色情况相差不多,但mdi70背景颜色较浅。综合层析速度与显色情况,三种硝酸纤维素膜中,mdi70更符合检测要求。
1.3.5.4 结合垫、样品垫和吸水垫的选择
分别取BX-SB06、WFB、QXLM三种不同材质材料作为结合垫及样品垫组装试纸条,在结合垫处滴加2 μl、10%的金标抗体,滴加70 μl的阴性饲料样品液,QXLM对饲料样本的吸收能力较好,层析速度较快且显色较深,故选择QXLM作为结合垫和样品垫。吸水垫选择吸水能力较好,质地均匀的Cotton linters300,厚度2.59。
1.3.5.5 结合垫的包被
将结合垫浸泡于pH值7.2,含有5%牛血清白蛋白,0.05 mol/l磷酸盐缓冲液中浸湿1 h,37℃烘2 h;用划膜仪将金标抗体包被在结合垫上,每1 cm结合垫包被0.01 ml金标抗体,置于37℃环境中60 min后取出,置于4℃环境中保存备用。
1.3.5.6 样品吸收垫的处理
将样品吸收垫置于pH值7.2,含2%小牛血清,1%活性剂,0.2 mol/l磷酸盐缓冲液浸泡2 h,37℃环境中2 h后备用。
自以为瞒天过海,常常暗自庆幸,他哪里想到,他的一切举动尽在妻子掌握之下。那么她拍这些照片要干什么呢?其动机似乎不完全是为了拿到自己背叛的证据。既然有了确凿的证据,为什么迟迟不向自己摊牌呢?仔细回味,妻子似乎没什么反常啊?她怎么会如此镇定?看来他低估了妻子的能力,低估了妻子的心机。
1.3.5.7 硝酸纤维素膜的处理与包被
用pH值7.2,0.01 mol/l磷酸盐缓冲液将包被抗原稀释到1mg/ml,用划膜仪将其包被于硝酸纤维素膜的检测线(T线),包被量为1 μl/cm;用pH值7.2,0.01 mol/l磷酸盐缓冲液将羊抗鼠二抗稀释到1mg/ml,用划膜仪将其包被于硝酸纤维素膜上的质控线(C线),包被量为1 μl/cm。
1.3.5.8 包被原包被时间的确定
在硝酸纤维素膜上包被抗原后,置于37℃烘箱中干燥,时间设置为30 min、1 h、2 h、4 h、8 h、12 h,待满足干燥时间后,同时对阴性饲料样本进行检测,从节约时间及成本考虑,选择包被抗原的硝酸纤维素膜在37℃干燥8 h。
1.3.5.9 金标抗体干燥条件的确定
用pH值7.2,0.01 mol/l磷酸盐缓冲液将金标抗体稀释到1∶2,取5 μl涂布在结合物垫上,分别置于室温、37 ℃条件下干燥,时间设置为10、20、30、60、120 min,结合垫在室温、37℃下干燥时间大于30 min时检测结果差异不显著,为减少外界因素对试验的影响,最终选择37℃下干燥60 min作为结合垫干燥条件。
1.3.5.10 检测线(T)、质控线(C)包被浓度及线宽的确定
利用已确定包被液将抗原与羊抗鼠二抗分别进行不同倍数稀释,并制备成试纸条检测,综合考虑阴性显色程度与阳性样本添加测试确定在硝酸纤维素膜上的抗原浓度为0.09mg/ml,线宽为0.12 μl/cm,羊抗鼠二抗浓度为0.13mg/ml,线宽为1.0 μl/cm。
试纸条组装按照常规检测试纸条组装模式[11]。
2 结果与分析
2.1 饲料样本的前处理
称取(1.0±0.05)g饲料样品至聚苯乙烯离心管中,加入5 ml、50%甲醇水溶液,涡动,静置,取上清液用于检测。
2.2 试纸条技术指标的测定
2.2.1 试纸条检测限
在空白饲料样本中添加0、2.5、5、10 μg/kg的呋喃唑酮,0、1、3、6 μg/kg的呋喃它酮,0、1、2、4 μg/kg的呋喃西林,0、1、2、4 μg/kg的呋喃妥因,取试纸条进行检测,每个样本重复测定3次。
对呋喃唑酮的测试结果为:滴试0、2.5 μg/kg浓度时,试纸条上显示出肉眼可见的两条红色条线,呈阴性,当滴试5、10 μg/kg浓度的标准液时试纸条检测线不显色,呈阳性,表明,本试纸条对呋喃唑酮的检测限为5 μg/kg;
对呋喃它酮的测试结果为:滴试0、1 μg/kg浓度时,试纸条上显示出肉眼可见的两条红色条线,呈阴性,当滴试3、6 μg/kg浓度的标准液时试纸条检测线不显色,呈阳性,表明,本试纸条对呋喃它酮的检测限为3 μg/kg;
对呋喃西林的测试结果为:滴试0、1 μg/kg浓度时,试纸条上显示出肉眼可见的两条红色条线,呈阴性,当滴试2、4 μg/kg浓度的标准液时试纸条检测线不显色,呈阳性,表明,本试纸条对呋喃西林的检测限为2 μg/kg;
对呋喃妥因的测试结果为:滴试0、1 μg/kg浓度时,试纸条上显示出肉眼可见的两条红色条线,呈阴性,当滴试2、4 μg/kg浓度的标准液时试纸条检测线不显色,呈阳性,表明,本试纸条对呋喃妥因的检测限为2 μg/kg。
2.2.2 试纸条假阳性率的测定
取空白饲料(不含有硝基呋喃药物)样本50份,将饲料样本前处理后用试纸条进行检测,每个样本重复测定2次,结果有1份试纸条的检测结果为阳性,试纸条检测饲料样本的假阳性率为2%。
2.2.3 试纸条假阴性率的测定
取阳性饲料(呋喃唑酮含量≥5 μg/kg)样本50份,阳性饲料(呋喃它酮含量≥3 μg/kg)样本50份,阳性饲料(呋喃西林含量≥2 μg/kg)样本50份,阳性饲料(呋喃妥因含量≥2 μg/kg)样本50份,用试纸条进行检测,每个样本重复测定2次,结果试纸条的检测结果均为阴性,试纸条检测饲料样本的假阴性率为0。
2.2.4 实际样本的试纸条检测结果与高效液相色谱[12]检测结果的比较
采集50份饲料样本,每种称取1 g于离心管中,加50%的甲醇水溶液10 ml,涡动,静置,取上清液检测。先用本实验研制试纸条进行初筛,然后用高效液相色谱法进行复核。试纸条检测结果表明50份饲料样本中43份为阴性,其余7份为阳性;试纸条检测结果和高效液相色谱检测结果的阳性符合率为100%。
2.2.5 保存性实验
将制作好的试纸条置于铝箔袋中,加干燥剂密闭包装,分别置于4℃、37℃、室温(20~25 ℃)条件下,其中置于4℃和室温条件的试纸条每隔7 d取出两组,置于37℃每天取出两组,分别检测阴性饲料样本和阳性饲料样本(含有2 μg/kg的呋喃西林)。观察检测线的有无,颜色深浅及玻璃纤维素膜上金标抗体的释放程度,4℃和室温条件下的保存试验持续3个月,37℃条件下保存试验持续7 d。确定试纸条的保存条件是置于铝箔袋中抽真空、加干燥剂室温密闭保存。
3 小结
硝基呋喃类药物作为抗生素,其残留通过食物链严重危害人体健康,各国都对其残留做出限量要求。本研究制备了硝基呋喃类药物单克隆抗体,建立了硝基呋喃类药物胶体金免疫层析检测试纸条方法。结果表明,该试纸条检测方法对饲料中呋喃唑酮的检测限为5 μg/kg,对饲料中呋喃它酮的检测限为3 μg/kg,对饲料中呋喃西林的检测限为2 μg/kg,对饲料中呋喃妥因的检测限为2 μg/kg;本方法试纸条对饲料样本检测的假阳性率为2%,假阴性率为0;与仪器方法检测结果的阳性复核率为100%;单个样本的检测时间仅需10 min。本试纸条产品,检测时不需要复杂的仪器设备,样本前处理简单,检测成本低,检测效率高,适合于大规模的现场筛查。
[1]贾涛.高效液相色谱法检测饲料中的硝基呋喃类药物[J].检测分析,2011,16:33-37.
[2]祝伟霞,刘亚凤,梁伟.动物性食品中硝基呋喃类药物残留检测研究进展[J].动物医学进展,2010,31(2):99-102.
[3]曹莹,张文刚,黄士新,等.饲料中4种硝基呋喃类药物的检测方法研究[J].中国农业科技导报,2008,10(S2):32-34.
[4]王蕾,鲍恩东.饲料中硝基呋喃类药物高效液相色谱检测方法的建立[J].中国农业大学学报,2011,16(2):125-132.
[5]宋凯,肖桂英,姜桥,等.高效液相色谱法同步测定饲料及兽药中4种硝基呋喃类药物[J].粮食与饲料工业,2010,3:49-51.
[6]徐英江,任传博,田秀慧,等.海产品中硝基呋喃类原药的超高效液相色谱串联质谱测定[J].分析测试学报,2010,4:327-330.
[7]McCracken R J,Kennedy D G.Determination of furazolidone in animal feeds using liquid chromatography with UV and thermospray mass spectrometric detection[J].Journal of Chromatography A,1997,771:349-354.
[8]Jorge Barbosa,Sara Moura,Rita Barbosa,Determination of nitrofu⁃rans in animal feeds by liquid chromatography-UV photodiode ar⁃ray detection and liquid chromatography-ionspray tandem mass spectrometry[J].Analytica chimica acta,2007,586(1):359-365.
[9]李军,张会彩,刘聚祥,等.酶联免疫吸附检测动物饲料中呋喃唑酮[J].中国兽医杂志,2009,45(8):85-86.
[10]蒋宏伟.酶联免疫技术在动物产品中硝基呋喃类药物残留检测的应用[J].陕西农业科学,2006,5:53-55.
[11]魏文平,龚振明.胶体金免疫层析法检测兽药残留的原理和方法[J].黑龙江畜牧兽医,2007,8:41-43.
[12]农业部1486号公告-8-2010.饲料中硝基呋喃类药物的测定高效液相色谱法农业部[S].
