生防菌株B9601-Y2对作物生长和产量的影响
2012-08-09程少丽张俊祥何月秋李顺德
程少丽 ,张俊祥,何月秋 ,3,李顺德
(1.山东招远市果业总站,265400;2.云南农业大学农业生物多样性国家工程中心;3.云南农业大学农业与生物技术学院;4.云南玉溪市农业局)
当前农业生产的发展趋势是减少化学肥料和农药的使用,让已脆弱的农业生态系统和生态环境得以恢复,而日益增长的人口又需要全球农业产量持续提高,生物菌肥的开发和利用为解决人口、环境和粮食安全之间的矛盾提供了建设性的出路[1,2]。植物促生长细菌 (plant growth-promoting rhizobacteria,PGPB)是能够促进植物生长的一类有益细菌[3,4],它可通过氮的固定[5]、土壤养分的溶解[6]、植物激素的产生[7,8]、乙烯合成的抑制[9]和提高植物对寒冷[10]、盐[11]、重金属毒性[12]和农药的忍耐能力[4,13]直接促进植物生长,也可通过位点竞争[14]、产生抗生素[15]和诱导系统抗性[16]等机制保护植物免受植物病原菌的为害和降低其为害程度,间接促进植物生长。解淀粉芽孢杆菌植生性亚种 (Bacillus amyloliquefacienssubsp.plantarium) 菌株B9601-Y2(下称Y2菌株)是具有广谱抑菌作用[17,18]及促进植物生长作用[19]的极具广泛开发应用前景的专利菌株(专利号:ZL200310104195.6)。本研究的重点是获知PGPB菌株解淀粉芽孢杆菌植生性亚种Y2菌株在田间的应用效果,探讨其在农业生产中作为生物肥料的潜力,为生物菌肥的开发与利用提供依据。
1 材料与方法
1.1 试验材料
①供试菌株 Y2水剂(3.2×109cfu/mL,由云南农业大学云南省植物病理重点实验室分离);对照菌株:解淀粉芽孢杆菌植生性亚种菌株FZB42(下称FZB42)悬浮剂(2.5×1011cfu/mL,Abitep GmbH 公司生产,已在欧洲登记的微生物肥料产品)。
②参试作物 番茄,2次试验品种均为绿亨108金樽(北京中农绿亨种子科技有限公司);黄瓜,第一次试验品种为冬冠(华远农业发展有限公司),第二次试验品种为绿优2号(日本引进品种,进口贸易许可证第A19258);玉米,2次试验品种均为会单4号。
1.2 试验设计
①番茄和黄瓜试验 试验在山东省招远市罗峰办事处郭家埠园艺场的日光温室中进行。温室为钢架塑料大棚(长×宽=63 m×9 m,567 m2),试验地土壤为棕壤,肥力上等。共设7个处理,处理1:FZB42悬浮剂200倍液;处理2:FZB42悬浮剂400倍液;处理3:FZB42悬浮剂 600倍液; 处理 4:Y2水剂 200倍液;处理5:Y2水剂400倍液;处理6:Y2水剂600倍液;处理7:等量清水对照(CK)。每个处理3次重复,随机排列。小区面积为8.4 m2(1.2 m×7 m)。起垄覆膜栽培,株距33 cm,小行距40 cm,大行距80 cm。
番茄第一次试验在定植前7 d往各处理的育苗杯(上口直径10 cm×高10 cm)中倒入20 mL稀释液;第二次试验于定植前14 d和21 d分别往各处理的育苗杯中倒入20 mL稀释液。黄瓜2次试验均于定植前15 d往各处理的育苗杯中倒入20 mL稀释液。
②玉米试验 试验地点为云南省玉溪市峨山县大龙潭乡司城村。试验地土壤为红壤土,肥力中等。试验共设4个处理:处理1:Y2水剂500倍液拌种;处理2:Y2水剂500倍液灭活后拌种;处理3:FZB42悬浮剂500倍液;处理4:清水拌种(CK)。播种前拌种、晾干,清水或菌液稀释液用量为种子量的1/50。平整土地,打塘施肥和播种。各小区面积66.7 m2,4次重复,完全随机区组排列。采用宽窄行播种,大行距80 cm,小行距40 cm,株距25 cm。
1.3 数据调查与分析
黄瓜、番茄播种后90 d,测定各处理黄瓜、番茄的株高、茎粗(离地60 cm处直径),各小区分次采摘,记录产量和果数。玉米在播种后的第10天,调查出苗率、苗高;播种后40 d调查叶片数。在收获前各小区随机5点取样,各点取2株,调查株高和取回雌穗,晒干后烤种,其他雌穗一并采收晒干,称质量测产。
所有数据均采用SASv 6.2软件统计分析,但百分率数据均经反正弦转换后,再行统计。
2 结果与分析
2.1 PGPB菌株Y2对黄瓜生长性状和产量的影响
试验结果(表1)表明,菌株Y2和FZB42处理的黄瓜株高、茎粗、单果质量和产量都显著或极显著高于对照。与对照相比,Y2水剂200倍液、400倍液、600倍液小区产量增产率分别达9.5%~12.6%,5.9%~6.4%和 2.6%~6.4%;FZB42悬浮液 200倍液、400倍液、600倍液小区产量增产率分别达7.6%~9.3%,10.3%~11.2%,4.9%~12.6%。不过,不同处理与对照间单果质量无显著差异。
2.2 PGPB菌株Y2对番茄生长性状和产量的影响
试验结果(表2)表明,菌株Y2和FZB42处理的番茄株高、茎粗、单果质量和产量都显著或极显著高于对照。与对照相比,Y2水剂200倍液、400倍液、600倍液,小区产量增产率分别达18.9%~24.8%,9.5%~16.9%,10.6%~17.3%;FZB42悬浮液 200倍液、400倍液、600倍液小区产量增产率分别达11.5%,19.6%,10.0%~20.1%,7.8%~14.4%。
2.3 PGPB菌株Y2对玉米生长性状和产量的影响
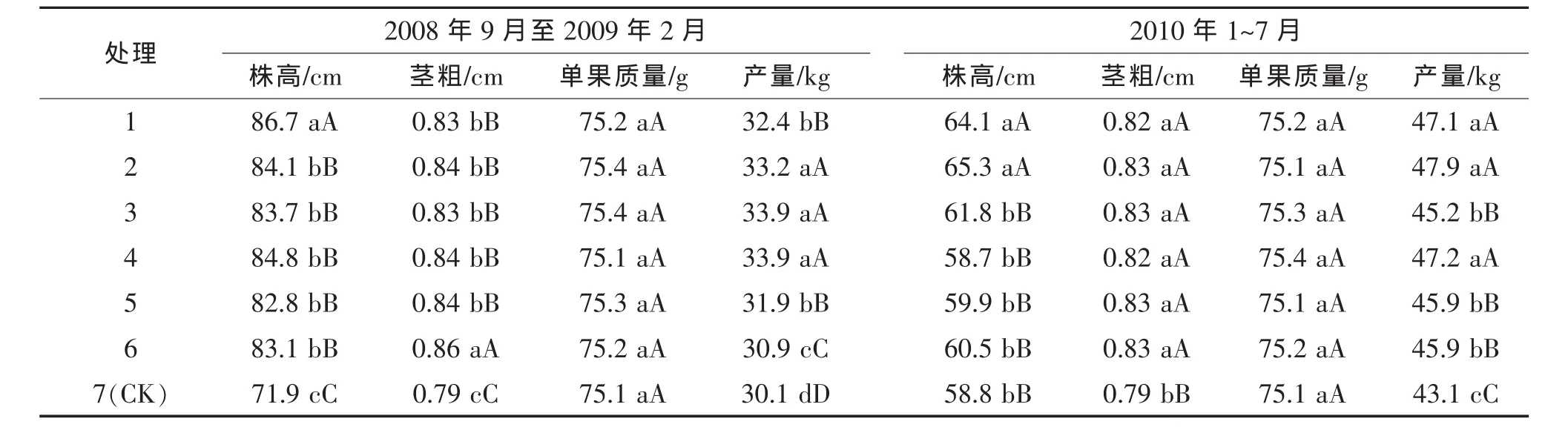
表1 PGPB菌株处理后的黄瓜植株和产量性状
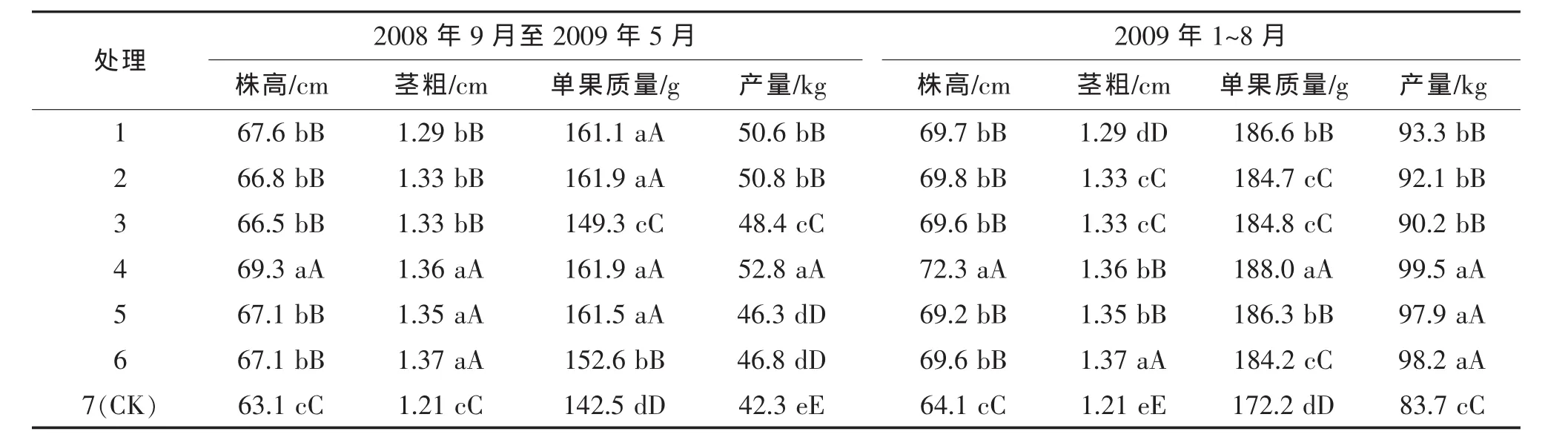
表2 PGPB菌株处理后番茄植株和产量性状
试验结果(表3)表明,菌株Y2和FZB42处理的玉米出苗率、叶片数、株高、穗位高、穗粗、穗行粒、穗长、千粒质量和产量均显著或极显著高于对照。Y2水剂 500倍液处理、Y2水剂 500倍液灭活处理和FZB42悬浮剂500倍液处理与对照处理相比,增产率分别达 7.3%~11.5%,5.1%~5.4%和 6.2%~8.9%。与对照相比,Y2水剂500倍液处理出苗率提高2.3%~3.7%、叶片数增加17.9%~21.6%、株高增加8.1%~10.5%、穗位高提高22.4%~33.7%、穗行粒数增加6.3%~16.7%、穗粗增加1.5%~3.6%、穗长增加4.6%~8.7%、千粒质量增加0.9%~3.1%。
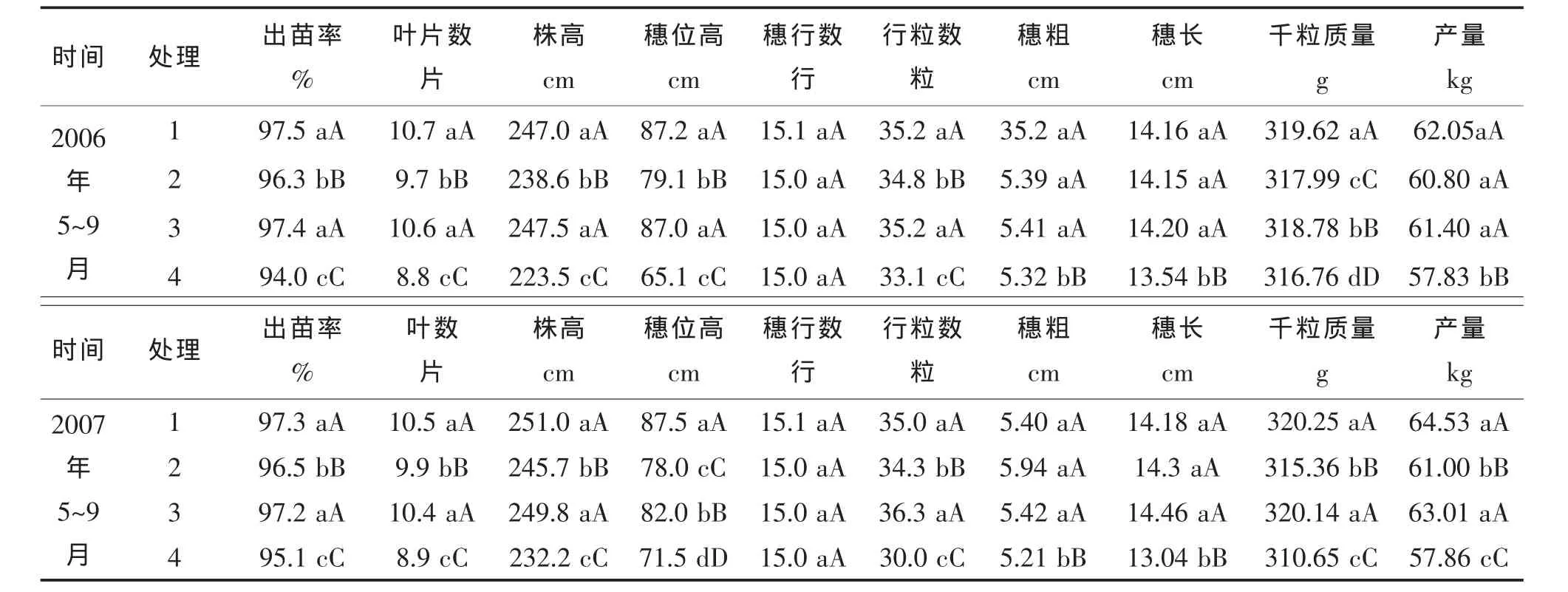
表3 PGPB菌株对玉米植株性状及产量的影响
3 结论与讨论
能够促进植物生长的PGPB已被广泛报道[20,21]。植物的根能为PGPB提供定殖场所,其渗出液和消融产物又为PGPB提供了生存、繁殖所需的营养物质。PGPB在获得植物提供的营养物质的同时,也为植物提供其所需的营养物质或者是提供促进植物生长的植物生长调节物质。以前的室内试验表明,B9601-Y2对植物生长具有促进作用[17],这次试验结果再次证实了接种该菌株后,作物生长加快,产量显著增加。
在田间,接种PGPB菌株B9601-Y2后,作物形态发生改变,在黄瓜、番茄上表现出株高增加、蔓茎加粗;在玉米上,表现出株高和叶片数增加。产生的原因可能是B9601-Y2菌株对作物的光合作用产生了积极影响。植物的光合作用酶活力与叶绿素含量和植物激素的含量密切相关[22],叶绿素浓度增加是光合作用增强的一个重要原因,而在一定程度上,光合作用强弱决定了作物的生产力。
接种菌株B9601-Y2对黄瓜单果质量没有明显影响,这主要是因为在黄瓜采摘过程中,通常按照要求的规格(大小一致)进行采摘。PGPB菌株提高黄瓜产量主要体现在结果数的增加上,Utkhede等[23]用Bacillus subtilisBACT-0接种黄瓜的试验结果也显示,其主要是提高黄瓜的坐果率,从而增加结果数。B9601-Y2菌株对玉米果穗的穗行数没有影响,这与Zaied等[24]报道的植物促生菌(如Azospirillum和A-zotobacter)不能增加玉米穗行数的结果一致。试验结果也显示,玉米接种B9601-Y2菌株虽不能增加果穗的穗行数,但显著增加穗粗、穗长以及行粒数。
Kloepper等[25]报道,植物促生菌的效果可能会受到环境条件(例如土壤类型、养分状况以及土壤温湿度)影响表现不稳定。本试验结果显示,B9601-Y2菌株无论是在南方的红壤土,还是在北方的棕壤土均表现出良好的促生长效果,且2次试验结果增长效果差异不大,这说明B9601-Y2菌株具有较强的环境适应能力以及稳定的增产效果。
作为FZB42的同一个亚种细菌 (Bacillus amyloliquefacienssubsp.plantarium)[26],B9601-Y2 促进植物生长的机制可能与FZB42有很多相似之处,如增加了土壤中固定态磷的溶解[27],提高磷的活性,使难溶性磷逐渐转化为游离态的磷,供植物吸收利用;产生植物激素促进植物生长发育[28]。B9601-Y2菌株具有的广谱抑菌作用也抑制了植物病原菌以及其他有害微生物的侵染繁殖,间接地促进植物生长[18,19]。此外,本试验以及以前的试验研究显示,B9601-Y2菌株的使用浓度低于FZB42菌株使用浓度的100倍,却与FZB42取得了相似的促生长效果,这可能暗示了B9601-Y2具有良好的定殖能力和更好的促生长能力[29]。
[1]Haggag W M.Sustainable agriculture management of plant diseases[J].J Biol Sci,2002,2(4):280-284.
[2]Selvakumar G,Mohan M,Kundu S,et al.Cold tolerance and plant growth promotion potential ofSerratia marcescens strain SRM (MTCC 8708)isolated from flowers of summer squash (Cucurbita pepo)[J].Lett Appl Microbiol,2008,46(2):171-175.
[3]Glick B R.The enhancement of plant growth by free-living bacteria[J].Can J Microbiol,1995,41(2):109-117.
[4]Bloemberg G V,Lugtenberg B J J.Molecular basis of plant growth promotion and biocontrol by rhizobacteria[J].Curr Opin Plant Biol,2001,4(4):343-350.
[5]Han J G,Sun L,Dong X Z,et al.Characterization of a novel plant growth-promoting bacteria strainDelftia tsuruhatensis HR4 both as a diazotroph and a potential biocontrol agent against various plant pathogens[J].Syst Appl Microbiol,2005,28:66-76.
[6]Rodriguez H,Fraga R.Phosphate solubilizing bacteria and their role in plant growth promotion[J].Biotechnol Adv,1999,17:319-339.
[7]Bottini R,Cassán F,Piccoli P.Gibberellin production by bacteria and its involvement in plant growth promotion and yield increase[J].Appl Microbiol Biotechnol,2004,65:497-503.
[8]Nassar A H,Khaled A E,Krishnapillai S.Promotion of plant growth by an auxin-producing isolate of the yeast Williopsis saturnusendophytic in maize(Zea maysL.)roots[J].Biol Fertil Soils,2005,42:97-108.
[9]Correa J D,Barrios M L,Galdona R P.Screening for plant growth-promoting rhizobacteria inChamaecytisus proliferus(tagasaste),a forage tree-shrub legume endemic to the Canary Islands[J].Plant Soil,2004,266:261-272.
[10]Katiyar V,Goel R.Solubilization of inorganic phosphate and plant growth promotion by cold tolerant mutants of Pseudomonas fluorescens[J].Microbiol Res,2003,158(2):163-168.
[11]Mayak S,Tirosh T,Glick B R.Plant growth-promoting bacteria confer resistance in tomato plants to salt stress[J].Plant Physiology and Biochemistry,2004,42(6):565-572.
[12]Wani P A,Khan M S,Zaidi A.Effect of metal-tolerant plant growth-promotingRhizobiumon the performance of pea grown in metal-amended soil[J].Arch Environ Contam Toxicol,2008,55:33-42.
[13]Glick B R,Bashan Y.Genetic manipulation of plant growth-promoting bacteria to enhance biocontrol of phytopathogens[J].Biotechnol Adv,1997,15(2):353-378.
[14]Hammond-Kosack K E,Jones J D G.Resistance genedependent plant defense responses[J].The Plant Cell,1996,8:1 773-1 791.
[15]DeGray G,Rajasekaran K,Smith F,et al.Expression of an antimicrobial peptide via the chloroplast genome to control phytopathogenic bacteria and fungi[J].Plant Physiol,2001,127:852-862.
[16]van Loon L C,Bakker P A H M,Pieterse C M J.Systemic resistance induced by rhizosphere bacteria [J].Annu Rev Phytopathol,1998,36:453-483.
[17]和凤美,何月秋,朱永平.生防菌B9601的防治效果研究[J].西南农业大学学报,2002,24(4):312-314,336.
[18]汪澈,何月秋,张永庆.枯草芽孢杆菌B9601-Y2抑菌蛋白活性及产生条件的研究[J].植物病理学报,2005,35(1):30-36.
[19]和凤美,何月秋,唐文华,等.生防菌株B9601对促进植物生长作用的研究 [J].中国农学通报,2002,18(4):62-64.
[20]Barka E A,Belarbi A,Hachet C,et al.Enhancement of in vitro growth and resistance to gray mold of Vitis vinifera co-cultured with plant growth-promoting rhizobacteria[J].FEMS Microbiol Lett,2000,186:91-95.
[21]Ramamoorthy V,Viswanathan R,Raghuchander T,et al.Induction of systemic resistance by plant growth promoting rhizobacteria in crop plants against pests and diseases[J].Crop Prot,2001,20:1-11.
[22]Tsenova E.Physiological effects of synthetic growth regulator Tidiasuron in high plants[J].Plant Physiol,1990:250-265.
[23]Utkhede R S,Koch C A,Menzies J G.Rhizobacterial growth and yield promotion of cucumber plants inoculated withPythium aphanidermatum [J].Can J Plant Pathol,1999,21:265-271.
[24]Zaied K A,Abd El-Hady A H,Sharief A E,et al.Effect of horizontal DNA transfer inAzospirillumandAzotobacterstrains on biological and biochemical traits of nonlegume plants[J].J Appl Sci Res,2007,3(1):73-86.
[25]Kloepper J W,Lifshitz R,Zablotowicz R M.Free-living bacterialinocula forenhancing crop productivity[J].Trends Biotechnol,1989,7:39-44.
[26]Borriss R,Chen X H,Rueckert C,et al.Relationship of Bacillus amyloliquefaciensclades associated with strains DSM7Tand FZB42T:a proposal forBacillus amyloliquefacienssubsp.amyloliquefacienssubsp.nov.andBacillus amyloliquefacienssubsp.plantarumsubsp.nov.based on complete genome sequence comparisons [J].Int J Syst Evol Microbiol,2010,61:1 786-1 801.
[27]Camilo A R,Joseph W K.Plant growth promotion by Bacillus amyloliquefaciensFZB45 depends on inoculum rate and P-related soil properties [J].Biol Fertil Soils,2010,46(8):835-844.
[28]Idris E E,Iglesias D J,Talon M,et al.Tryptophan-dependent production of Indole-3-Acetic Acid (IAA)affects level of plant growth promotion byBacillus amyloliquefaciensFZB42[J].Mol Plant-Microb Interact,2007,20:619-626.
[29]张俊祥,程少丽,吴兴兴,等.生防菌株B9601-Y2促进植物生长和防治辣椒青枯病研究[C]//彭友良,朱有勇.中国植物学会2009年学术年会论文集.北京:中国农业科技出版社,2009:589.
