赤霉素和6-BA对苦豆子种子萌发生理特性的影响
2012-08-09张春梅王勤礼李志颜马小兵
闫 芳,张春梅 ,王勤礼,李志颜,马小兵
(1.河西生态与绿洲农业研究院,甘肃张掖 734000;2.河西学院农业与生物技术学院,甘肃张掖 734000;3.天津市大港油田第一矿区园林绿化管理公司,天津 300280)
苦豆子(Sophora alopecuroides L.),别名草本槐或苦豆根,为豆科槐属多年生草本植物,能清热、解毒、消肿止痛,具有较强的耐旱性、耐盐碱和抗风沙性能(王进等2007),是我国西北荒漠地区广泛分布的一种重要的防风固沙和改良盐碱地的优良中旱生野生植物(张守润等2008)。苦豆子种子硬实率极高,不利于其正常萌发繁殖(王进等2007)。随着土地荒漠化加剧,植被破坏和过度放牧,我国的苦豆子野生资源量也急剧下降(李爱华等2000)。
用植物生长调节剂处理种子,提高种子活力,增强种子在逆境中的出苗萌发率的技术已在各种蔬菜、果类植物上得到很好的应用(祁燕蓉等2008)。赤霉素是种子中的重要物质,可促进种子发育及调控种子的休眠和发芽。6-苄基腺嘌呤(6-BA)可促进细胞分裂,诱导芽的分化,延迟植株衰老、延长贮藏期和保鲜、提高发芽率等(王磊等2010)。目前,有关苦豆子的研究主要围绕在药用方面,对于苦豆子的生物学及生态学等方面的研究则主要集中于种子形态特征及发芽条件、组织培养、发芽特性与种子休眠等方面(张福平等2008)。然而,由于分布区的特殊性,对苦豆子种子萌发生理特性的研究到目前为止报道较少。为此,本试验结合生产实践,以甘肃张掖市的苦豆子种子为材料,研究了不同时间与质量浓度的外源赤霉素和6-BA浸种对苦豆子种子发芽率、萌发生理特性和幼苗生长特征的影响,为苦豆子的栽培利用和其种子加工处理提供理论参考。
1 材料与方法
1.1 试验材料
采集于甘肃省张掖市西郊黑河岸边的苦豆子种子,除去杂质,晒干,千粒重为22.667g,用纸袋包装,放置于阴凉干燥处密封保存,待用。
生长调节剂:赤霉素,含量为92%;6-BA,含量为99.6%,购自北京化学试剂公司。
试验于2012年12月至4月在河西学院农业与生物技术学院实验室进行。
1.2 试验仪器及试剂
恒温培养箱,培养皿,滤纸,镊子,砂纸,种子筛,孔穴盘,沙土,移液管,洗耳球,容量瓶等。
0.1mol/L稀盐酸,65%的H2SO4,蒸馏水等。
1.3 试剂的配制
以0.1 mol/L稀盐酸为溶剂,分别配制50 mg/L,100 mg/L,150 mg/L,200 mg/L,250 mg/L 的赤霉素和 20 mg/L,40 mg/L,60 mg/L,80 mg/L,100 mg/L的6-BA,待用。
1.4 种子的处理
发芽试验按照国家标准《农作物种子检验规程》的方法进行(朱进等2008)。各发育阶段种子发芽率测定采用纸上发芽法(LI D等2006)。从供试的种子中选取大小、形状、色泽一致且饱满、成熟、无病害的苦豆子种子500粒,先用清水冲洗干净,吸干水分,然后用75%的乙醇浸泡30 min,取出用0.01%的HgCl2消毒3 min,再用65%的 H2SO4处理20min,然后用蒸馏水冲洗数次后放入培养皿中,分别加入15 mL配制好的不同浓度的赤霉素和6-BA浸种4,8 h,最后再放入铺有3层滤纸作为发芽床的培养皿中,每皿放10粒。以相同量蒸馏水浸种作为对照。将种子均匀摆放,加盖,置于培养箱内进行培养,培养温度为(25±0.5)℃ ,相对湿度80%,每天光照8 h。注意保持滤纸湿度。以胚根突破种皮2 mm以上作为发芽标准,逐日统计发芽种子粒数。每处理50粒种子,重复3次。
各取200粒种子,用以上方法消毒后,分别在浓度为200 mg/L的赤霉素溶液和浓度为60 mg/L的6-BA下浸种8 h,以蒸馏水为对照,然后播种于装有沙子的孔穴盘中,并不断补充水份,每穴播放5粒种子,重复2次,播种14 d、21 d后统计出苗率。
1.5 数据统计与处理
第6 d测定种子发芽势,第10 d测定种子发芽率。
发芽势(%)=6 d内发芽的种子个数/50(供试种子数)×100%
发芽率(%)=10 d内发芽的种子个数/50(供试种子数)×100%
出苗率(%)=出苗数/200(植入总粒数)×100%
所有数据均用Microsoft Office Excel录入,并作图。采用SPSS 13.0 for Windows统计软件进行数据分析。
2 结果与分析
2.1 赤霉素对苦豆子种子发芽势和发芽率的影响

表1 赤霉素处理4 h对苦豆子种子发芽力的影响
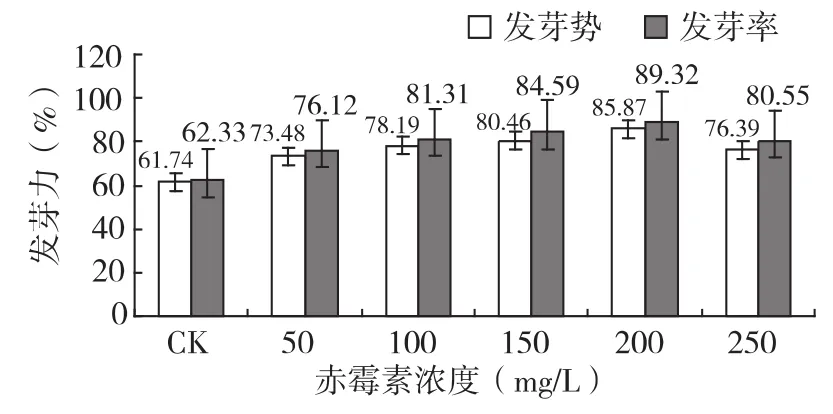
图1 赤霉素处理8h对苦豆子种子发芽力的影响
从表1、图1可以看出,经不同时间不同浓度赤霉素处理的苦豆子种子发芽势、发芽率均高于对照,各处理的种子发芽势、发芽率与对照相比差异显著,在所选浓度范围内,赤霉素浸种处理苦豆子种子,其发芽势、发芽率随处理浓度的升高而增加,而且相同浓度的赤霉素浸种8 h,发芽势、发芽率均高于浸种4 h。其中,200 mg/L赤霉素处理苦豆子种子4 h的发芽势达到80.44%,比对照提高了19.87%,发芽率达到85.26%,比对照提高了20.9%。200 mg/L赤霉素处理苦豆子种子8 h,发芽势达到了85.87%,比对照提高了24.13%,发芽率达到了89.32%,比对照提高了26.99%。从整体趋势看,在赤霉素浓度在50 mg/L~200 mg/L之间,苦豆子种子发芽势、发芽率随浓度的升高而增加,当浓度大于200 mg/L时,发芽势、发芽率随浓度的升高而降低,因此,在赤霉素的浓度为200 mg/L,浸种8 h,苦豆子种子发芽势和发芽率最高,此时效果最好。由此可说明,在一定浓度范围内,赤霉素处理可促进苦豆子种子的萌发,而且增加其浸种时间也可以提高苦豆子种子的萌发。
2.2 6-BA对苦豆子种子发芽势和发芽率的影响
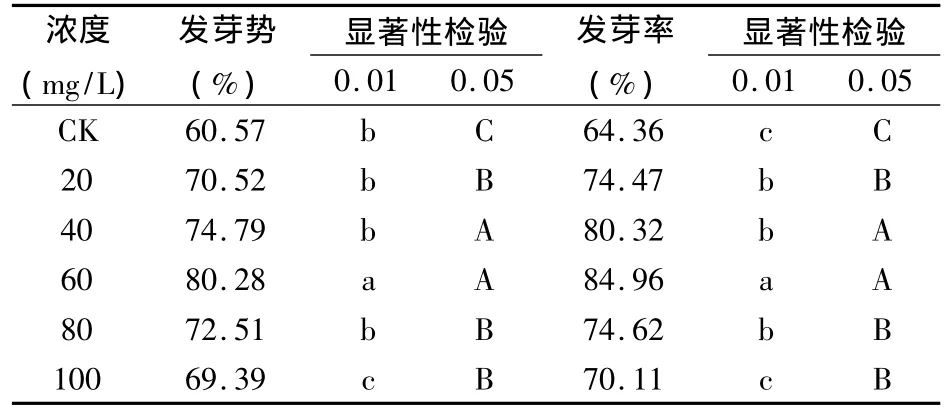
表2 6-BA处理4 h对苦豆子种子发芽力的影响
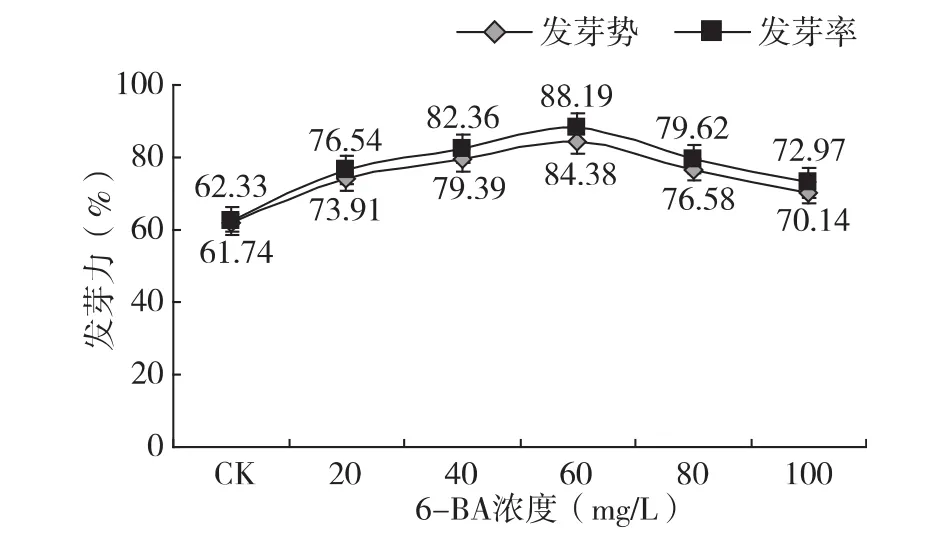
图2 6-BA处理8 h对苦豆子种子发芽力的影响
从表2和图2可以看出,经不同时间、不同浓度6-BA处理的苦豆子种子发芽势、发芽率均高于对照,其中各处理的苦豆子种子发芽势、发芽率与对照相比差异显著。在20~60 mg/L的浓度范围内,6-BA浸种处理苦豆子种子,其发芽势、发芽率随浓度的升高而增加;当浓度大于60 mg/L时,发芽势、发芽率随浓度的升高而降低,在所选浓度范围内,6-BA浸种处理苦豆子种子,其发芽势、发芽率随处理浓度的升高而增加;而且相同浓度的6-BA浸种8 h发芽势、发芽率均高于浸种4 h,其中,60 mg/L 6-BA处理苦豆子种子4 h的发芽势达到80.28%,比对照提高了19.71%,发芽率达到84.96%,比对照提高了20.60%;60 mg/L 6-BA处理苦豆子种子8 h,发芽势达到了84.38%,比对照提高了22.64%,发芽率达到了88.19%,比对照提高了25.86%。由此可说明,在一定浓度范围内,6-BA处理可促进苦豆子种子的萌发,而且增加其浸种时间也可以提高苦豆子种子的萌发。因此,在 6-BA浓度为60 mg/L,浸种8 h的条件下,种子发芽率和发芽势最高,此时效果最好。
2.3 赤霉素和6-BA对苦豆子种子出苗率的影响
从表3可知,分别用200 mg/L的赤霉素和60 mg/L的6-BA进行处理,播种14d和21d后苦豆子种子的出苗率均显著高于对照,但两处理间差异不显著。
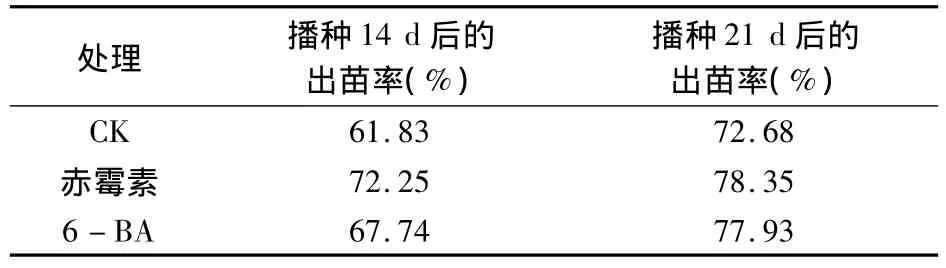
表3 赤霉素和6-BA处理对苦豆子种子出苗率的影响
3 结论与讨论
许多植物的休眠种子,随着休眠的解除,其脱落酸(ABA)等抑制萌发的活性物质含量水平下降,而细胞分裂素(6-BA)、赤霉素(GA3)等促进萌发的活性物质含量开始剧增(鱼小军等2005)。赤霉素(GA3)、6-苄氨基嘌呤(6-BA)均能促进多种植物种子的萌发,提高种子活力种子的萌发是一个复杂的过程,至今尚未能清楚地阐明其调控机制,但因处理浓度及植物种类的不同会有不同的处理效果(裴东升2008)。因此,必须正确掌握所用植物生长调节剂的种类及施用浓度,才能达到促进植物种子萌发的效果(张福平等2010)。在一般条件下,苦豆子实生种子可能已具备萌发的各种条件,能够合成和转化形成各种激素,但是这些激素都处于被束缚状态,即所谓的休眠状态,处于休眠的种子在播种后不能立即发芽,致种子休眠的因子有光、温度、湿度、氧等外因子,还有种皮、胚、激素等内因子(胡小文等2009)。用一定浓度激素(赤霉素、细胞分裂素、生长素等)浸泡种子,能打破种子的休眠,促进种子萌发,提高种子的发芽率(赵美华等2009)。研究表明,赤霉素的促进作用在于提高了种子内部的IAA水平,然后通过IAA在其中直接起促进作用,反映了其对生长素IAA合成起着一种调节作用,从而促进种子的萌发,而6-BA能促进细胞的分裂和器官的分化,本身就能促进种子的萌发。发芽势指种子的发芽速度和发芽整齐度,表示种子生活力的强弱程度。发芽率指样本种子中发芽种子的百分数,表示种子发芽的多少(彭素琴等2006)。苦豆子种子发芽障碍主要是种皮致密,硬实度大,吸胀困难,用砂纸多次磨擦和硫酸处理能破坏种皮,加速种子吸胀及萌发(杨辉等2009)。
本试验结果表明,不同时间、不同浓度梯度的赤霉素和6-BA对苦豆子种子进行预处理,对种子的萌发均有不同程度的促进作用,且同一激素还受浓度的影响。在一定浓度范围内,赤霉素和6-BA均可提高苦豆子种子的发芽势、发芽率,并且增加浸种时间可以提高种子的发芽势和发芽率,200 mg/L赤霉素处理8 h和60 mg/L 6-BA处理8h时最为合适,可显著提高苦豆子种子萌发的出苗率。赤霉素和6-BA两种激素对幼苗生长的作用效果相似。一般情况下,田间出苗率与实验室发芽率的比值小于1(浙江农业大学,2010)。在本试验中,采用赤霉素和6-BA处理的苦豆子种子出苗率小于其发芽率,符合规律。采用赤霉素最佳浓度(200 mg/L)处理的发芽势和发芽率与6-BA最佳浓度(60 mg/L)处理的结果无显著性差异,可说明两种药剂处理的效果类似。但从经济的角度来看,由于6-BA价格较贵,建议使用200 mg/L的赤霉素处理。
[1]胡小文,武艳培,王彦荣.苦豆子种子休眠的形成及其解剖结构变化[J].西北植物学报,2009,29(1):16-21.
[2]李端,周立刚,王敬国,等,苦豆子提取物对黄瓜和番茄病原菌的抑制作用[J].西北植物学报,2006,26(3):558-563.
[3]李爱华,孙兆军.苦豆子资源开发现状及前景初探[J].宁夏大学学报:自然科学版,2000,21(4):354-356.
[4]贾永华,王飞,张占艳.硫酸和PEG处理对多叶羽扇豆种子萌发和某些生理生化指标的影响[J].西北农业学报,2006,3(79):104-108.
[5]彭素琴,刘郁林.水分胁迫对不同产地金银花种子的发芽的影响[J].福建农林科技,2006,3(55-57):48-51.
[6]裴东升.植物生长调节剂对朱顶红不定芽诱导影响的研究[J].山西农业科学,2008,3(66):62-63.
[7]祁燕蓉,何生虎,史光亮.苦豆子的研究进展[J].甘肃畜牧兽医,2008,38(6):36-38.
[8]王磊,周余华,关雪莲,等.GA3和6-BA对粉绿铁线莲种子发芽特性的影响[J].种子,2010,29(3):44-45.
[9]王进,韩多红,陈叶,等.环境因子对苦豆子种子萌发和幼苗生长的影响[J].草地学报,2007,15(3):259-262.
[10]王进,张勇,陈叶,等.苦豆子种子形态特征及发芽条件研究[J].草地学报,200715(5):486-490.
[11]杨辉,华鹏,黄培祐.苦豆子种子特性与种群扩展关系的研究[J].干旱区资源与环境,2006,20(1):198-201.
[12]鱼小军,王芳,龙瑞军.破除种子休眠方法的进展[J].种子,2005,24(7):46-49.
[13]赵美华,薛娟,逯保德.不同浓度赤霉素对十字花科蔬菜种子发芽,出苗及活力的影响[J].山西农业科学,2009,37(2):16-18.
[14]张春庆,王建华.种子检验学[M].北京:高等教育出版社,2006,8:59-62.
[15]张福平,魏玲玲.IAA等对紫罗勒种子发芽及幼苗生长的影响[J].种子,2007,26(10):94-97.
[16]张守润,纪瑛,蔺海明.施氮对苦豆子生物性状和生物量积累动态的响应[J].草业科学,2008,25(3):37-42.
[17]浙江农业大学.蔬菜栽培学总论[M].2版.北京:中国农业出版社,2010,3(8):102-104.
[18]朱进,何标,张道敏,等.高山特色蔬菜山葵高效栽培技术[J].长江蔬菜,2008,(12):10-11.
