紫杉醇脂质体瘤体内给药对荷S180实体瘤小鼠的抑瘤作用
2012-08-08刘宝瑞
陈 凝, 刘宝瑞
紫杉醇是从短叶红豆杉树皮中提取和纯化得到的一种对许多类型的肿瘤细胞具有细胞毒作用的提取物,其化学结构是紫杉烷类中一种四环二萜类化合物。其通过干预肿瘤细胞微管蛋白、停止有丝分裂过程而中断细胞的生长,促使肿瘤细胞发生凋亡[1-2]。紫杉醇难溶于水,目前紫杉醇注射剂多以聚氧乙烯蓖麻油和无水乙醇(1∶1)辅助溶剂增加水溶性,前者有促进组胺释放的作用,常引起严重的过敏反应,临床使用前需给予抗过敏药物并进行心电监护,且需缓慢滴注。采用脂质体为载体,既解决了紫杉醇难溶于水的问题,又因不再使用聚氧乙烯蓖麻油和无水乙醇为溶媒而避免了对人体的毒性反应和过敏反应[3-4]。
脂质体皮下注射后表现出良好的淋巴靶向性和缓释性[5-7]。直径小于100 nm的脂质体能直接进入淋巴管,然后到达区域淋巴结,淋巴吸收可达70%左右;直径较大的脂质体则沉积在注射部位,逐渐降解后,被其包封的药物缓慢释放进入血液循环(见图1)。
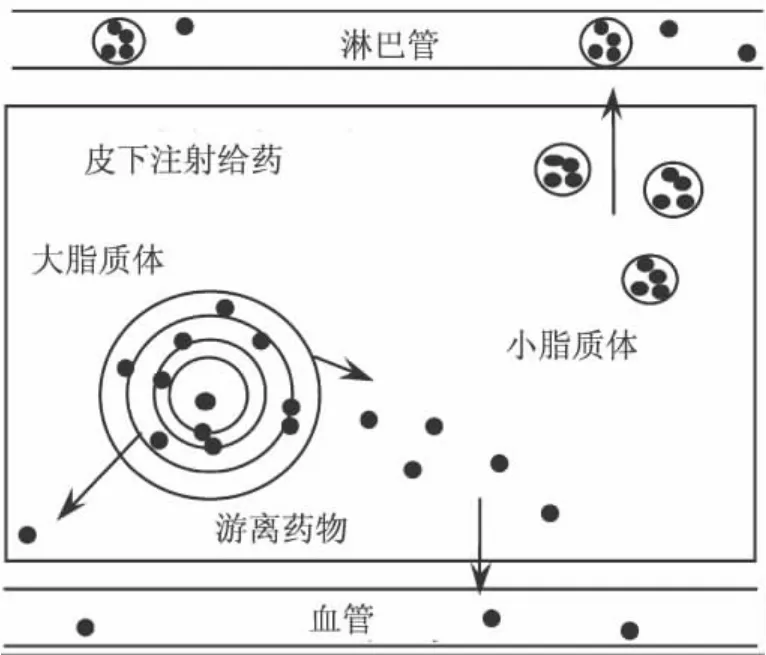
图1 脂质体皮下给药后药物分布示意图
游离药物瘤体内注射后,由于分子粒径小,药物容易从注射部位泄漏;而包裹了化疗药物的脂质体瘤体内注射后,由于分子粒径较大可以在肿瘤局部维持较高的药物浓度并缓慢解放,继而减少全身副作用[8]。用99m锝标记的脂质体瘤体内直接注射后瘤体和瘤周的浓度可达给药总量的50%左右,20 h后瘤体和瘤周的浓度仍有给药总量的40%,而未经脂质体包裹的99m锝在瘤内注射20 h后瘤体和瘤周的浓度只有给药总量的19%[9]。已有试验证明瘤体内直接注射IL-2质粒DNA/阳离子脂质体复合物可抑制小鼠肝癌的生长[10],而紫杉醇脂质体瘤体内注射后对于肿瘤的控制作用国内尚未有报道,据此,我们制备了紫杉醇脂质体,并观察其对昆明鼠瘤体内给药后的疗效。
1 材料与方法
1.1 药品、试剂与仪器 大豆磷脂(北京海淀区生物科技公司),胆固醇(北京海淀区生物科技公司),聚乙二醇二硬脂酰磷脂酰丝氨酸(DSPE-PEG2000,西安力邦制药有限公司),紫杉醇注射液(北京四环制药有限公司),紫杉醇原药(北京协和药厂馈赠),维生素E注射液(上海市第九制药厂),小牛血清(Amersco,美国),胎牛血清(Amersco,美国),1640培养液(Gibco,美国),二甲基亚砜(DMSO)、甲醇、二氯甲烷、乙睛均为分析纯(上海中兴化学品有限公司)。
JY92-II型超声波粉碎仪(宁波新芝生物科技股份有限公司),透析袋(8 000,12 000-14 000,Sorua,德国),超滤膜(Ultracel PL,10.000 NMWL,Millipore,美国)。85-2型恒温磁力搅拌器(常州国华仪器厂),2XE-1真空泵(奉化市飞马电机厂),冷冻干燥机(上海仪表集团),RE-52A旋转蒸发仪(上海亚荣生化仪器厂),超滤器(Stirred Cells 8050,Millipore,美国),UV3100 紫外分光光度计(Shimadzu,日本),恒温槽(ELLY4,TOKYO Rikaaikai,日本),Zetasizer 3000激光粒径散射仪(MALVERN,英国),LC29A高效液相色谱仪(Shimadzu,日本),SPD210AVP紫外可变波长检测器(Shimadzu,日本)。
1.2 动物 昆明种小鼠,体重(20±2)g,雄性,南京大学医学院附属鼓楼医院实验动物中心提供。
1.3 小鼠移植瘤株 小鼠 S180细胞株从中国药科大学药物研究室取种后种植在南京大学医学院附属鼓楼医院动物房昆明鼠体内传代。
1.4 紫杉醇脂质体的制备及检测 采用逆向蒸发法+超声法制备紫杉醇脂质体。经粒径测定仪测定脂质体平均粒径为(282.4±8.94)nm,多分散性为0.243。紫杉醇脂质体的包封率为91%[11]。
1.5 实体瘤模型的建立 选用雄性成熟昆明种小鼠20只,分别在其右后肢近腹侧皮下种植S180细胞(细胞数1×107/mL)0.1 mL。7天后100%成瘤。
1.6 给药方法 20只雄性昆明种小鼠皮下种植S180细胞,7天成瘤后随机分为4组,每组5只,分别为生理盐水对照组、空白脂质体组、紫杉醇注射液组、紫杉醇脂质体组。紫杉醇注射液、紫杉醇脂质体均用生理盐水稀释至含紫杉醇剂量1 mg/mL。紫杉醇注射液组、紫杉醇脂质体组给药剂量为10 mg/kg,生理盐水对照组、空白脂质体组为等容积量生理盐水和等容积量空白脂质体悬液,分别瘤体内注射,给药时间为随机分组后第0、3、6、9天。每次给药后观察小鼠的精神状况、毛色、活动度,同时测量瘤径,称重。在给药结束后观察3天,第4天经小鼠眼眶静脉丛取血,随即处死动物,解剖剥离肿瘤,测量瘤径,计算瘤体积并称重。部分血样进行细胞分类检查,部分血样离心后取上清用于肝功能检测。根据以下公式计算抑瘤率:肿瘤抑瘤率=[1-给药组平均瘤重(体积)/对照组平均瘤重]×100%。
1.7 统计学方法 对原始数据进行随机区组设计的方差分析。采用Stata 8.0统计软件进行分析,以P<0.05时为有统计学意义。
2 结果
2.1 一般情况 荷瘤鼠在给药期间及观察期内无毛色发暗、脱毛等改变;给药期间均存活,活动均自如。给药后体重均有增加。从动物体重变化可以看出,紫杉醇脂质体组给药前后动物体重增长较紫杉醇注射液组更接近生理盐水对照组(见表1)。
表1 荷瘤鼠体重的变化(g,±s)
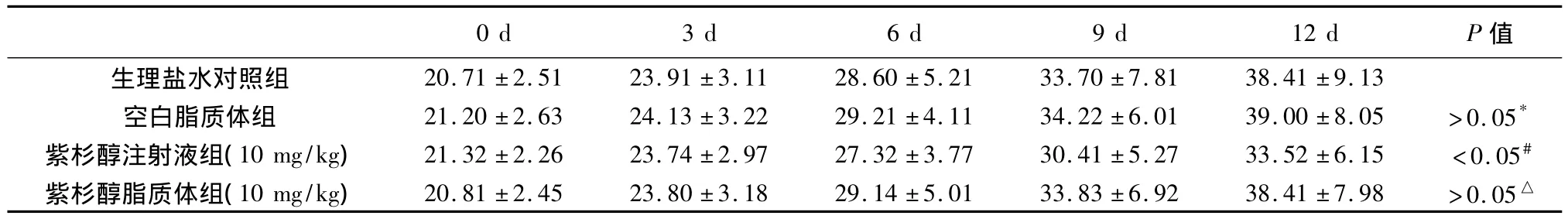
表1 荷瘤鼠体重的变化(g,±s)
注:*12 d与对照组比较P>0.05,#12 d与对照组比较P<0.05,△12 d与对照组比较P>0.05;12 d紫杉醇脂质体组与紫杉醇注射液组比较,P<0.05;12 d紫杉醇脂质体组与空白脂质体组比较,P>0.05。
0 d 3 d 6 d 9 d 12 d P 值1 38.41 ±9.13空白脂质体组 21.20 ±2.63 24.13 ±3.22 29.21 ±4.11 34.22 ±6.01 39.00 ±8.05 >0.05*紫杉醇注射液组(10 mg/kg) 21.32 ±2.26 23.74 ±2.97 27.32 ±3.77 30.41 ±5.27 33.52 ±6.15 <0.05#紫杉醇脂质体组(10 mg/kg) 20.81 ±2.45 23.80 ±3.18 29.14 ±5.01 33.83 ±6.92 38.41 ±7.98 >0.05生理盐水对照组 20.71 ±2.51 23.91 ±3.11 28.60 ±5.21 33.70 ±7.8△
2.2 紫杉醇脂质体瘤体内给药的抑瘤效果 从表2可以看出,与生理盐水对照组比较,紫杉醇注射液组的质量抑瘤率为36.42%(P<0.05),紫杉醇脂质体组的质量抑瘤率为57.47%(P<0.01),空白脂质体组的质量抑瘤率为2.59%(P>0.05);空白脂质体组与紫杉醇脂质体组比较,P<0.01。紫杉醇脂质体组与紫杉醇注射组比较,P<0.05。从表3可以看出,与生理盐水对照组比较,紫杉醇注射液组的体积抑瘤率为(47.55 ±3.12)%(P <0.05),紫杉醇脂质体组的体积抑瘤率为(65.49±4.53)%(P<0.01),空白脂质体组的体积抑瘤率为(3.65±0.62)%(P>0.05);空白脂质体组与紫杉醇脂质体组比较,P<0.01。紫杉醇脂质体组与紫杉醇注射组比较,P<0.05。紫杉醇脂质体组的抑瘤效果优于紫杉醇注射液组。瘤体内给药后荷瘤鼠体积变化曲线见图2。瘤体内给药后荷瘤鼠解剖后瘤体标本照片见图3。
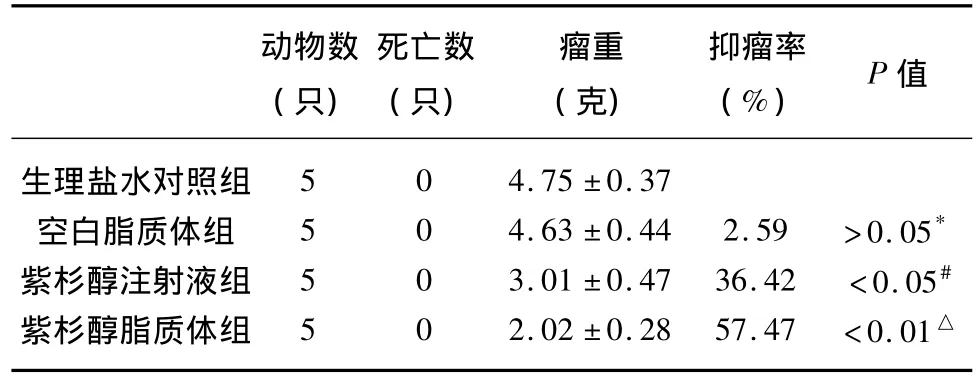
表2 荷瘤鼠移植瘤质量抑瘤率(%)
表3 荷瘤鼠移植瘤体积抑瘤率(%,±s)
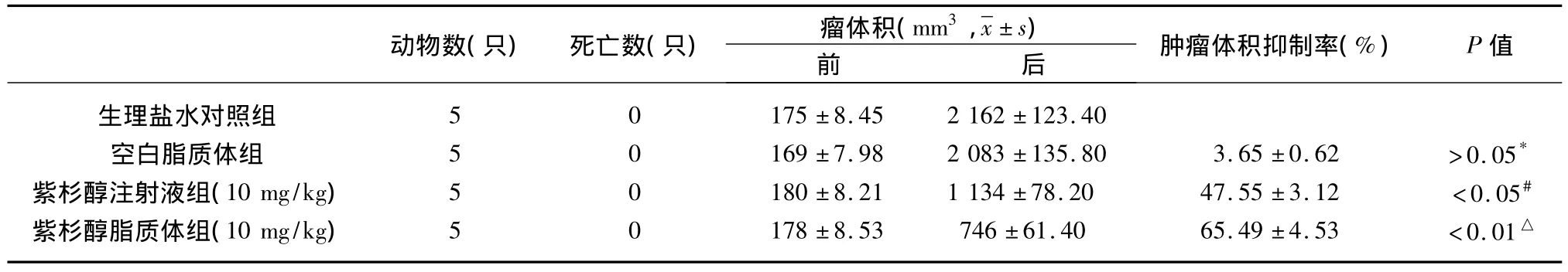
表3 荷瘤鼠移植瘤体积抑瘤率(%,±s)
注:* ,#,△ 均为与对照组比较结果;紫杉醇脂质体组与紫杉醇注射液组比较,P<0.05;紫杉醇脂质体组与空白脂质体组比较,P<0.01。
动物数(只) 死亡数(只) 瘤体积(mm3,±s)前后肿瘤体积抑制率(%) P值生理盐水对照组 5 0 175±8.45 2 162±123.40空白脂质体组 5 0 169±7.98 2 083±135.80 3.65±0.62 >0.05*紫杉醇注射液组(10 mg/kg) 5 0 180 ±8.21 1 134 ±78.20 47.55 ±3.12 <0.05#紫杉醇脂质体组(10 mg/kg) 5 0 178 ±8.53 746 ±61.40 65.49 ±4.53 <0.01△
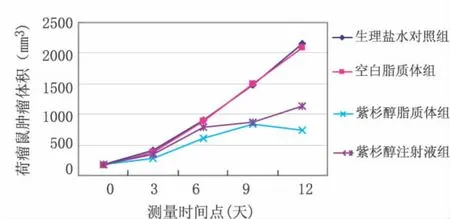
图2 瘤体内给药后荷瘤鼠肿瘤体积变化曲线
2.3 紫杉醇脂质体瘤体内给药后荷瘤鼠外周血分类改变 从表4可以看出,与生理盐水对照组比较,紫杉醇注射液组外周血白细胞计数明显降低(P<0.05),血红蛋白和血小板计数无明显差异(P>0.05);与生理盐水对照组比较,紫杉醇脂质体组外周血白细胞计数略低于生理盐水对照组,但差异无统计学意义(P>0.05);血红蛋白和血小板计数与生理盐水对照组比较无明显差异(P>0.05);紫杉醇注射液组比较与紫杉醇脂质体组比较,前者外周血白细胞计数明显低于后者(P<0.05)。

图3 瘤体内给药后荷瘤鼠解剖后肿瘤体积变化图片
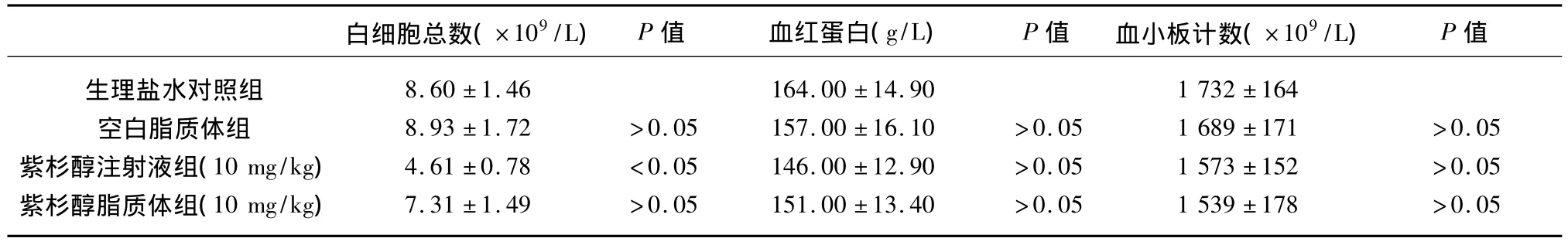
表4 荷瘤鼠外周血分类检查结果
2.4 紫杉醇脂质体瘤体内给药后荷瘤鼠肝功能检查结果 从表5可以看出,与生理盐水对照组比较,紫杉醇注射液组及紫杉醇脂质体组ALT、AST值均略高于生理盐水对照组,但差异无统计学意义(P>0.05)。紫杉醇脂质体组与紫杉醇注射液组间比较以及紫杉醇脂质体组与空白脂质体组间比较差异亦无统计学意义(P>0.05)。
表5 荷瘤鼠肝功能检查结果(mol/L,±s)
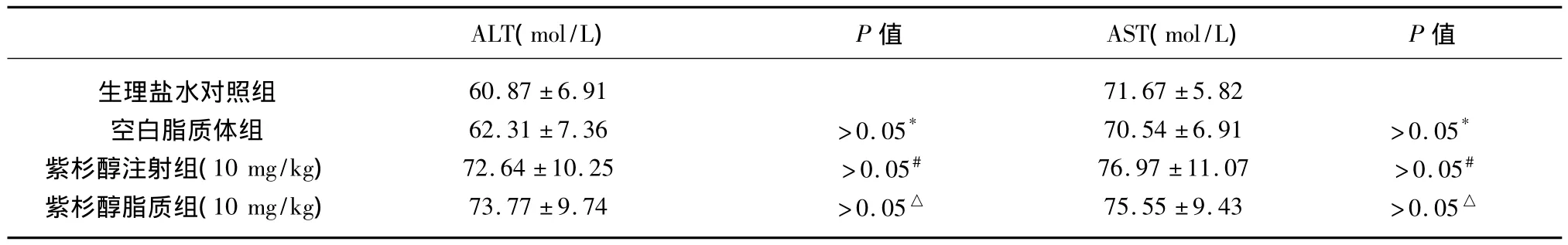
表5 荷瘤鼠肝功能检查结果(mol/L,±s)
注:*,#,△均为与对照组比较的结果;紫杉醇脂质体组与紫杉醇注射液组比较,紫杉醇脂质体组与空白脂质体组比较,均P>0.05。
ALT(mol/L) P值 AST(mol/L) P值生理盐水对照组 60.87 ±6.91 71.67 ±5.82空白脂质体组 62.31±7.36 >0.05* 70.54±6.91 >0.05*紫杉醇注射组(10 mg/kg) 72.64±10.25 >0.05# 76.97±11.07 >0.05#紫杉醇脂质组(10 mg/kg) 73.77±9.74 >0.05△ 75.55±9.43 >0.05△
3 讨论
传统的化疗药物是通过各种途径给药后,达到一定的血药浓度分布于全身而产生治疗作用。这种治疗方法最大的缺陷是缺乏选择性。而脂质体对肿瘤组织具有靶向性和缓释性,在肿瘤组织中能保持较高的药物浓度,将抗肿瘤药物选择性地分布于肿瘤病变部位,降低其对正常组织的毒副作用,从而提高药物利用率[12-15]。
在对鼠S180实体瘤模型瘤体内给药中,我们发现与生理盐水对照组比较,紫杉醇注射液组的质量抑瘤率为36.42%(P<0.05),紫杉醇脂质体组的质量抑瘤率为57.47%(P<0.01);与生理盐水对照组比较,紫杉醇注射液组的体积抑瘤率为(47.55±3.12)%(P <0.05),紫杉醇脂质体组的体积抑瘤率为(65.49 ±4.53)%(P <0.01)。结果表明,从抑制肿瘤质量及肿瘤体积两方面统计,紫杉醇脂质体的效果优于紫杉醇注射液,其可能的原因在于脂质体瘤体内注射后,在瘤体和瘤周可以保持长时间的高浓度,从而抑制肿瘤的生长;另一方面,由于脂质膜的特异性作用,紫杉醇可以稳定停留并蓄积于肿瘤组织处,进入细胞内部,发挥细胞毒作用。我们在实验中还发现,紫杉醇脂质体对于荷瘤鼠外周血白细胞的毒性小于紫杉醇注射液,这可能与紫杉醇脂质体中药物多集中于瘤组织内或瘤周组织,进入全身血液循环相对较少有关。周卫等[16]研究紫杉醇脂质体在大鼠体内的组织分布情况,发现紫杉醇脂质体在肝脏、肺、脾脏等组织中分布较多。考虑到紫杉醇脂质体可能造成的器官毒性,本实验比较了各组的主要肝功能指标。结果显示,在本实验所用的剂量下,紫杉醇脂质体组的小鼠肝功能与对照组比较无显著性差异,与紫杉醇注射液组之间也未发现显著性差异。紫杉醇脂质体在体内分布的改变并未增加其对肝脏的毒性。
[1] 陈卫东,刘晓东,抗肿瘤药紫杉醇脂质体的研究进展[J].中国药物与临床,2005,5(10):776-778.
[2] 阎家麒,王悦,王九一.紫杉醇隐形脂质体的制备及在小鼠体内的组织分布[J].药学学报,2000,35(9):706-709.
[3] Straubinger RM,Balasubramanian SV.Preparation and characterization of taxane-containing liposomes[J].Methods Enzymol,2005,391:97-117.
[4] 杨爱珍,李军,徐海军,等.紫杉醇脂质体的体内外抗肿瘤作用研究[J].中国肿瘤,2006,15(12):862-864.
[5] Chen JH,Ling R,Yao Q,et al.Effect of small-sized liposomal Adriamycin administered by various routes on a metastatic breast cancer model[J].Endocr Relat Cancer,2005,12(1):93-100.
[6] Ling R,Li Y,Yao Q,et al.Lymphatic chemotherapy induces apoptosis in lymph node metastases in a rabbit breast carcinoma model[J].J Drug Target,2005,13(2):137-142.
[7] Kanaoka E,Takahashi K,Yoshikawa T,et al.Continuous release of interleukin-2 from liposomal IL-2(mixture of interleukin-2 and liposomes)after subcutaneous administration to mice[J].Drug Dev Ind Pharm,2003,29(10):1149-1153.
[8] Oussoren C,Storm G.Liposomes to target the lymphatics by subcutaneous administration[J].Adv Drug Deliv Rev,2001,50(1-2):143-156.
[9] Rdler JO,Koltover I,Salditt T,et al.Structure of DNA-cationic liposome complexes DNA intercalation in multilamellar membranes in distinct interhelical packing regimes[J].Science,1997,11(275):810-820.
[10] 金晓凌,井清源,王炳生.瘤体内直接注射白介素2质粒复合物治疗小鼠肝癌[J].中国肿瘤临床,2001,28(10):33-39.
[11] 陈凝,杨觅,钱晓萍,等.紫杉醇脂质体腹腔给药对S180腹水瘤小鼠的疗效[J].南京医科大学学报(自然科学版),2007,27(7):706-710.
[12] Straubinger RM,Arnold RD,Zhou R,et al.Antivascular and antitumor activities of liposome-associated drugs[J].Anticancer Res,2004,24(2A):397-404.
[13] 宫亮,杨和平.脂质体载药系统和抗肿瘤药物[J].中国药业,2005,14(3):27-29.
[14] 李彦超,蔡宝昌.脂质体在抗肿瘤药物研究中的应用[J].南京中医药大学学报,2003,19(4):250-253.
[15] Bao A,Phillips WT,Goins B,et al.Potential use of drug carriedliposomes for cancer therapy via direct intratumoral injection[J].Int J Pharm,2006,316(1-2):162-169.
[16] 周卫,翁帼英,陈文忠,等.紫杉醇脂质体在大鼠体内的组织分布[J].中国药学杂志,2005,40(18):1402-1404.
