趋化性细胞因子受体CXCR4基因表达对人骨肉瘤细胞增殖和迁移的影响
2012-08-07吕南千张麒云楼国祥
吕南千,费 青,张麒云,楼国祥
骨肉瘤好发于青少年,恶性程度高、侵袭力强,极易发生血道转移[1],早期肺部转移是患者死亡的主要原因。近年来,随着分子生物学技术的不断进步及其在肿瘤病因学的广泛应用,从分子水平研究骨肉瘤的形成机制,寻找有针对性的治疗措施以改善患者的预后,渐成骨肿瘤领域的研究热点。有研究结果显示,作为趋化因子CXCL12,即基质细胞衍生因子(stromal cell derived factor 1,SDF 1)的专属受体,CXCR4与其配体CXCL12相互作用可促使肿瘤细胞发生迁移、侵袭和转移[2]。有研究结果显示,包括卵巢癌、肺癌、黑色素瘤等在内的多种肿瘤均存在CXCR4的选择性高表达[3-4]。但是,CXCR4与骨肉瘤之间的关系目前尚未明确。为进一步深入探讨CXCR4与骨肉瘤发生、发展的关系,本研究在mRNA水平上检测多种人骨肉瘤细胞株CXCR4的表达情况,并将真核表达质粒pcDNA3/CXCR4通过脂质体转染到骨肉瘤细胞HOS-8603中,旨在观察pcDNA3/CXCR4的表达对人骨肉瘤细胞增殖和迁移的影响。
1 材料与方法
1.1 材料与设备
人骨肉瘤细胞株HOS-8603、U2OS和MG-63由第二军医大学病理学教研室提供,培养于含10%胎牛血清的低糖DMEM培养液中。pcDNA3空白质粒和pcDNA3/CXCR4质粒由德国Marburg实验室Herbert Schwarz教授惠赠。穿膜小室(Transwell小室,周径24 mm、孔径8 μm)、重组细胞基底膜(Matrige 1,美国Costar公司);新生牛血清(美国Hyclone公司);脂质体转染试剂Lipofectamine 2000和Trizol试剂(美国Invitrogen公司);反转录试剂盒(美国Fermentas公司);rTaq酶、T4DNA连接酶、dNTPs及各种限制性内切酶(日本TaKaRa公司);质粒小量抽提试剂盒及大量抽提试剂盒(德国Qiagen公司);Real time PCR试剂(美国Gene公司);DMSO和MTT(美国Amresco公司)。2550型酶联免疫检测仪和MRC 1024LCSM流式细胞仪(美国BIO-RAD公司);CO2培养箱(美国Forma公司)。所有引物采用Primer 2.0软件自行设计,由上海生工生物工程技术服务有限公司合成,CXCR4引物(上游:GAA CTT CCT ATG CAA GGC AGT,下游:CCA TGA TGT GCT GAAACT GGA,长度:800 bp);β-actin引物(上游:ATC TGG CAC CAC ACC TTC TAC AAT GAG CTG,下游:CGT CAT ACT CCT GCT TGC TGATCC ACATCT,长度:750 bp)。DNA测序由上海博尚生物技术公司完成。
1.2 方法
1.2.1 Real-time PCR测定CXCR4 mRNA含量Trizol试剂抽提总RNA,紫外分光光度计测定RNA浓度及吸光度(optical density,OD)值。反转录试剂盒反转录合成cDNA:取1 μg总RNA,加入Oligo(dT)18(500 μg/mL)1 μL,DEPC 水补足至12 μL,70℃加热5 min后置于冰上,加入5×酶缓冲液4 μL、dNTP(10 mmol/L)2 μL、RNA酶抑制剂(40U/μL)1 μL后混匀,37 ℃温育5 min;再加入反转录酶(200 U/μL)1 μL,42 ℃温育 60 min;最后70℃加热10 min,收集反转录产物cDNA。反应体系:模板(骨肉瘤cDNA)1 μL、CXCR4引物(5 μ mol/L)l μL、SYBR Green Real-time PCR Master Mix 12.5 μL,加 ddH2O 水补足至25 μL。反应条件:95 ℃预变性,15 min;94 ℃变性,15 s;56 ℃复性,30 s;72 ℃延伸,30 s;共35个循环。数据分析:荧光本底信号设定为前16个循环的荧光值;阈值设定为5~16个循环的荧光信号标准差的10倍;Ct值为每个反应管内的荧光信号达到设定阈值时所经历的循环数,实时测定每个孔的荧光数值;以β-actin作为内参照,校正每个样品的Ct值。△△Ct=(样品Ct均值-内参照Ct均值)-(对照样品Ct均值-对照内参照Ct均值),然后计算2-△△Ct,即代表被检样品初始mRNA的含量。
1.2.2 PCR鉴定CXCR4重组质粒菌落 分别取1 μL pcDNA3空质粒和pcDNA3/CXCR4质粒加入感受态TG1菌液中,依次冰浴30 min、42℃90 s、冰浴5 min,加入800 μL无抗性LB培养液,37℃摇床中100 r/min振摇1 h。将转化产物涂于含有氨苄青霉素抗性的LB培养板上,倒置于37%温箱中培养过夜;再挑选1个单克隆菌落加入4 mL LB培养液,37℃220 r/min振荡培养过夜。取l μL菌液作为反应模板,反应体系:菌液1 μL、CXCR4引物1 μL、ddNTP(2.5 mmoL/L)2 μL、10 × buffer 2 μL、rTaq酶 0.1 μL,加 ddH2O 补足至 20 μL。反应条件:95 ℃预变性,10 min;95℃变性,30 s;60 ℃退火,45 s;72 ℃延伸,1 min;共40个循环;72 ℃再延伸10 min。取l μL扩增产物点样于2%琼脂糖凝胶,凝胶成像系统成像观察条带。
1.2.3 双酶切鉴定CXCR4重组质粒 采用质粒小量抽提试剂盒抽提菌液中的重组质粒,然后进行双酶切鉴定,双酶切反应体系如下:EcoR I 1 μL、BamH I 1μL、10 × K buffer 2 μL、质粒5 μL,ddH2O补足至20 μL,37℃酶切3 h。取1 μL酶切产物点样于2%琼脂糖凝胶,凝胶成像系统成像观察条带。
1.2.4 测序及序列分析 取5 μL经PCR和双酶切鉴定的重组质粒进行测序,并运用PubMed的BLAST对测序结果进行分析。
1.2.5 pcDNA3/CXCR4质粒瞬时转染HOS-8603细胞 根据Qiagen质粒大量抽提试剂盒说明书进行pcDNA3和pcDNA3/CXCR4质粒抽提。应用Lipofectamine 2000将重组质粒转染入HOS-8603细胞(pcDNA3/CXCR4组)。同时制备转染pcDNA3空质粒的阴性对照组(pcDNA3组)。转染后24 h和48 h,应用RT-PCR检测CXCR4转染效率。
1.2.6 MTT法检测CXCR4转染后HOS-8603细胞增殖情况 按l×104/孔将HOS-8603细胞接种于96孔板,37℃培养箱中培养24 h,进行质粒转染。分别于转染后24、48、72 h进行MTT反应,即每孔加入MTT溶液20 μL培育4 h,终止培养,小心吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解。于酶联免疫检测仪上测定各孔490 nm波长处的OD值,每组重复3次。
1.2.7 迁移实验检测CXCR4转染后HOS-8603细胞迁移情况 将HOS-8603细胞用无血清培养液制成单细胞悬液,按1.5×106/孔接种于Transwell小室,培养48 h后取出Transwell小室,PBS冲洗后用棉签轻轻擦去微孔膜上层的细胞,95%乙醇固定微孔膜下层细胞,HE染色,在400倍高倍镜下取10个视野的均数作为该样本从微孔膜上层迁移至下层的细胞数,每组重复4次。
1.3 统计学方法
应用SAS 6.12统计软件进行分析,计量资料以均数±标准差(±s)表示,多组比较采用方差分析,两两比较采用LSD-t检验,两组比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤细胞株中CXCR4 mRNA表达量差异
Real-time PCR检测结果显示,MG-63、U2OS、HOS-8603细胞中CXCR4 mRNA相对表达含量分别为(12.5±1.6)%、(5.7±1.3)%、(1.1±0.3)%,3组比较,差异有统计学意义(F=6.345,P=0.006)。因此,本研究选择自身CXCR4表达较低的HOS-8603细胞用于后续实验。
2.2 CXCR4重组质粒的鉴定结果
pcDNA3/CXCR4质粒转化入感受态菌TG1并经抗生素筛选培养后,取6个菌落进行PCR及电泳成像,可见800 bp左右处有一清晰条带,与CXCR4条带大小吻合(图1A)。双酶切鉴定结果:pcDNA3空质粒表现出1个条带,大小在2000 bp以上;CXCR4重组质粒表现出2个条带,其中一条在2000 bp以上;另一条在800 bp左右,与CXCR4条带大小相吻合(图1B)。pcDNA3/CXCR4质粒测序结果与PubMed基因库比对结果显示,重组质粒中CXCR4 mRNA及其编码氨基酸序列完全正确。
2.3 RT-PCR检测质粒转染效率的结果
pcDNA3组CXCR4 mRNA表达量为(1.03±0.09)%,质粒转染入HOS-8603细胞24、48 h后,CXCR4基因重组质粒转染成功且转染效率较高,pcDNA3/CXCR4组的CXCR4 mRNA表达量分别为(98.43±6.68)%、(138.00±9.21)%,是pcDNA3组的96倍和124倍(P<0.05)。
2.4 CXCR4转染对HOS-8603细胞增殖的影响
pcDNA3组HOS-8603细胞增殖率为(1.5±0.3)%;pcDNA3/CXCR4质粒转染24、48、72 h后细胞增殖率分别为(12.7±3.6)、(34.6±4.7)、(61.5±11.1)%,是pcDNA3组的12.3倍、32.7倍和57.0倍(P<0.05);转 染 72 h后 CXCR4对HOS-8603细胞的增殖促进作用最强。见图2。
2.5 CXCR4转染对HOS-8603细胞迁移的影响
pcDNA3组和pcDNA3/CXCR4组迁移的HOS-8603细胞数分别为(236±23)、(584±42.9)个,两组比较,差异有统计学意义(t=10.092,P=0.000)。
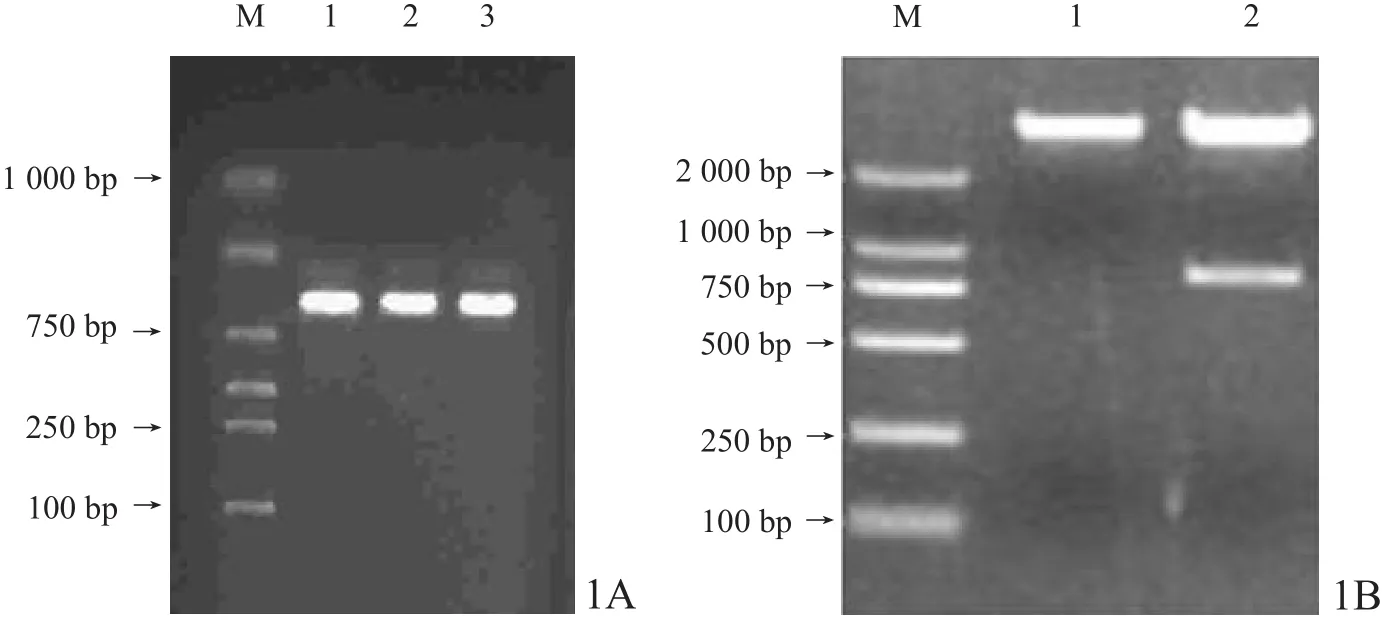
图1 重组质粒的PCR与双酶切鉴定结果
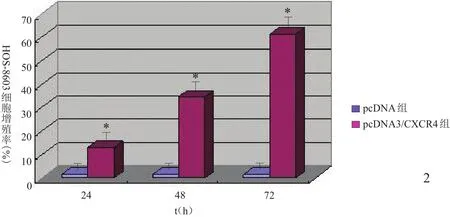
图2 CXCR4转染对HOS-8603细胞增殖的影响
3 讨论
恶性肿瘤的侵袭和转移是一个多阶段、多步骤的复杂过程,受许多基因的共同调控[5]。目前,趋化因子及其受体在肿瘤疾病中的作用也得到了广泛的关注和研究。根据氨基酸序列可将趋化因子受体分为4种类型,即CR、CCR、CXCR和CX3CR。既往的研究结果显示,白细胞对某种特殊趋化因子的反应能力依赖于其细胞表面所表达的趋化因子受体,在趋化因子受体作用下,白细胞向趋化因子所在部位进行运动,参与炎症的发展过程[6]。近年来,研究结果表明,肿瘤细胞表面亦可表达趋化因子受体,包括CXCR4、CXCR3、CCR10、CCR9、CCR7、CCR4和CCR3等[7],这些受体和靶器官表达的趋化因子决定了肿瘤细胞迁移的方式[8],参与肿瘤的发病、侵袭和转移等多个关键环节。其中,CXCR4生物轴具有趋化肿瘤细胞、促进血管生长的功能,在多种肿瘤的侵袭和转移中发挥着重要作用[9-11],CXCL12在淋巴结、肺和肝脏等组织中高度表达,而表达CXCR4的肿瘤则常常转移到上述这些部位[12-13]。Salvucci等[6]的研究结果表明,通过抗CXCL12-CXCR抗体阻断CXCL12-CXCR4的功能,或者RNAi技术使CXCL12-CXCR4基因沉默,可抑制血管生长因子依赖性的血管生成,从而抑制肿瘤的生长。这说明CXCR4生物轴可能是一个潜在的治疗靶点。
骨肉瘤作为一种预后极差的原发性恶性肿瘤,其发病机制尚不十分清楚,缺乏有效的生物标志物和实验室指标,临床治疗效果并不理想。有研究结果表明,CXCR4与骨肉瘤的发生可能也具有密切关系[14],进一步阐明二者之间的相关性,有助于为骨肉瘤的治疗提供一个新的切入点,通过针对性调控CXCR4的表达,或与目前常规采用的放化疗、热疗等方式相结合,有望达到提高疗效,改善患者生存质量的目的。
本研究利用Real-time PCR技术检测3种人骨肉瘤株(U2OS、MG-63和HOS-8603)中 CXCR4 mRNA的表达水平,结果显示,在不同分化程度的骨肉瘤细胞中,CXCR4 mRNA表达水平的差异很大,其中在低分化骨肉瘤细胞MG-63中表达量相对较高,在中分化骨肉瘤细胞U2OS中表达量相对较低,而在高分化的骨肉瘤细胞HOS-8603中的表达量最低,因此,本研究选择HOS-8603细胞作为后续的实验细胞。上述结果也提示CXCR4的表达与肿瘤细胞的分化有一定关系,但其具体相关性仍有待进一步探讨。
本研究将重组的真核表达质粒pcDNA3/CXCR4转染入HOS-8603细胞,观察细胞生长和增殖情况,结果显示转染后的HOS-8603细胞CXCR4表达明显增加,同时骨肉瘤细胞增殖明显增加,这与有关学者报道的CXCR4促进癌细胞增殖的现象一致[15-18]。另外,本研究中迁移实验结果进一步证实,CXCR4能够明显促进HOS-8603细胞迁移。这提示CXCR4可增强肿瘤细胞的成瘤性,加速肿瘤的生长,并可能参与肿瘤细胞的转移,这也为进一步在体实验奠定了理论基础,为骨肉瘤的分子生物学治疗提供了新的思路。
综上所述,CXCR4的表达与骨肉瘤细胞株不同的分化程度密切相关,恢复其表达可明显促进骨肉瘤的增殖和迁移,这进一步证实CXCR4可能在骨肉瘤发生、发展和浸润转移中扮演着重要角色,有可能成为骨肉瘤预防和治疗中一个新的靶点。为进一步阐明CXCR4对骨肉瘤的影响,我们将在以后的工作中进一步完善CXCR4表达与骨肉瘤患者临床病理特征之间的相关性研究,并通过体内实验观察CXCR4基因转染对骨肉瘤生长、转移以及成瘤能力的影响。
[1]李梅,张余.细胞凋亡与骨肉瘤[J].中国骨科临床与基础研究杂志,2011,3(4):299-303.
[2]Kodama J,Hasengaowa,Seki N,et al.Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer[J].Eur J Gynaecol Oncol,2007,28(5):370-375.
[3]Takekoshi T,Ziarek JJ,Volkman BF,et al.Locked,dimeric CXCL12 variant effectively inhibits pulmonary metastasis of CXCR4-expressing melanoma cells due to enhanced serumstability[J].Mol Cancer Ther,2012,8(6):1835-1841.
[4]Spano D,Zollo M.Tumor microenvironment:a main actor in the metastasis process[J].Clin Exp Metastasis,2012,29(4):381-395.
[5]Pan J,Mestas J,Burdick MD,et al.Stromal derived factor-1(SDF-1/CXCL12)and CXCR4 in renalcellcarcinoma metastasis[J].Mol Cancer,2006,5:56.
[6]Salvucci O,Bouchard A,Baccarelli A,et al.The role of CXCR4 receptor expression in breast cancer:a large tissue microarray study[J].Breast Cancer Res Treat,2006,97(3):275-283.
[7]Kawada K,Hosoqi H,Sonoshita M,et al.Chemokine receptor CXCR3 promotes colon cancer metastasis to lymph nodes[J].Oncogene,2007,26(32):4679-4688.
[8]Laverdiere C,Hoang BH,Yang R,et al.Messenger RNA expression levels of CXCR4 correlate with metastatic behavior and outcome in patients with osteosarcoma[J].Clin Cancer Res,2005,11(7):2561-2567.
[9]Kremer KN,Clift IC,Miamen AG,et a1.Stromal cell-derived factor-1 signaling via the CXCR4-TCR heterodimer requires phospholipase C-β 3 and phospholipase C-γ 1 for distinct cellular responses[J].J Immuol,2011,187(3):1440-1447.
[10]Castellone MD,Guarino V,De Falco V,et a1.Functional ex pression of the CXCR4 chemokine receptor is induced by RET/PTC oncogenes and is a common event in human papillary thyroid carcinomas[J].Oncogene,2004,23(35):5958-5967.
[11]Engl T,Relja B,Marian D,et al.CXCR4 chemokine receptor mediates prostate tumor cell adhesion through alpha5 and beta3 integrins[J].Neoplasia,2006,8(4):290-301.
[12]Mashino K,Sadanaga N,Yamaguchi H,et al.Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma[J].Cancer Res,2002,62(10):2937-2941.
[13]Emmett MS,Lanati S,Dunn DB,et al.CCR7 mediates directed growth ofmelanomas towards lymphatics [J].Microcirculation,2011,18(3):172-182.
[14]姚兆鹏,龚丹,罗庆丰.趋化因子受体CXCR4的表达与骨肉瘤转移的相关性研究[J].南昌大学学报:医学版,2011,51(4):83-84,88.
[15]Mendonça VA,Alvim de Melo GE,Araújo MG,et al.ExpressionofthechemokinereceptorCXCR4onlymphocytes of leprosy patients[J].Braz J Med Biol Res,2011,44(12):1256-1260.
[16]Wang T,Hui XH,Zhou LX,et al.Expression of CXCR4 and VEGF in hemangioblastomas of the central nervous system and its relation to tumor angiogenesis[J].2010,41(3):420-423.
[17]Yurdakul AS,Akyürek N,Demirtas S,et al.The effect of adhesion molecule CEACAM1 and chemokine receptor CXCR4 expression on prognosis of non-small cell lung cancer patients[J].Tuberk Toraks,2010,58(4):351-356.
[18]Katsumoto K,Kume S.Endoderm and mesoderm reciprocal signaling mediated by CXCL12 and CXCR4 regulates the migration of angioblasts and establishes the pancreatic fate[J].Development,2011,138(10):1947-1955.
