微弧氧化镁合金对兔骨骼肌细胞黏附和增殖的影响
2012-08-07尹庆水杨小明蓝国波
张 涛,尹庆水,夏 虹,张 余,李 梅,杨小明,蓝国波
镁合金是一种新型可降解金属材料,具有良好的降解性和生物相容性[1],但其降解速度较快,临床应用受到一定限制。微弧氧化(microarc oxidation,MAO)处理可使镁合金表面形成粗糙面,有利于成骨细胞吸附,耐蚀性能也明显改善[2-3]。本研究试图通过观察MAO镁合金、镁合金、钛合金对骨骼肌细胞黏附及增殖影响的比较研究,以评价MAO镁合金材料的生物相容性。
1 材料与方法
1.1 实验动物
日本大耳兔3只,体质量2.0~2.5 kg,雌雄不限,购于广东省医学实验动物中心。
1.2 主要试剂和试件材料
DMEM培养基、PBS、胎牛血清和胰蛋白酶(美国Hyclone公司);碘化丙啶染色剂(江苏碧云天公司);CCK-8(日本同仁公司);庆大霉素(广东邦民制药厂有限公司)。医用钛合金、镁合金AZ31B均由中科院金属研究所提供,规格均为直径10 mm、厚3 mm圆片状。
1.3 实验分组及处理
根据材料试件的不同分为3组:(1)对照组:采用医用钛合金,磨平抛光后,丙酮和无水乙醇超声清洗,消毒后待用;(2)镁合金组:采用镁合金AZ31B,磨平抛光后,丙酮和无水乙醇超声清洗,消毒后待用;(3)MAO组:采用镁合金AZ31B,磨平抛光后,丙酮和无水乙醇超声清洗,进而采用MAO技术(表面打磨平整、脱脂处理、中和、水洗、SIMOXIDE微弧氧化、水洗、干燥、封闭处理[2]),处理后得到MAO镁合金,消毒待用。
1.4 兔骨骼肌细胞培养
无菌条件下取兔臀部肌肉1 cm3,置于冷D-Hank液中,加入104U/L庆大霉素反复冲洗,去除结缔组织,保留肌肉组织,剪成1 mm3左右的小块,按照组织块法[4]置于培养瓶中贴附,加入含10%胎牛血清的DMEM培养基,于37℃、5%CO2、饱和湿度条件下培养,2~3 d换液1次,细胞长至80%融合时进行传代。
1.5 浸提液的制备
根据ISO 10993医疗器械生物学评价标准[5],按照材料表面积/浸提介质为1.25 cm2/mL的比例,向装有镁合金及MAO镁合金材料的容器中加入含10%胎牛血清的高糖DMEM培养基,在37℃、5%CO2培养箱中孵育、浸泡24 h,获得镁合金提取液和MAO镁合金提取液,4℃冷藏,24 h内使用。
1.6 细胞黏附率的测定
取3块24孔培养板,分别在每块板中放置18枚材料试件,每组6枚;将兔骨骼肌细胞以1×105/孔接种于24孔板,于37℃、5%CO2培养箱内培养2、6、24 h;各取出1块培养板,PBS漂洗3次,吸净液体,0.25%胰蛋白酶1.0 mL消化1 min;加入含血清的培养基1.0 mL终止消化,1000 r/min离心5 min,吹打制成细胞悬液。使用细胞计数板进行计数,取平均值,计算黏附率,每组设6个复孔。细胞黏附率(%)=已贴壁细胞数/接种细胞总数×100%。
1.7 细胞相对增殖率的测定
0.25 %胰蛋白酶消化兔骨骼肌细胞,取1×104/L细胞悬液200 μL接种于96孔板中,于37℃、5%CO2培养箱内培养24 h。镁合金组、MAO组分别将培养液更换为镁合金浸提液和MAO镁合金浸提液;对照组则加入高糖DMEM培养基,2 d更换1次。分别培养1、3、5、7 d,PBS清洗后加入20 μL CCK-8试剂,继续培养2 h,酶联免疫检测仪测定450 nm处吸光度(optical density,OD),每组设6个复孔,计算相对增殖率。细胞相对增殖率(%)=试验组OD值/对照组OD值×100%。根据细胞增殖率进行毒性评级[6]:0级:100%;1级:80%~99%;2级:50%~79%;3级:30%~49%;4级0~29%。
1.8 细胞凋亡的检测
将1×106/L的细胞悬液2 mL接种于6孔板中,培养24 h;镁合金组、MAO组分别将培养液更换为镁合金浸提液和MAO镁合金浸提液;对照组加入高糖DMEM培养基;分别培养3 d后,加入0.25%胰蛋白酶,将细胞消化成为单细胞悬液;加入1 mL冰浴预冷的乙醇,4℃过夜,1000 g离心4 min沉淀细胞,吸除上清;加入1 mL冰浴预冷的PBS,重悬细胞;再次离心后,加入碘化丙啶染色剂,37℃避光孵育30 min,流式细胞仪488 nm处进行测定。
1.9 统计学分析
应用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用方差分析,组内两两比较采用LSD-t检验或Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 3组细胞黏附率的测定结果
培养2、6、24 h时,3组细胞黏附率比较,差异有统计学意义(P<0.05);其中MAO组与对照组、镁合金组各时相点细胞黏附率比较,差异有统计学意义(P<0.05)。各组细胞黏附率呈时间依赖性增加(P<0.05)。见表1。
2.2 3组细胞相对增殖率的比较结果
培养后1、3、5、7 d,3组细胞相对增殖率比较,差异有统计学意义(P<0.05);其中MAO组细胞相对增殖率高于镁合金组(P<0.05),但与对照组比较,差异无统计学意义(P>0.05)。在不同时相点,镁合金组细胞相对增殖率呈时间依赖性下降(F=12.385,P=0.000);而MAO组细胞各时相点相对增殖率比较,差异无统计学意义(F=1.197,P=0.332)。见表2。
镁合金组毒性评级为2级;MAO组毒性评级为1级,具有良好的生物相容性。
2.3 3组细胞凋亡检测结果
流式细胞仪检测结果表明,对照组和MAO组细胞未见明显凋亡,无明显细胞毒性;而镁合金组可见部分细胞出现凋亡,提示镁合金存在部分细胞毒性。见图1。
表1 不同时相点3组细胞黏附率的比较结果(±s,%)
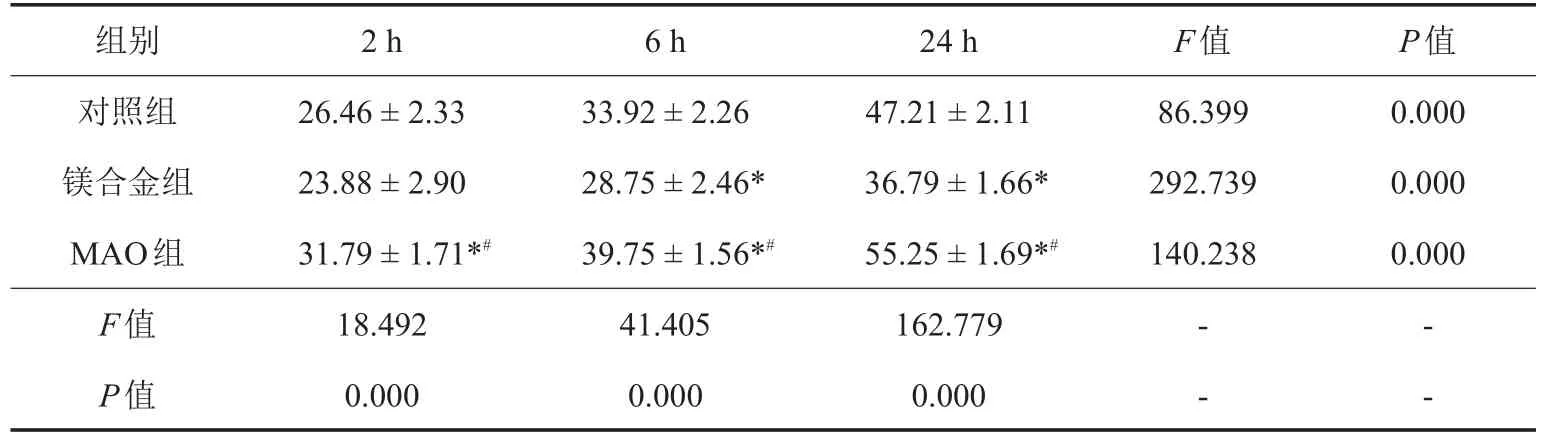
表1 不同时相点3组细胞黏附率的比较结果(±s,%)
注:*与对照组比较,P<0.05;#与镁合金组比较,P<0.05。
组别对照组镁合金组MAO组F值P值2 h 26.46±2.3323.88±2.9031.79±1.71*#18.4920.0006 h 33.92±2.2628.75±2.46*39.75±1.56*#41.4050.00024 h 47.21±2.1136.79±1.66*55.25±1.69*#162.7790.000 F值86.399292.739140.238 P值0.0000.0000.000- -- -
表2 不同时相点3组细胞相对增殖率的比较结果(±s,%)
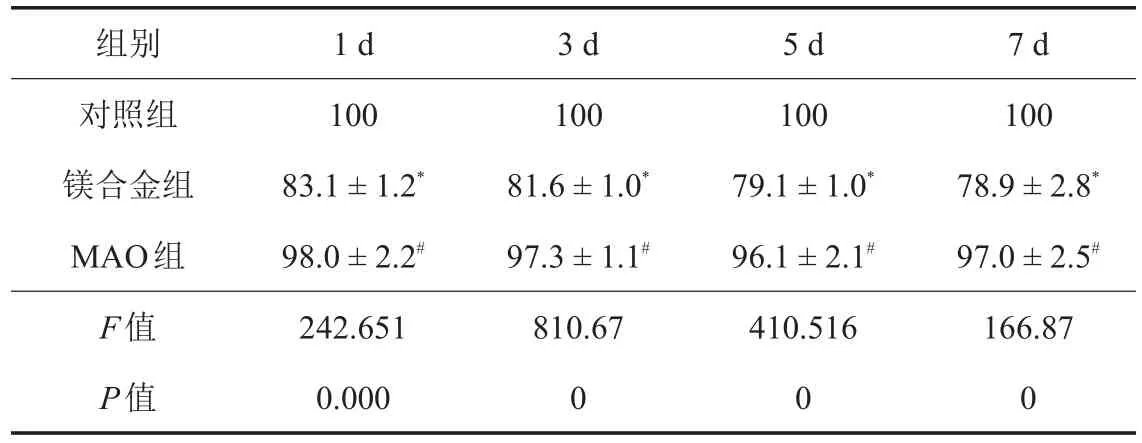
表2 不同时相点3组细胞相对增殖率的比较结果(±s,%)
注:*与对照组比较,P <0.05;#与镁合金组比较,P <0.05。
组别对照组镁合金组MAO组F值P值1 d 10083.1±1.2*98.0±2.2#242.6510.0003 d 10081.6±1.0*97.3±1.1#810.6705 d 10079.1±1.0*96.1±2.1#410.51607 d 10078.9±2.8*97.0±2.5#166.870
3 讨论
3.1 镁合金的优缺点
钛合金是目前临床上最常用的骨科植入材料,具有良好的生物相容性,但存在被人体吸收的可能性,术后患者需接受二次手术取出内固定。因此,寻找一种可降解吸收的植入材料成为当前骨科研究领域的热点之一。
镁合金是近年来新兴的一种可降解金属材料,作为骨科植入材料具有其他金属难以比拟的优点:(1)密度为1.74 g/cm3左右,与人的密质骨密度(1.75 g/cm3)基本相当;(2)比强度和比刚度高,镁合金的杨氏模量约为45 GPa,接近人骨20 GPa左右的弹性模量[7],可避免应力遮挡效应;(3)镁是人体内仅次于钙、钠和钾的常量元素(成人每人每日需要量超过350 mg),与神经、肌肉及心脏功能关系密切[8]。但镁合金的腐蚀破坏速度较快,难以满足临床要求[9],这成为限制其临床应用的主要瓶颈。为进一步减缓镁合金降解速度,学者们探索了一系列镁合金表面的处理方法,如电化学电镀、化学转化、阳极氧化、气相沉积、激光表面改性和有机涂层等[10-11],其中MAO作为一种新型的金属表面处理技术,近年来得到材料学及医学界的广泛关注。
3.2 MAO镁合金的优点
MAO是一种在有色金属表面原位生成氧化膜的新技术。该技术将铝、钛、镁等金属置于电解质溶液中,在热化学、等离子化学和电化学的共同作用下,使材料表面产生火花放电生成陶瓷层。MAO技术可显著提高上述材料的耐蚀性、耐磨性和硬度,目前已被广泛应用于航空、航天、机械、电子、纺织、装饰等领域[2]。同时,MAO也是一种很有前景的医用金属植入体表面生物改性技术,已成功应用于钛种植体表面[12]。
与其他表面处理方法相比较,MAO技术的综合性能更加适合于生物医用环境中镁合金的表面处理。它具有以下几个优点:(1)耐腐蚀、耐磨性能更好;(2)与基体结合紧密、不易脱落;(3)可在金属表面形成粗糙面,有利于成骨细胞吸附;(4)与通常的阳极氧化处理相比,对材料的疲劳强度影响较小[3]。黄震等[13]的研究结果显示,经MAO技术处理后的AZ9lD镁合金具有良好的成骨细胞相容性,有利于MG63细胞的早期黏附。柳麟翔等[14]以钛合金作为对照,将MAO镁合金植入兔股骨,术后4周和12周取材观察材料与骨组织的结合情况,结果表明,MAO AZ91D镁合金具有较好的骨结合性能。亦有学者研究MAO镁合金对人体组织的影响,以明确其是否能够真正进入临床。吴婕等[15]观察经MAO处理的AZ91D镁合金浸提液对口腔黏膜的刺激性,结果表明,MAO镁合金未对组织造成明显的不良刺激反应。苗波和姜德志[16]将MAO镁合金植入动物下颌骨内,动物肝脏和肾脏的病理学检测结果均提示其未造成不良影响。这些结论均证实了MAO镁合金良好的生物相容性。
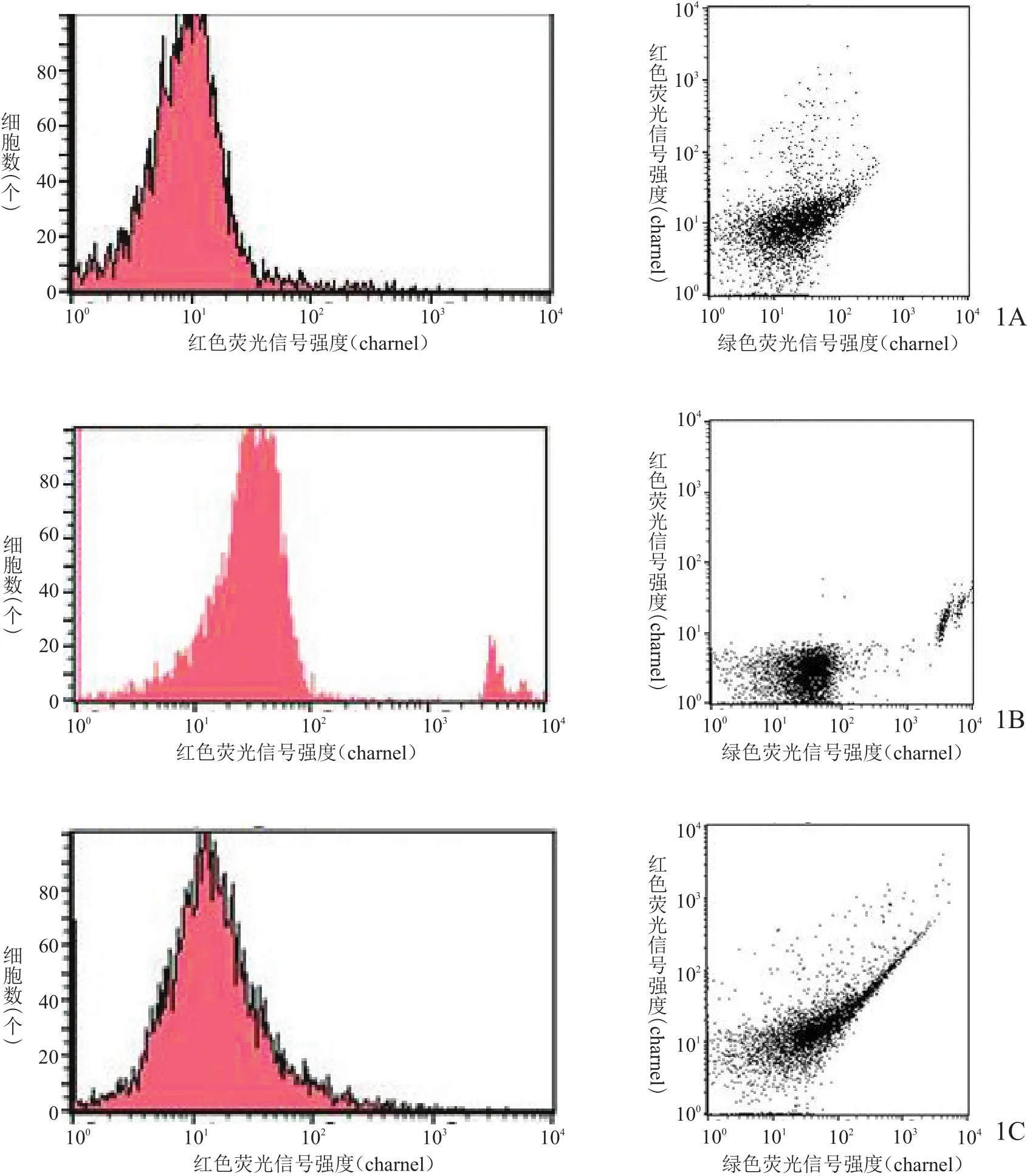
图1 流式细胞仪检测3组细胞凋亡情况
3.3 MAO镁合金对骨骼肌细胞黏附及增殖的影响
作为四肢骨关节运动的动力装置,骨骼肌对于骨关节运动的意义重大。MAO镁合金植入体内后,除了接触骨骼外,还要接触骨骼肌,这种材料对骨骼肌组织的生物相容性如何,对于骨骼肌细胞黏附、增殖有无影响,目前尚没有准确的结论。有研究结果表明,影响黏附的因素包括材料表面的形貌、粗糙度、表面元素成分及金相结构等[17],这些影响因素不是孤立存在的,而是共同作用以对材料表面的细胞黏附造成影响[18]。
本研究结果显示,MAO组细胞黏附率高于对照组和镁合金组,说明MAO镁合金的表面可能更适合于骨骼肌细胞的黏附。此外,MAO组细胞增殖率与对照组接近,高于镁合金组;MAO组毒性评级为1级,低于镁合金组的2级毒性;进一步的流式细胞仪检测结果证实,MAO组未见明显的细胞凋亡。这些结果均证实,MAO镁合金降解速度减缓,毒性减弱,生物相容性更加优良。
综上所述,镁合金AZ31B经MAO技术处理后对于兔骨骼肌细胞具有良好的黏附作用,且不影响细胞增殖,这为其在骨科植入材料领域的应用提供了部分理论依据,但MAO镁合金对人骨骼肌细胞的作用还有待于进一步的深入研究。
[1]Staiger MP,Pietak AM,Huadmai J,et al.Magnesium and its alloys as orthopedic biomaterials:a review[J].Biomaterials,2006,27(9):1728-1734.
[2]刘元刚,张巍,李久青,等.镁合金微弧氧化膜结构及耐蚀性的初步研究[J].材料保护,2004,37(1):17-18.
[3]蒋百灵,张淑芬,吴建国,等.镁合金微弧氧化陶瓷层显微缺陷与相组成及其耐蚀性[J].中国有色金属学报,2002,12(3):454-457.
[4]张涛,尹庆水.镁合金及其涂层的生物学性能研究进展[J].中国骨科临床与基础研究杂志,2011,3(3):224-227.
[5]中华人民共和国国家质量监督检验检疫总局.GB/T 16886.5-2003医疗器械生物学评价第5部分:体外细胞毒性试验[S].北京:中国标准出版社,2003:80-88.
[6]The United States Pharmacopeial Convention.USP 29 NF 24[M].USA:The United States Pharmacopeial Convention,1999:2525.
[7]浦素云.金属植入材料及其腐蚀[M].北京:北京大学航空航天出版社,1990:29.
[8]黄晶晶,任伊宾,张炳春,等.镁及镁合金的生物相容性研究[J].稀有金属材料与工程,2007,36(6):1102-1105.
[9]王福会,杜克勤,张伟,镁合金的腐蚀与防护研究进展[J].中国材料进展,2011,30(2):29-34.
[10]张新平,熊守美,沈厚发,等.镁合金表面覆盖层形成方法及相关国家[J].材料科学与工艺,2005,13(6):627-632.
[11]Yan TT,Tan LL,Xiong DS,et al.Fluoride treatment and in vitro corrosion behavior of an AZS1B magnesium alloy[J].Mater Sci Engineer C,2010,30(5):740-748.
[12]马威,时惠英,刘宝林,等.成骨细胞在微弧氧化处理后纯钛表面的附着、增殖及ALP活性[J].实用口腔医学杂志,2005,21(1):106-110.
[13]黄震,吴凤呜,柳麟翔,等.微弧氧化Az9lD镁合金对成骨细胞早期黏附的影响[J].口腔医学,2009,29(4):180-182.
[14]柳麟翔,吴凤鸣,朱志军,等.微弧氧化AZ91D镁合金骨结合性能的研究[J].口腔医学,2010,30(5):261-263.
[15]吴婕,吴凤鸣,张新平,等.微弧氧化AZ91D镁合金的口腔黏膜刺激实验[J].口腔医学,2008,28(3):127-129.
[16]苗波,姜德志.不同涂层镁合金兔下颌骨植入的生物相容性研究[J].牡丹江医学院学报,2009,30(2):28-30.
[17]Prasanna N,Pallavi Reddy Y,Kavitha S,et al.Degree of conversion and residualstressofpreheated and roomtemperature composites[J].Indian J Dent Res,2007,18(4):173-176.
[18]Ghavamnasiri M,Moosavi H,Tahvildamejad N.Effect of centripetal and incremental methods in ClassⅡcomposite resin restorations on gingival microleakage[J].J Contemp Dent Pract,2007,8(2):113-120.
