产辅酶Q10大肠杆菌工程菌的构建*
2012-08-06李家洲谢明权李安兴罗晓春
李家洲 谢明权 李安兴 罗晓春†
(1.华南理工大学生物科学与工程学院,广东广州510006;2.中山大学水生经济动物研究所,广东广州510275)
辅酶Q(CoQ),亦称泛醌,广泛存在于各种生物膜中,参与多种生命过程.CoQ的首要功能是参与生物呼吸链电子的传递,将呼吸过程所产生的电子由复合体Ⅰ或复合体Ⅱ传递给复合体Ⅲ[1].除此之外,CoQ还有许多其它重要功能.例如,作为还原型烟酰胺腺嘌吟二核苷酸(NADH)氧化酶的辅酶,参与胞质中烟酰胺腺嘌吟二核苷酸氧化型与还原型比例(NAD+/NADH)的调节,从而影响细胞的生长与分化[2];作为高效抗氧化剂阻止细胞蛋白、脂质和DNA被氧化[3];阻止线粒体膜上大分子转运膜打开从而避免线粒体功能损伤[4]等.依据苯环上所结合的聚异戊二烯侧链的聚合度,CoQ可分为 CoQ5、CoQ6、CoQ7、CoQ8、CoQ9、CoQ10等.不同物种依据其固有的遗传特性,均能合成特定的CoQ.例如,大肠杆菌合成的是 CoQ8[5];老鼠体内合成的是 CoQ9[6];人体内合成的则是CoQ10[7].CoQ10在人类健康领域展现出非常巨大的市场前景,受到广泛关注.CoQ10可作为优良的抗氧化剂可消除人体内的活性氧[8].此外,CoQ10还可用于治疗心血管疾病[9]、糖尿病[10]、帕金森氏综合症[11]等,也可用于缓解一些抑制素(如促黑激素抑制素、生长激素抑制素等)的副作用[12].
目前,CoQ10生产方法有化学合成法、半合成法和发酵法,其中发酵法是目前的主流[13].发酵法的关键是选育或构建高产CoQ10的菌种.目前可用于生产的菌种均经过诱变育种法得到,包括农杆菌、脱氮副球菌和雨生红球菌等[14].虽然大肠杆菌具有许多适于工业化生产的优良性能,但由于其合成的是CoQ8,限制了其在商业生产CoQ10方面的应用.现代生物分子学技术的快速发展,使得通过遗传改造构建适于工业化生产CoQ10的大肠杆菌的构想具备了可行性.
能提供ddsA编码产物聚十异戊二烯焦磷酸合成酶的微生物包括裂殖酵母(Fission yeast)、脱氮副球菌(Paracoccus denitrificans)、红球菌(Rhodobacter sphroides)、放射型根瘤菌[14].历史上放射型根瘤菌曾归入农杆菌属,后根据表现型和基因型的差异,将其单列成一个属[15].日本科学家获得的CoQ10高产纪录(760mg/L)就来自于放射型根瘤菌[14],这证明其酶系统具有高产CoQ10的潜力.本研究选择放射型根瘤菌作为ddsA来源,将其克隆后通过同源重组替换大肠杆菌的聚八异戊二烯焦磷酸合成酶基因ispB,并强化CoQ合成过程中的关键酶,构建产CoQ10的大肠杆菌工程菌.
1 材料与方法
1.1 实验材料
DNA标准物、质粒抽提试剂盒、凝胶试剂盒、DNA聚合酶、pMD18T载体、限制性内切酶和其它DNA修饰酶购自大连宝生物有限公司;异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、蛋白酶K和细菌基因组提取试剂盒购自北京普博生物技术有限公司;L-阿拉伯糖购自阿拉丁公司;CoQ10标准品购自中国药品生物制品检定所;DNA引物由上海生工生物工程有限公司合成;用于高效液相色谱(HPLC)分析的试剂均为色谱纯,其它试剂均为分析纯.
放射型根瘤菌WSH由江南大学堵国成教授馈赠;其它菌种、pKD3、pKD46、pCP20、pQE30 及其它载体均为华南理工大学广东省发酵与酶工程重点实验室保存或构建.
1.2 ddsA 基因克隆
放射型根瘤菌WSH经摇床培养[16],按照细菌基因组提取试剂盒说明书从培养液中提取基因组.基因克隆参照文献[17].根据Genebank中Agrobacterium tumefaciens c.58全基因序列中ddsA为参照设计上游引物RDup(CGCGGATCCTTGCCGCACAAGGCATCAGTTT,下划线处为BamHI酶切位点)和下游引物RDdown(CGCAAGCTTTCAGTTGAGACGCTCGATGCAG,下划线处为HindⅢ酶切位`点).利用LA Taq酶进行聚合酶链式反应(PCR),条件为:94℃5min;94℃ 30s,55℃ 30s,72℃ 70s,30 个循环;72℃5min.PCR产物经电泳检测,凝胶回收纯化后进行A-T 克隆,构建质粒 pMD18ddsA,转化 E.coliDH5α,菌落PCR检测,送样测序.
1.3 大肠杆菌BL21 ispB基因置换
利用大肠杆菌red重组系统,对大肠杆菌BL21 ispB基因用放射型根瘤菌ddsA基因置换.根据ispB基因上下游环境,设计上游打靶引物D1(CAGCGATGTGCGCGAGGCCGATGAGTGCTTCTCGCCAAGGGGTGTCCGGGATAGTTCCTATTCCGAAGT,下划线处为pkD3 Cmr基因引物)和下游打靶引物D2(TGCCTTTGTTCACAGTAAGGTAATCGGGGCGAAAAGCCCGGCTTTTGCGATGCCGCACAAGGCATCA,下划线处为ddsA上游引物).打靶片段的下游同源臂为大肠杆菌ispB基因翻译起始密码子前面的50 bp序列;上游同源臂为ispB基因翻译终止密码子后面的50bp序列.ddsA基因的起始密码子直接与同源臂相连,保证置换后ddsA的转录和翻译不受影响.ddsA与氯霉素抗性基因(Cmr)之间通过 BamHI酶切位点相连.Cmr基因与ddsA基因连接引物p1为CGCGGATCCCGAAGTTCCTATACTTTCTAGAG(下划线为BamHI位点);连接引物p2为CGCGGATCCTCAGTTGAGACGCTCGATGCAG(下划线为BmaHI位点).以 Primer star为 PCR聚合酶,以 D1和 p1为引物扩增pKD3上的Cmr基因;以D2和p2为引物扩增质粒 pMD18ddsA,条件为:98℃ 1 min;98℃10s,68℃ 70s,30 个循环;68℃ 5min.PCR 产物分别经凝胶纯化A-T克隆构建质粒pMD18HC和质粒pMD18HD.之后用 BamHI酶切 pMD18HC,并用碱性磷酸酶处理,回收酶切产物;用 BamHI酶切pMD18HD,凝胶回收带同源臂的 ddsA片段,与pMD18HC用连接酶连接构建质粒pMD18HCDH.菌落经PCR筛选和测序验证.经过克隆构建出ispB基因置换打靶片段,其结构见图1.图1中,FRT为翻转酶结合位点的缩写.
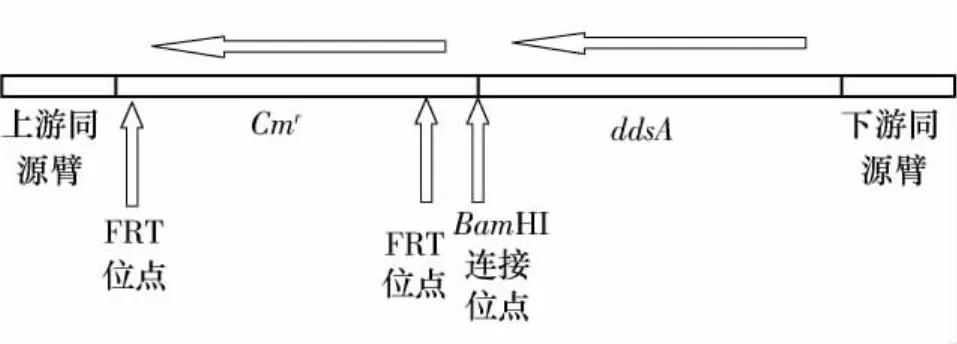
图1 置换大肠杆菌ispB基因的打靶片段结构Fig.1 Structure of target fragment for substituting Escherichia coli ispB gene
对验证无误的菌落振荡培养提取质粒,用引物D1和D2进行PCR,条件同前,制备打靶片段.后续操作参照文献[18]进行.ispB基因置换利用了大肠杆菌的red重组系统.工具质粒pKD46在阿拉伯糖的诱导下合成Exo、Beta、Gam 3种蛋白.Exo结合在通过电转化进入大肠杆菌的同源臂的末端,自5'向3'降解形成单链的同源臂末端.Beta蛋白结合在形成的同源臂单链上,引导目的片段ispB的置换重组.Gam抑制RecBCD活性,防止其对打靶片段的降解.重组后利用打靶片段上的氯霉素抗性标记进行筛选,再用pCP20质粒上的翻转酶重组酶(FLP)结合在Cmr两端的FRT位点上,通过两位点自身重组,消除掉Cmr基因.其置换过程见图2.
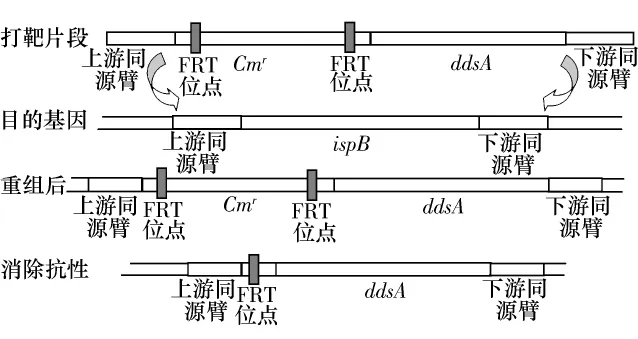
图2 ddsA基因置换大肠杆菌ispB基因的过程Fig.2 Process of substitution of Escherichia coli ispB with ddsA
用菌落PCR筛选阳性克隆,引物为ispB上下游的特异性片段 c1(GACCTTCGCTTACTCGG)和 c2(CCTTCGCAATAATCATCTC);工具酶为 rTaq.反应条件为:94℃ 5min;94℃ 30s,44℃ 30s,72℃ 3min,30个循环;72℃ 5 min.所得2900 bp的片段为阳性克隆.
1.4 大肠杆菌 BL21 ubiA、ispA、idi基因克隆及与ddsA串联表达
在CoQ10合成过程中聚十异戊二烯焦磷酸合成酶、对羟基苯甲酸聚异戊二烯焦磷酸转移酶、法呢基焦磷酸合成酶、异戊二烯焦磷酸异构酶是关键酶.将以上4种关键酶按上述顺序依次克隆至pQE30上,在每基因前加上独立的SD序列进行串联表达,分别转入大肠杆菌BL21R1,诱导表达,促进CoQ10合成.以大肠杆菌BL21基因组为模板,分别设计引物PCR扩增 ubiA、ispA、idi基因,并分别进行 A-T克隆.PCR检测和测序鉴定.先将 ddsA克隆到pQE30多克隆位点 BamHI和SacI之间构建质粒pQE30D.并依次将 ubiA、ispA、idi克隆到 pQE30D 多克隆位点的 SacI与 SmaI、SmaI与 PstI、PstI与 HindⅢ之间,每序列前面均带有核糖体结合位点(RBS,GAAGGAGATATACC)以方便各基因分别翻译,相应地构建 pQE30DA、pQE30DAF、pQE30DAFI.各载体的结构见图3.将上述各质粒转化入经ddsA置换的大肠杆菌宿主菌内,分析其对CoQ10合成的促进作用.

图3 多酶共表达体系的构建Fig.3 Construction of enzymes co-expression systems
1.5 CoQ10分析
含质粒的菌种,振荡培养至D(600)=0.6后,添加IPTG至0.2 mmol/L继续振荡培养5 h,检测D(600),根据标准曲线换算成细胞干重.取50 mL菌液离心收集菌体,加无菌水清洗一遍,加正已烷3mL,超声抽提10 min,离心收集上清.重复抽提一遍,合并两次上清,减压蒸馏除去溶剂,加入色谱纯乙醇1mL,溶解样品.用岛津Prominence LC-20A检测,采用 shodex C18M 4E(250 mm ×4.6 mm)柱,柱温为32℃,流动相乙醇/甲醇体积比为7∶3,流速为1mL/min,用紫外检测器检测,检测波长为275nm[19].
2 实验结果与讨论
2.1 ddsA基因的鉴定
以提取的放射型根瘤菌基因组为模板,以引物RDup和RDdown进行PCR扩增,得到一条长度为1100bp左右的片段,经A-T克隆,获得 E.coliDH5α转化体,以相同引物对转化体进行鉴定,结果见图4.
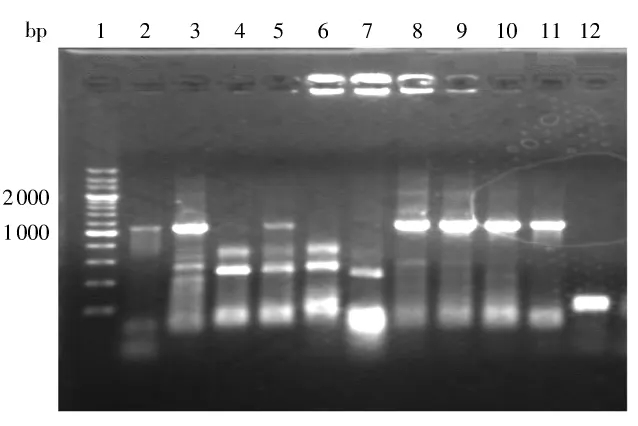
图4 ddsA A-T克隆的菌落PCR筛选结果Fig.4 Screening results of ddsA A-T clone by using colony PCR 1—200bp DNA标准物;2-12—样品
ddsA 基因全长为1077bp.图4 中第2、3、5、8、9、10、11泳道均有相应PCR条带,初步判定为阳性克隆.为进一步确定结果,随机选择第3、8、10泳道的阳性克隆送样测序分析,将结果在Genebank中进行Blast比对,证明所得片段为放射型根瘤菌ddsA基因.
2.2 ispB基因置换和目标重组体的获得
引物c1位于ispB上游388 bp处,c2位于ispB下游316bp处,ispB全长942 bp,c1与c2之间相距1675bp.未取代前,以c1与c2为引物的PCR产物长度为1675 bp.以打靶片段取代之后,加上氯霉素基因,再以c1与c2为引物进行PCR,其产物长度变成2902 bp.将氯霉素抗性基因消除后,以c1与c2为引物进行PCR的产物长度为1900 bp左右(包含由于氯霉素抗性基因消除时留下的一个FRT位点).以c1与c2为引物,分别以替代前、替代后带Cmr、替代后不带Cmr的基因组为模板进行PCR,所得结果见图5.
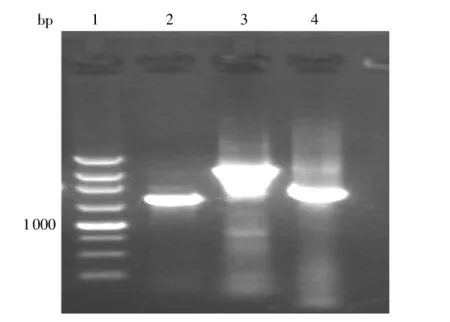
图5 大肠杆菌BL21 ispB基因替代前后的PCR鉴定Fig.5 PCR identification of Escherichia coli BL21 ispB before and after substitution
图5中ispB基因替代前后的PCR结果符合预期.为进一步确证,将替代后Cmr消除前的PCR产物送样测序.其基因序列结构与设计一致,表明ddsA基因置换ispB成功.
2.3 重组大肠杆菌的CoQ10合成
菌落PCR为阳性的克隆,经摇瓶培养,用HPLC分析CoQ的种类,结果见图6.图6(a)-(c)示出了标准CoQ10、ispB未置换的大肠杆菌BL21(DE3)中所含的CoQ8、ispB被ddsA置换后大肠杆菌BL21所含的CoQ种类(包括CoQ9和CoQ10).通过对比图6(b)和(c)可以证明ispB已被ddsA成功置换,故不再具有CoQ8合成能力.放射型根瘤菌的ddsA在大肠杆菌中,除了可以合成CoQ10外还合成CoQ9,这与文献[19]的报道一致.笔者已经通过实验验证,这种合成的非特异性由菌体培养环境引起(结果将在另一篇文章刊出).这一结果同时证明,在大肠杆菌中,CoQ10完全可以替代 CoQ8的功能,不影响大肠杆菌的正常代谢.但各CoQ6-10种类之间,是否都可以完全相互替代,则还需要进一步证明.
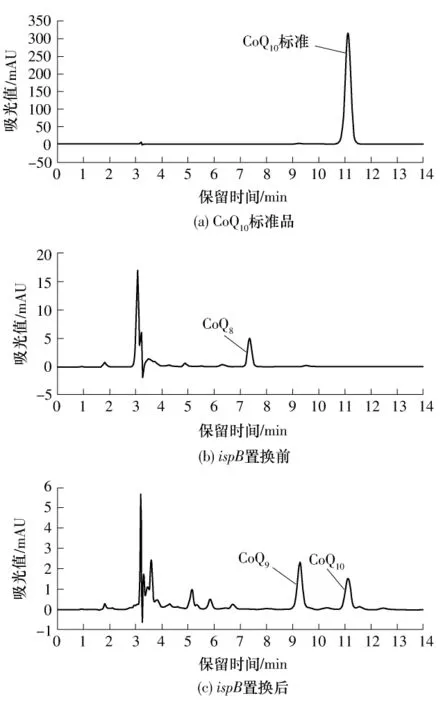
图6 ispB被ddsA替代前后CoQ的HPLC检测Fig.6 HPLC detection of CoQ of Escherichia coli before and after substituting ispB with ddsA
2.4 多酶共表达促进CoQ10合成
根据文献[19]的报道,在CoQ10的合成体系中ddsA、ubiA、ispA、idi 4 种酶为关键酶.其中 ddsA 基因产物为聚十异戊二烯焦磷酸合成酶,催化CoQ10的侧链聚十异戊二烯焦磷酸;ubiA基因产物为对羟基苯甲酸聚异戊二烯焦磷酸转移酶,负责将聚异戊二烯连接到对羟基苯甲酸苯环的第3位碳原子上;ispA基因产物为法呢基焦磷酸合成酶,催化合成聚十异戊二烯焦磷酸合成的前体;idi的基因产物为异戊二烯焦磷酸异构酶,将异戊二烯焦磷酸异构为二甲基烯丙基焦磷酸,后者为异戊二烯焦磷酸聚合的引导物.对于CoQ的合成代谢调节机理,目前依然知之甚少.
根据本实验室的实验结果,pQE30是表达放射型根瘤菌ddsA的良好载体.其它研究者虽然有利用pET32、pET28和pUC18作载体成功表达其它物种ddsA 的例子[20-22],但在本实验中,用上述载体表达的酶均为包涵体,不能用于促进CoQ10的合成.这可能与不同来源ddsA的表达产物折叠时的难易不同有关.放射型根瘤菌聚十异戊二烯合成酶(DPS)在折叠时相对困难,因此在用强启动子表达时,表达速度太快,使产物来不及形成正确的折叠.用启动能力相对较弱的pQE30时则不存在这个问题,可以形成正确的折叠,故本实验选用pQE30作载体.
将上述构建的各表达体系转入E.coli BL21R1,经菌落PCR鉴定获得阳性克隆,接种入50mL LB培养基摇瓶培养检测其CoQ10合成能力,结果见表1.
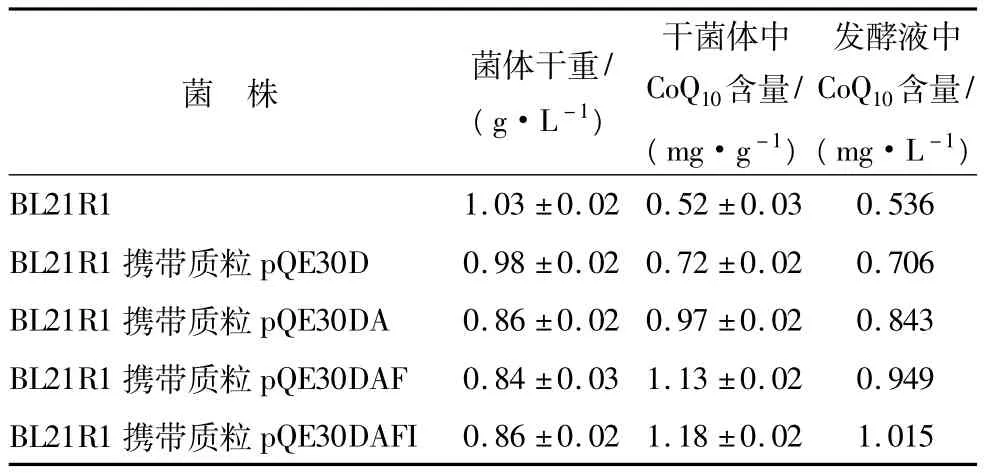
表1 各工程菌CoQ10合成情况Table 1 Results of all recombinants for CoQ10production
从表1中可以看出,随着表达酶种类的增多,细胞干重呈下降趋势.这主要是因为,随表达酶数量的增加,菌体所承受的负担增加,使菌体生长速度下降所致.同时,随表达酶种类的增多,干菌体中CoQ10含量增加,其中带有 pQE30D、pQE30DA、pQE30DAF、pQE30DAFI的BL21R1相对不带质粒的BL21R1分别提高 38.5%、86.5%、117.3%、126.9%.按构建顺序进行前后比较,CoQ10提高幅度由高到低分别为pQE30DA(48.0%)、pQE30D(38.5%)、pQE30DAF(30.8%)、pQE30DAFI(9.6%).ddsA 催化合成的产物为ubiA的底物,在强化ddsA的前提下,强化ubiA比不强化ubiA时的CoQ10的产量提高幅度高,表明在强化ddsA的前提下,ubiA是CoQ10合成的瓶颈.综合而言,ddsA与ubiA对CoQ10产量影响较大,为关键基因;ispA与idi对CoQ10产量影响较小,为次关键基因.最终得到的 E.coli BL21R1 pQE30-DAFI的 CoQ10合成能力相对于出发菌株提高了1.269倍.
3 结语
通过将大肠杆菌ispB置换为放射型根瘤菌ddsA,使合成CoQ8大肠杆菌可以合成CoQ10,证明CoQ10可代替大肠杆菌中CoQ8的功能.通过强化CoQ10合成过程中的关键酶 ddsA、ubiA、ispA、idi等,可以使大肠杆菌CoQ10合成能力由出发菌株的(0.52±0.03)mg/g(干菌体),提高至(1.18 ±0.02)mg/g(干菌体),提高幅度达126.9%.大肠杆菌遗传背景清晰,代谢简单,安全性好,生长迅速,被广泛用于构建多种工业生产菌种,但到目前为止,还未成功构建用于生产CoQ10的菌种.可能的原因是对大肠杆菌中与CoQ合成相关的一些机制还未完全了解.因此,为利用大肠杆菌生产CoQ10,需要进一步研究其调节机制,才能最终实现突破.
[1] Ernster L,Dallner G.Biochemical,physiological and medical aspects of ubiquinone function [J].Biochimica et Biophysica Acta,1995,1271(1):195-204.
[2] Consuelo Gormez-Diaz,Juan Carlos Rodriguez-Aguilera,Maria P Barroso,et al.Antioxidant ascorbate is stabilized by NADH-coenzyme Q10ruductase in the plasma membrane[J].Journal of Bioenergetics and Biomembranes,1997,29(3):251-257.
[3] David Petillo,Herbert O Hultin.Ubiquinone-10 as an antioxidant[J].Journal of Food Biochimistry,2008,32(2):173-181.
[4] Laura Papucci,Nicola Schiavone,Ewa Witort,et al.Coenzyme Q10prevents apoptosis by inhibiting mitochondrial depolarization independently of its free radical scavenging property[J].The Journal of Biological Chemistry,2003,278(30):28220-28228.
[5] Kwon O,Kotsakis A,Meganathan R.Ubiquinone(coenzyme Q)biosynthesis in Eshcherichia coli:identification of the ubiF gene[J].FEMS Microbiology Letters,2000,186(2):157-161.
[6] Michael Tekle,Magnus Bentinger,Tomas Nordman,et al.Ubiquinone biosynthesis in rat liver peroxisomes[J].BiochemicalandBiophysicalResearchCommunications,2002,291(5):1128-1133.
[7] Daniel J M Fernández-Ayala,Guillermo López-Lluch,Macarena García-Valdés,et al.Specificity of coenzyme Q10for a balanced function of respiratory chain and endogenous ubiquinone biosynthesis in human cells[J].Biochimica et Biophysica Acta,2005,1706(1/2):174-183.
[8] Magnus Bentinger,Kerstin Brismar,Gustav Dallner.The antioxidant role of coenzyme Q[J].Mitochondrion,2007,7(S):S41-S50.
[9] Muralikrishnan Dhanasekaran,Jun Ren.The emerging role of coenzyme Q-10 in aging,nerodegeration,cardiovascular disease,cancer and diabetes mellitus[J].Current Neurovascular Research,2005,2(5):447-459.
[10] Hodgson J M,Wattsi G F,Playford D A,et al.Coenzyme Q10improves blood pressure and glycaemic control:a controlled trial in subjects with type 2 diabetes[J].European Journal of Clinical Nutrition,2002,56(11):1137-1142.
[11] Clifford W Shults,David Oakes,Karl Kieburtz,et al.Effects on coenzyme Q10in early Parkinson disease:evidence of slowing of the functional decline[J].Archives of Neurology,2002,59(10):1541-1550.
[12] Giuseppe Caso,Patricia Kelly,Margaret A McNurlan,et al.Effect of coenzyme Q10on myopatic symptoms in patients treated with statins[J].American Journal of Cardiology,2007,99(10):1409-1412.
[13] Jeya Marimuthu,Moon Hee-Jung,Lee Jeong-Lim,et al.Current state of coenzyme Q10production and its applications[J].Applied Microbiology Biotechnology,2010,85(6):1653-1663.
[14] Hajime Yoshida,Yukinobu Kotani,Keiko Ochiai,et al.Production of ubiquinone-10 using bacteria [J].The Journal of General and Applied Microbiology,1998,44(1):19-26.
[15] Yong J M,Kuykendall L D,Martínez-Romero E,et al.Classification and nomenclature of Agrobacterium and Rhizobium-a reply to Farraad et al(2003) [J].International Journal of Systematic and Evolutionary Microbiology,2003,53(4):1689-1695.
[16] 潘春梅,刘畅,堵国成.放射型根瘤菌辅酶Q10发酵助剂的研究[J].食品与发酵工业,2005,31(10):13-16.Pan Chun-mei,Liu Chang,Du Guo-cheng.Studies on the promotor of CoQ10fermentation with Rhizobium radiobacter[J].Food and Fermentation Industries,2005,31(10):13-16.
[17] 郭成栓,崔堂兵,郭勇.β-1,4-葡聚糖内切酶基因的克隆及表达[J].华南理工大学学报:自然科学版,2008,36(12):112-115,145.Guo Cheng-shuan,Cui Tang-bing,Guo Yong.Cloning and expression of β-1,4-endoglucanase gene [J].Journal of South China University of Technology:Natural Science Edition,2008,36(12):112-115,145.
[18] Kirill A Datsenko,Barry L Wanner.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the National Academy of Sciences,2000,97(12):6640-6645.
[19] Seiji Takahashi,Tokuzo Nishino,Tanetoshi Koyama.Isolation and expression of Paracoccus denitrificans decaprenyl diphosphate synthase gene for production of ubiquinone-10 in Escherichia coli[J].Biochemical Engineering Journal,2003,16(2):183-190.
[20] Seo M J,Im E M,Nam J Y,et al.Increase of CoQ10production level by the coexpression of decaprenyl diphosphate synthase and 1-deoxy-D-xylulose 5-phosphate isolated from Rhizobium radiobacter ATCC4718 in recombinant Escherichia coli[J].Journal of Microbiology and Biotechnology,2007,17(6):1045-1048.
[21] Liu Xinyi,Wu Haizhen,Ye Jiang,et al.Cloning and characterization ofddsA gene encoding decaprenyl diphosphate synthase from Rhodobacter capsulatus B10[J].Canadian Journal of Microbiology,2006,52(12):1141-1147.
[22] Kazunori Okada,Tomohiro Kainou,Kasunori Tanka,et al.Molecular cloning and mutational analysis of the ddsA gene encoding decaprenyl diphosphate synthase from Gluconobacter suboxydans[J].European Journal of Biochemistry,1998,255(12):52-59.
