黑曲霉内切聚半乳糖醛酸酶A基因在大肠杆菌中的表达及产物酶学性质研究
2012-08-02刘明启戴贤君白兰芳
刘明启,戴贤君,白兰芳
(中国计量学院 生命科学学院,浙江 杭州 310018)
果胶由酯化程度不同的半乳糖醛酸以α-1,4糖苷键聚合而成的,并含有木糖、海藻糖、半乳糖等侧链的一类杂多糖.果胶酶(pectinase)是指能够降解果胶一系列酶的总称,主要包括聚半乳糖醛酸 酶(PG)、果胶裂解酶(PL)、果胶酯酶(PE)[1,2].果胶酶是世界四大工业用酶制剂之一,广泛应用于食品工业、生物制浆、纺织工业和饲料工业.内切聚半乳糖醛酸酶(endo-polygalacturonase,EC.3.2.1.15)作用于果胶主链内部的2个非酯化半乳糖醛酸间的α-1,4糖苷键,是果胶最关键的水解酶之一,也是果胶酶中最早被人们所认识和应用最广泛的一类.质量最好的果胶来自于柑橘水果类,2010年浙江省柑橘的种植面积为169.3万亩,柑橘产量为192万吨,多年居全国第一位,果胶资源非常丰富,具有以果胶为原料生产高附加值产品的优势.
果胶经内切聚半乳糖醛酸特异性降解所得产物为聚合度不等的果胶低聚糖(POS,DP:2-10)和低分子果胶(MCP,DP:20-50).POS是公认的功能性添加剂,具有特异性增殖双歧杆菌和乳酸菌、有效用量最小、热量低、稳定性好、感观性好等特性[3-7].低分子果胶(MCP)具有重要的生理功能,主要表现为抗肿瘤作用,增强免疫功能,改善肥胖和降低血脂水平,辅助排毒[8-10].低分子果胶和果胶低聚糖虽然广泛存在柑橘胶质中,但含量很低,采用直接提取方法生产成本高,难以实现大规模的商品化生产;然而固定化内切聚半乳糖醛酸酶结合酶反应器为大规模制备POS和MCP提供了可能性.
果胶酶在实际应用过程存在诸多不足之处,如:由野生菌种分泌到胞外的蛋白种类多,增加了果胶酶分离纯化的难度,故目前商品化野生型果胶酶纯度较低;果胶酶活性偏低,导致催化水解效率偏低;现在市场上销售的果胶酶多为内切酶、裂解酶及果胶酯酶的混合物,缺少专一适用于制备POS、MCP的商品化内切聚半乳糖醛酸酶[11,12].黑曲霉(Aspergillus niger JL-15)为本实验室前期筛选的酶高产菌株,它主要产果胶酶、木聚糖酶、淀粉酶和葡聚糖酶[13].本研究采用 RT-PCR方法,克隆到黑曲霉内切聚半乳糖醛酸酶A基因(pgaA),并在大肠杆菌中获得分泌表达,有助于获得适用于制备POS、MCP的重组内切聚半乳糖醛酸酶.
1 材料和方法
1.1 实验材料
黑曲霉JL-15(Aspergillus niger JL-15)菌株由本实验室分离,其孢子于-20℃保存.Escherichia coli Rosetta-gami B(DE3)、pET-32a(+)购于Novagen;pUCm-T vector System、总 RNA提取试剂盒、逆转录试剂盒、PCR试剂盒和DNA Marker购于上海生工生物技术有限公司;质粒抽提试剂盒、PCR产物纯化试剂盒和割胶回收纯化试剂盒购于Axygen;T4DNA连接酶和限制性内切酶购自TaKaRa;酵母膏、蛋白胨购于Oxoid;其余常规试剂均为进口或国产分析纯.
1.2 黑曲霉内切聚半乳糖醛酸酶A基因(pgaA)的RT-PCR
根据GenBank中已登录的真菌内切聚半乳糖醛酸酶基因序列设计特异性引物,引物序列为:P1,5′-TCAG^AATTCATGCCTTCTGCCAAGCCTTTGT-3′,P2,5′-CAT GC^GGCCGCTTACT-GATCGCAAGAAGCAC-3′,并在上下游引物中分别引入EcoRI和NotI限制性内切酶识别位点.
将A.niger JL-15接种于YPD液体培养基中,30℃,150r/min培养48h,收集菌丝于灭菌后的滤纸上,吸干,再将菌丝置于灭菌后的研钵中,经液氮冷冻,碾磨;然后采用Trizol法提取黑曲霉总RNA[14],参照逆转录试剂盒操作说明合成cDNA.以cDNA为模板,P1和P2为引物进行目的基因的PCR扩增.PCR反应条件如下:94℃,4min;94 ℃,50s;62.6 ℃,50s;72 ℃,2min,循环34次;72 ℃,10min.PCR 产物经1.0%琼脂糖电泳分析,并割胶回收目的条带,回收产物与pUCm-T vector连接,构建重组质粒pUCm-T-pgaA,测定核苷酸序列.
1.3 黑曲霉内切聚半乳糖醛酸酶A基因(pgaA)在大肠杆菌中的表达
重组质粒pUCm-T-pgaA 经EcoRI和NotI双酶切,电泳,割胶回收的目的片段,定向插入酶切后的表达载体pET-32a(+)中,并转化E.coli Rosetta-gami B(DE3),转化产物涂布于含100mg/L氨苄青霉素的LB平板上,37℃培养12h,挑取单菌落,提取质粒进行PCR鉴定和双酶切鉴定.将阳性克隆子接种于LB液体培养基中(100mg/L氨苄青霉素),37℃、150r/min培养至A600=0.8左右,加IPTG(终浓度1mmol/L)30℃诱导培养8h,离心,取上清液测定果胶酶活性.
1.4 重组黑曲霉内切聚半乳糖醛酸酶A(rePGA)活性测定和SDS-PAGE
聚半乳糖醛酸酶活性测定采用DNS法[15],果胶酶活力单位(U)定义为:在最适反应条件下,以每1min生成1μmol还原糖(以D 半乳糖醛酸计)所需的酶量为一个酶活力单位.蛋白质浓度的测定采用Bradford法,牛血清白蛋白(BSA)为标准蛋白[16].选用不同底物浓度测定果胶酶活性,采用双倒数作图法求米氏常数(Km)和最大反应速度(Vmax)[17].
重组黑曲霉内切聚半乳糖醛酸酶A(rePGA)的SDS-PAGE分析参照Laemmli报道的方法[18],浓缩胶和分离胶的质量分数分别为5%和15%.以pET-32a(+)转化菌为对照,阳性表达子和对照菌株经培养,离心收集菌体,加5×SDSPAGE电泳上样缓冲液,100℃煮沸10min,离心,取上清液,等量蛋白上样.
1.5 温度对rePGA活性的影响及其热稳定性
测定rePGA在30~90℃下的活性,以确定其最适温度.rePGA在30~90℃下分别保温4min,然后冰浴5min,在最适条件下测定酶活,以未经热处理的rePGA在最适条件下的酶活为对照,计算残余酶活.
1.6 pH对rePGA活性的影响及其稳定性
分别用pH 3.0~9.0的缓冲液配制果胶底物,测定果胶酶活性,确定rePGA最适pH.将rePGA酶液pH分别调为pH3.0~9.0,在25℃条件下保温1h,然后在最适条件下测定酶活,计算rePGA的残余酶活.
1.7 金属离子对rePGA活性的影响
分别向rePGA酶液中添加CaCl2、MgSO4、CuSO4、ZnSO4、MnSO4、FeCl3、KCl和 AlCl3,各种金属离子的终浓度均为5.0mmol/L,在25℃下处理1h,计算rePGA残余酶活.
1.8 水解过程中果胶溶液粘度和还原糖的变化
以400mL 4.0%的果胶为底物,添加4.0mL的rePGA酶液(110U),在28℃条件下进行酶解反应,采用Brookfield DV-I Prime测定反应体系的粘度变化,选用S 02号转子,100r/min转速;每间隔5min取样测定反应体系的还原糖浓度.
2 结果与分析
2.1 黑曲霉内切聚半乳糖醛酸酶A基因(pgaA)的克隆及序列分析
从黑曲霉菌丝体中提取其总RNA,逆转录后进行PCR扩增,产物经1.0%的琼脂糖凝胶电泳检测,结果表明在1100bp大小附近存在特异条带(图1).测序结果表明,扩增产物序列全长为1113bp,与黑曲霉内切聚半乳糖醛酸酶A基因(pgaA)理论长度一致,为一个完整的开放阅读框(ORF),编码370个氨基酸残基(图2),所编码蛋白的理论相对分子质量为38800Da,pgaA与Genbank已登录的黑曲霉内切聚半乳糖醛酸酶A基因(CAB72125)的同源性为99%.
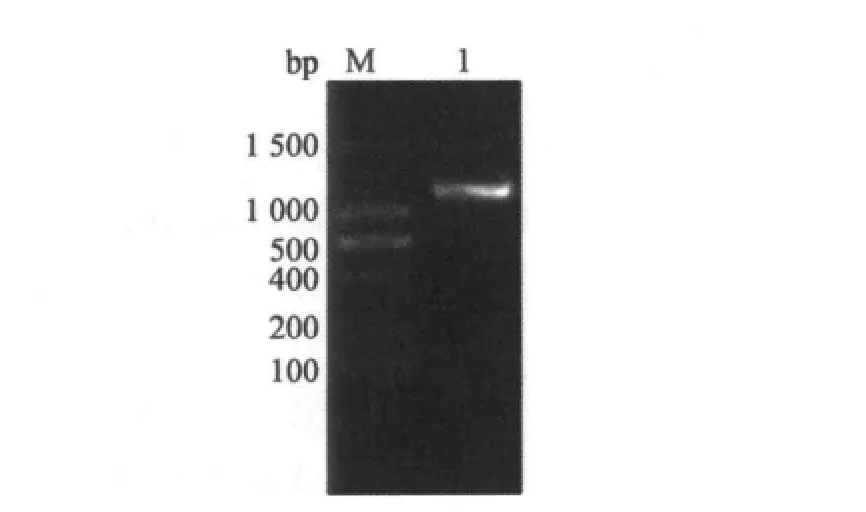
图1 黑曲霉内切聚半乳糖醛酸酶A基因(pgaA)PCR扩增Figure 1 Electrophoresis of pgaAfromA.niger
2.2 pgaA在大肠杆菌中的表达及SDS-PGAE分析
重组表达质粒pgaA-pET-32a(+)Vector经EcoRI、NotI双酶切后电泳,显示切出与目的基因大小一致的DNA片段(图3),表明克隆载体含有pgaA序列.pgaA-pET-32a(+)Vector转化E.coli Rosetta-gami B(DE3),挑取重组子于LB中,37℃培养12h,然后添加IPTG诱导,阳性子BL21pgaA7发酵上清液中的果胶酶活性最高,为637.0U/mg,分别高于黑曲霉深层发酵产果胶酶的活性和重组Burkholderia cepacia 果胶酶的活性[[19,20].
SDS-PAGE 结果表明,与对照相比,BL21pgaA7在40000Da附近存在特异性条带(图4),计算出的相对分子质量为40500Da,与理论值40000Da相近.酶促动力学研究表明,rePGA的米氏常数(Km)和最大反应速度(Vmax)分别为4.05mg/mL和39.37μmol/(mL·min)(图5),与野生型黑曲霉JL-15果胶酶的Km和Vmax相似.

图2 黑曲霉内切聚半乳糖醛酸酶A基因序列及编码的氨基酸序列Figure 2 Nucleotide sequences of pgaAand the deduced amino acid sequences

图3 重组表达质粒pgaA-pET-32a(+)Vector双酶切鉴定Figure 3 Digestion of pgaA-pET-32a(+)Vector
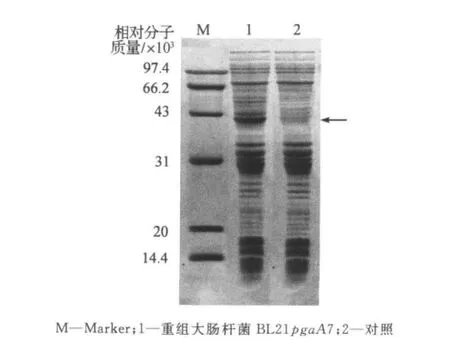
图4 重组大肠杆菌BL21pgaA7表达产物SDS-PAGE分析Figure 4 SDS-PAGE of BL21pgaA7
2.3 温度对rePGA活性的影响及其热稳定性
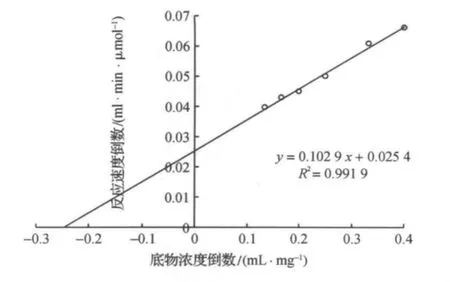
图5 rePGA的酶促动力学Figure 5 Michaelis-Menten kinetics of rePGA
在不同温度下,重组黑曲霉内切聚半乳糖醛酸酶(rePGA)的活性变化较大,在60℃时,酶活性达到最大值(图6),在70℃~80℃范围内,酶活性迅速降低.热稳定性研究表明,rePGA在低于50℃条件下较稳定,50℃处理5min,其残余酶活为64.37%.在高于65℃条件下,重组酶活性稳定性迅速下降,80℃处理5min后,其残余酶活仅为14.18%(图6).
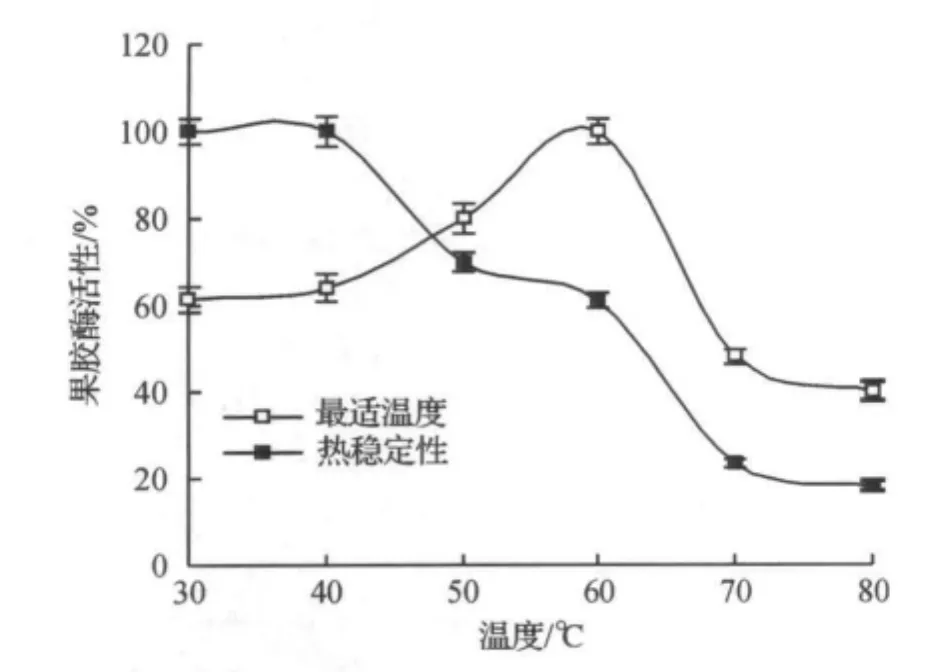
图6 温度对rePGA活性的影响及其热稳定性Figure 6 Optimum temperature and thermostability of rePGA
2.4 pH对rePGA活性的影响及其稳定性
在不同pH条件下,rePGA活性发生明显变化,在pH 5.0时酶活性达到最大值(图7),rePGA在酸性条件下活性较高,为嗜酸性酶.pH稳定性研究表明,重组酶在pH 5.0~9.0范围内较稳定,25℃处理30min,其残余酶活均在70%以上(图7).

图7 pH对rePGA活性的影响及其pH稳定性Figure 7 Optimum pH and pH stability of rePGA
2.5 金属离子对rePGA活性的影响
8种常见金属离子对重组酶活性的影响各异(图8).Ca2+对rePGA酶活具有显著促进作用,经过1h处理,果胶酶活性是对照组的为137.95%.Fe3+、Mg2+、Mn2+、Al3+对rePGA的活性具有明显抑制作用,处理后的残余酶活分别是对照组的14.36%、0.89%、58.1%、70.2%,其它2种金属离子对rePGA活性无显著影响.Ca2+对米曲霉JL-14果胶酶活性无显著影响[21],但对枯草芽孢杆菌JL-13果胶酶活性有显著的促进作用[22].Mn2+对米曲霉JL-14果胶酶和Mucor rouxii果胶酶活性均有显著促进作用[23].

图8 金属离子对rePGA活性的影响Figure 8 Effect of metal ions on rePGA activity
2.6 水解过程中果胶溶液粘度和还原糖的变化
rePGA能快速降低果胶溶液的粘度并使反应体系的还原糖浓度升高(图9).反应前期的粘度降低幅度显著高于反应后期,而还原糖浓度的变化则是反应前期小于反应后期,该结果与rePGA的内切作用模式相符,经过30min水解rePGA使果胶溶液的粘度降低了72%,还原糖的质量浓度增加到11.2mg/mL.米曲霉果胶酶经过30min水解作用使橘皮果胶溶液的粘度降低了80%[18],粘度降低的幅度高于rePGA的作用效果.
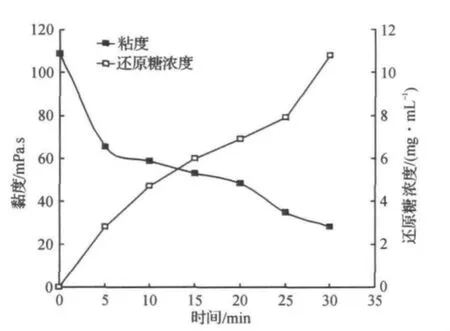
图9 水解过程中底物粘度与还原糖质量浓度的变化Figure 9 Change in viscosity and concentration of reducing sugars during hydrolysis of pectin by rePGA
3 结 语
目前商品化果胶酶生产菌株多为野生真菌菌株或突变选育菌株,实验室前期分离到多株果胶酶高产菌株,并对其发酵条件和酶学性质进行了研究,但野生型菌株分泌的杂蛋白较多,增加了果胶酶分离纯化的难度.构建高产果胶酶基因工程菌,可以使繁琐的酶蛋白分离纯化变得简单快捷,也有助于获得专一性的内切聚半乳糖醛酸酶.本研究采用RT-PCR的方法克隆到黑曲霉内切聚半乳糖醛酸酶A基因(pgaA),该基因ORF全长1113bp,编码370个氨基酸残基;pgaA定向插入表达载体pET-32a(+)中,在E.coli获得分泌表达,重组黑曲霉内切聚半乳糖醛酸酶A(rePGA)最高活性为637.0U/mg,相对分子质量约为40500Da,Km和Vmax分别为4.05mg/mL 和39.37μmol/(mL·min).rePGA 的最适温度为60℃,最适pH为pH 5.0.rePGA能快速降低果胶溶液的粘度,符合其内切作用模式特点,表明其初步具备适用于制备POS和MCP的特性.
[1]VLUGT-BERGMANS C J B,VAN DER MEEUWSEN P J A,VORAGEN A G J,et al.Endo-xylogalacturonan hydrolase,a novel pectinolytic enzyme[J].Applied Environmental Microbiology,2000,66:36-41.
[2]YADAV S,YADAV P K,KAPIL D Y,et al.Pectin lyase:A review[J].Process Biochemistry,2009,44:1-10.
[3]OLANO M,RIMBACH G H.Pectins and pectic oligosaccharides inhibit Escherichia coli O157:H7Shiga toxin as directed towards the human colonic cell line HT29[J].FEMS Microbiology Letters,2003,218:101-105.
[4]KASHYAP D R,VOHRA P K.CHOPRA S.Applications of pectinases in the commercial sector:a review[J].Bioresource Technology,2001,3:215-227.
[5]ELBOUTACHFAITI R,DELATTRE C,MICHAUD P,et al.Oligogalacturonans production by free radical depolymerization of polygalacturonan[J].International Journal of Biologicol Macromolecucar,2008,43:257-261.
[6]丁长河,鲁慧芳,张建华.双歧因子果胶低聚糖的研究进展[J].现代食品科技,2005,21:80-82.
[7]SALAM A M.Functional foods:hopefulness to good health[J].American Journal of Food Technology,2010,5(2):86-99.
[8]汪 峰,刘海鹰.低分子柑橘果胶对结肠癌细胞奥沙利铂敏感性的影响[J].实用医学杂志,2011,27(21):3828-3831.
[9]张若培,范晓青,陈建国,等.低分子柑桔果胶粉对肥胖大鼠调节血脂及瘦素的研究[J].浙江预防医学,2008,20(1):7-9.
[10]邬晓婧,张爱珍,陈建国,等.低分子柑桔果胶粉对糖尿病小鼠血糖、血脂的调节作用[J].中国全科医学,2006,9(20):1685-1686.
[11]OGLU S,DEMIR N,ACAR J,et al.The use of commercial pectinase in the fruit juice industry,part 2:Determination of the kinetic behaviour of immobilized commercial pectinase[J].Journal of Food Engineering,2001(4):271-274.
[12]高振红,岳田利,袁亚宏,等.果胶酶在果品加工中的应用及其组装研究[J].农产品加工,2007(3):31-35.
[13]刘明启,关荣发,陈文伟.黑曲霉固体发酵产木聚糖酶的相应面优化设计及其酶学性质的研究[J].农业生物技术学报,2010,18(1):52-60.
[14]SAMBROOK J,RUSSELL D W.Molecular Cloning:A laboratory manual[M].Third ed.USA:Cold Spring Harbor Laboratory Press,2001:576-578.
[15]MILLER G L,BLUM R,GLENNOM W E,et al.Measurement of methods for assay of xylanase activity[J].Analytical Biochemistry,1959,21:27-132.
[16]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[17]郭 勇.酶工程原理与技术[M].北京:高等教育出版社,2005:211-212.
[18]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1976,227:680-685.
[19]PATIL S R,DAYANANA A.Production of pectinase from deseeded sunflower head by Aspergillus niger in submerged and solid-state conditions[J].Bioresource Technology,2006,97:2054-2058.
[20]MASSA C,DEGRASSI G,DEVESCOVI G,et al.Isola-tion,heterologous expression and characterization of an endo-polygalacturonase produced by the phytopathogen Burkholderia cepacia[J].Protein Expression and Purification,2007,54:300-308.
[21]刘明启,刘光富,戴贤君,等.优化米曲霉固体发酵产果胶酶及产物酶学性质[J].中国计量学院学报,2010,21(2):146-151.
[22]白兰芳,高 慧,刘明启,等.产果胶酶枯草芽孢杆菌的鉴定、发酵条件优化及产物酶学性质的研究[J].中国畜牧杂志,2011,47(19):63-68.
[23]BRIAND N S M,BRIAND C G Y,MICHAUD P.Production,purification and characterization of an endopolygalacturonase from Mucor rouxii NRRL 1894[J].Enzyme Microbial Technology,2007,41:800-805.
