亚砷酸钠抑制血小板源性生长因子受体β介导的细胞迁移及其机制
2012-08-02鄢春亭吉化总医院内分泌科吉林吉林132021
李 晶 鄢春亭 (吉化总医院内分泌科,吉林 吉林 132021)
砷中毒可以导致动脉粥样硬化、冠心病等,严重者导致肿瘤,这些疾病的发生都是以血管内皮损伤为基础。损伤后机体的自我修复主要包括两个方面:损伤部位周围正常细胞的增殖和远处正常细胞的迁移。血小板源性生长因子(PDGF)与其受体(PDGFR)结合后主要参与血管壁细胞的发育,具有促进外膜细胞、平滑肌细胞增殖和迁移作用,在血管形成后期发挥重要作用。间质溶解素1(又称为 MMP3)是基质金属蛋白酶(MMP)家族的重要成员,有着广泛的分解底物,包括蛋白聚糖、纤维结合蛋白、层黏连蛋白和Ⅳ型胶原蛋白等。除此之外,MMP3可以增强其MMPs的活性〔1~3〕。而基质的降解是细胞发生迁移的基础。本课题组利用前期建立的稳定表达PDGFRβ的猪动脉内皮细胞(PAE)细胞系〔4〕,进一步研究砷作用激活PDGFRβ通路时,MMP3基因表达的情况,为地砷病相关机制研究提供参考。
1 材料与方法
1.1 细胞及试剂 PAE细胞,PDGFB链纯合二聚体(PDGFBB),人 PDGFRβ 表达质粒(PDGFRβ/pcDNA3.0),空载质粒(pcDNA3.0)为瑞典Uppsala大学Heuchel和Heldin博士惠赠。亚砷酸钠(NaAsO2)购于Sigma公司,F12培养基购于Gibco公司,Lipofectamine 2000 和 RNA 提取试剂(Trizol-Reagent)购自Invitrogen,RNase free DNase I 购自 Promega,RT-PCR 试剂盒购自TaKaRa,PCR Marker、琼脂糖均为Promega公司产品,PCR引物由上海生物工程合成。
1.2 方法
1.2.1 细胞培养和转染 细胞培养在含10%胎牛血清的F12培养基中(含青霉素100 U/ml、链霉素100 μg/ml),置于5%CO2、饱和湿度、37℃条件下培养。指数增长期细胞,按1×105/ml的密度接种于24孔培养板。培养24 h后,分别用人PDGFRβ表达载体(PDGFRβ/pCDNA3.0)及其空载(pCDNA3.0)质粒转染细胞。转染应用脂质体 Lipofectamine 2000介导的方法,按照厂家产品说明书进行。
1.2.2 细胞总RNA提取及RT-PCR检测人PDGFRβ 应用Trizol Reagent提取细胞总RNA,用RNase free DNase I对所获样品进行处理,除去可能污染的DNA分子。应用RT试剂盒将提取的总RNA逆转录为cDNA,反应条件:30℃、10 min,42℃、30 min,99℃、5 min,5℃、5 min;PCR 以得到的 cDNA 为模板进行PCR,反应总体系50 μl,取 RT反应产物10 μl加入 PCR 反应液(TaKaRa)40 μl中。人 PDGFRβ引物库 ID为 NM_002609,上游引物序列 5′-TGATGCCGAGGAACTATTCATCT-3′;下游引物序列 5′-TTTCTTCTCGTGCAGTGTCAC-3′,扩增产物为103 bp。反应条件:94℃、2 min,94℃变性 15 s,53℃退火,72℃延伸45 s,共35个循环。最后72℃、5 min。PCR产物用2%琼脂糖凝胶系统电泳(含溴化乙啶),拍照鉴定。用Pharmacia Image Master凝胶成像仪观察分析基因表达的变化,结果用灰度值表示。
1.2.3 细胞损伤24 h完全修复所需PDGFBB最低浓度的测定 细胞按1×105/ml密度培养于24孔板中,待细胞完全汇合后,用200 μl枪头制造划痕,经磷酸盐缓冲液(PBS)洗去游离细胞后加入不同浓度PDGFBB,无血清培养24 h后于共聚焦显微镜下观察划痕的修复(迁移),测量划痕宽度。
1.2.4 NaAsO2对细胞迁移抑制率的检测 细胞按5×105/ml密度培养于24孔板中,24 h后,用200 μl枪头制造划痕,PBS洗去游离细胞后,每孔加入1 ml用无血清的F12(含10 μg/L PDGFBB)配制好的不同浓度(0、2.5、5、10、20 μmol/L)NaAsO2溶液,每一浓度设3个复孔,培养24 h。观察细胞迁移抑制率,微分干涉(DIC)拍照。抑制率公式:(孵育后的细胞划痕宽度/孵育前的细胞划痕宽度)×100%。
1.2.5 细胞总RNA提取及RT-PCR检测MMP3 mRNA表达指数增长期的细胞以5×105/ml密度培养于6 cm培养皿中,待细胞融合 80%时,加入 F12(含10 ng/L PDGFBB)配制的NaAsO2,最终浓度分别为0、5、20 mol/L,每个组别各设三组平行样,用于RNA的提取。应用Trizol Reagent提取细胞总RNA
(按说明书提取),用RNase free DNase I对所获样品进行处理,除去可能污染的DNA分子。应用RT试剂盒将提取的总RNA逆转录为 cDNA,反应条件:42℃、60 min,70℃、15 min,4℃、5 min;以得到的cDNA为模板进行PCR,反应总体系50 μl,取RT反应产物10 μl加入 PCR反应液(TaKaRa)40 μl中。因本实验研究的 PAE细胞稳定表达 PDGFRβ,所以本实验把PDGFRβ定为内参基因。MMP3:上游引物 5′-ACGGACCTCCCCCAGCTTCC-3′;下游引物 5′-GGATCACATGTGGCCGGCGT-3′扩增产物为 88 bp。反应条件:94℃、2 min,94℃、15 s,58℃、30 s,72℃、30 s,共 40 个循环。循环结束后 72℃、5 min。PCR产物用2.5%琼脂糖凝胶系统电泳(含溴化乙啶),拍照鉴定。用Pharmacia Image Master凝胶成像仪观察分析基因表达的变化,结果用灰度值表示。
1.3 统计学方法 采用SPSS13.0统计软件,细胞划痕实验检测结果以±s表示,组间差异比较采用单因素方差分析。
2 结果
2.1 RT-PCR检测人PDGFRβ在转染细胞中的稳定表达 外源人PDGFRβ mRNA只在其表达质粒转染的细胞中呈高水平表达,对细胞进行跟踪检测发现,PDGFRβ在该细胞中持续稳定高水平表达,而在未转染及空载转染细胞中均未见表达。见图1。
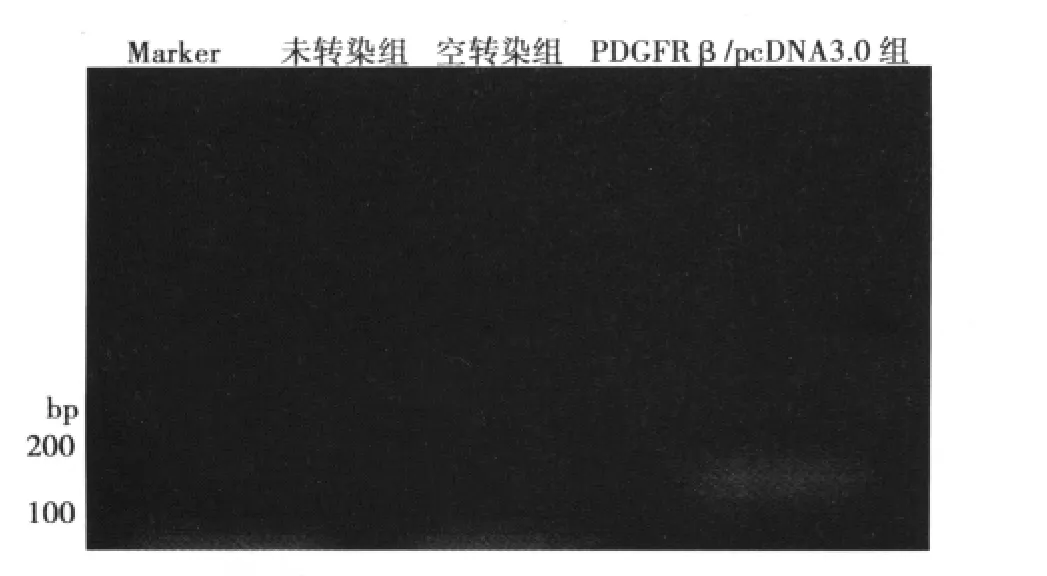
图1 PDGFRβ在各组细胞中的表达
2.2 细胞损伤24 h完全修复所需PDGFBB最低浓度的测定未加入PDGFBB的对照组划痕宽度与培养前无明显差异,均为 550 μm;5 μg/L PDGFBB 组可见划痕宽度为 140 μm;PDGFBB≥10 μg/L时划痕已完全修复,宽度为0 μm。即经24 h细胞划痕完全愈合所需的PDGFBB最低浓度为10 μg/L。
2.3 NaAsO2对细胞迁移抑制率的作用 NaAsO2作用细胞24 h后,划痕宽度随着NaAsO2浓度的增高越来越宽,代表细胞迁移抑制率随着NaAsO2浓度的增加而增加,其抑制作用呈明显的剂量效应关系。2.5~20 μmol/L NaAsO2组间比较均有显著性差异(P<0.05)。见表1。
2.4 不同浓度 NaAsO2作用下 MMP3 mRNA的表达 0、5、20 μmol/L三组中 MMP-3 mRNA 表达灰度值为:4.58 ± 1.14,2.06 ± 0.37,1.12 ± 0.68。5、20 μmol/L 组与 0 μmol/L 组相比MMP-3表达下调,其中20 μmol/L组下调的更为明显(P<0.05),20 μmol/L 组与5 μmol/L 组相比 MMP-3 表达也明显下调(P<0.05)。可见,MMP-3 mRNA的表达随着浓度的NaAsO2增加而逐渐降低,有剂量依赖效应。见图2。
表1 NaAsO2对细胞迁移的抑制作用(n=3,±s)

表1 NaAsO2对细胞迁移的抑制作用(n=3,±s)
组间比较:1)P<0.05
组别 划痕宽度(μm) 抑制率(%)空白对照组 -0 2.5 μmol/L NaAsO2组 49.7 ±3.061) 23.991)5 μmol/L NaAsO2组 73.0 ±6.081) 35.271)10 μmol/L NaAsO2组 126.0 ±8.181) 60.871)20 μmol/L NaAsO2组 180.0 ±23.891) 86.961)
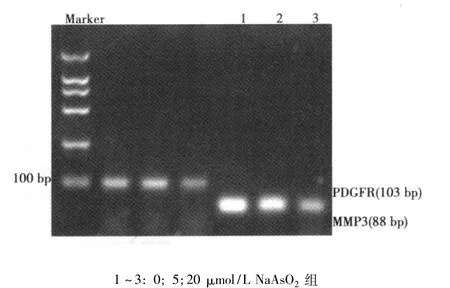
图2 不同NaAsO2浓度组中MMP3 mRNA表达的RT-PCR检测结果
3 讨论
血管内皮细胞是决定血管活性的重要因素,内皮细胞的增殖和迁移是血管损伤后修复的一个重要环节,所以研究血管损伤修复需要一个实验模型。
本实验建立了稳定表达人 PDGFRβ的PAE细胞,加入PDGFBB后,该通路被激活,可以引起明显的细胞迁移〔4〕。由于PAE本身并不表达PDGFRβ,所以这个模型建立成功后,可以更好地研究砷剂影响细胞迁移是否与PDGFR通路有关。本实验结果显示,随着砷浓度增加,细胞迁移受到抑制,呈现出剂量效应关系,说明砷中毒后破坏了血管内皮细胞的修复功能,这可能是随着砷中毒病情的进展会导致动脉粥样硬化,甚至肿瘤形成的一个重要原因。
MMP3的功能是调节细胞外基质的重建,可以降解几乎全部的细胞外基质成分。正常情况下MMP3处于很低的表达水平,但在外界刺激、内环境改变(细胞因子刺激)等影响时均可引起MMP3表达的改变〔5〕。有文献报道动脉粥样硬化患者MMP-3表达可能受细胞因子和生长因子的调节〔6〕。本文在检测MMP3表达时发现,在PDGFBB刺激下,MMP3表达增强。但是,随着砷浓度的增加,MMP-3表达明显下降,提示砷剂抑制PDGFR介导的细胞迁移是通过下调MMP-3来实现的。这个结论为砷中毒导致的心血管疾病的发生,甚至肿瘤发生的机制研究提供理论依据。
1 Woessner JF Jr.Matrix metalloproteinases and their inhibitors in connective tissue remodeling〔J〕.FASEB J,1991;5(8):2145-54.
2 Ogata Y,Itoh Y,Nagase H.Steps involved in activation of the pro-matrix metalloproteinase 9(progelatinase B)-tissue inhibitor of metalloproteinases-1 complex by 4-aminophenylmercuric acetate and proteinases〔J〕.J Biol Chem,1995;270(31):18506-11.
3 Libby P.Molecular bases of the acute coronary syndromes〔J〕.Circulation,1995;91(11):2844-50.
4 史艳芬,李 晶,李玉林,等.鸦胆子乙醇提取物对血小板源性生长因子受体介导细胞迁移的抑制作用〔J〕.吉林大学学报(医学版),2009;35(4):608-11.
5 栾朝霞,高沁怡,裴著果.洛伐他汀对血管平滑肌细胞基质金属蛋白酶3表达的影响〔J〕.中国动脉硬化杂志,2003;11(4):339-41.
6 Kanaki T,Bujo H,ORI S,et al.Functional analysis of aortic endothelial cells expressing mutant PDGF receptors with respect to expression of matrix metalloproteinase-3〔J〕.Biochem Biophys Res Commun,2002;294(2):231-7.ORI S,et al.
