IL-17、IL-22与乙型病毒性肝病的相关性分析
2012-07-31刘家秀许国莹王莉娟潘继承
刘家秀,许国莹,徐 彬,王莉娟,潘继承
(1淮阴卫生高等职业技术学校,江苏淮安 223300;2淮安市传染病医院;3江苏省省级机关医院)
长期以来,在乙型病毒性肝病(HB)的发病机制中,免疫应答及细胞因子的作用一直受到国内、外学者的广泛关注。Th17细胞(Thelp cell 17)是一类新发现的效应性CD+4Th细胞亚群,独立于Th1和Th2[1]。其发现弥补了传统的Th1/Th2模式在解释疾病免疫病理机制中的局限性,成为近年来研究的热点。研究发现,Th17细胞分泌的 IL-17、IL-17F、IL-21、IL-6、IL-22 和肿瘤坏死因子-α(TNF-α)等细胞因子参与了肝脏损伤及再生过程,在脂肪肝、自身免疫性肝病及肝脏肿瘤中发挥重要作用[2]。2010年1月~2011年6月,我们检测了HB患者外周血IL-17、IL-22变化,并分析其与肝纤维化指标的关系,旨在为HB的诊疗提供新的思路。
1 资料与方法
1.1 一般资料 84例HB患者为2010年1月~2011年6月淮安市传染病防治院门诊和住院患者,男52例,女32例;年龄26~78岁,平均42.5岁。急性肝炎18例(急性肝炎组),慢性肝炎26例(慢性肝炎组),肝硬化24例(肝硬化组),肝癌16例(肝癌组)。所有病例均符合2000年中华医学会传染病与寄生虫病学分会制定的《病毒性肝炎防治方案》中的诊断标准[3],并排除合并感染其他病毒性肝炎,排除心、脑、肾、肺等器官疾病及高血压、糖尿病等。健康组为40例健康体检者,其中男28例,女12例,年龄26~67,平均39.3岁。各组性别及年龄有可比性。
1.2 相关指标检测 各组均取空腹静脉分离血清,于-80℃保存,行以下指标检测。
1.2.1 IL-17及 IL-22水平 IL-17检测采用单克隆抗体夹心ELISA法,由全自动酶免分析仪测定结果,试剂盒由Sigma公司提供,严格按试剂说明书操作。血清IL-22检测采用IL-22抗体(Santa Cruz,美国)包被于反应板微孔,于4℃过夜;用含10 g/dL BSA的封闭液37℃封闭2 h,于每孔中加入待检样本并于37℃孵育2 h,洗涤后加入HRP标记的羊抗人IgG(Zymed Laboratories,美国)于37℃孵育1 h,加人TMB显色液,采用酶联仪450 nm波长进行比色分析,读取A值,并与标准曲线比较进而获取IL-22血清表达水平。
1.2.2 透明质酸(HA)、层黏蛋白(LN)和Ⅳ型胶原蛋白(ⅣC)水平采用ELISA法测定,试剂盒由中科院上海细胞生物研究所提供。
1.2.3 总胆红素(TBIL)和 γ-谷氨酰转移酶((γ-GT)水平 采用常规自动生化分析仪测定。
1.2.4 相关性分析 对IL-17及IL-22水平与ⅣC、LN和HA及肝癌组IL-22水平与TBIL、γ-GT水平的相关性进行分析。
1.3 统计学方法 采用SPSS14.0软件进行统计学处理。计量资料采用±s表示,均数间比较采用方差分析和t检验,相关性分析采用Spear-man线性相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 IL-17及IL-22水平 见表1。
表1 各组IL-17、IL-22水平比较(±s)

表1 各组IL-17、IL-22水平比较(±s)
注:与健康组比较,▲P <0.01;与急性肝炎组比较,#P <0.05;与慢性肝炎组比较,*P <0.05;与肝硬化组比较,△P <0.05
组别 n IL-17(ng/mL) IL-22(pg/mL)急性肝炎组 18 123.32±32.62▲△ 450.68±43.26▲△慢性肝炎组 26 106.63±35.21▲△ 530.14±24.23▲△肝硬化组 24 401.41 ±25.27▲#* 683.42 ±76.28▲#*肝癌组 16 1462.58 ±10.02▲#*△ 824.53 ±64.20▲#*△健康组 40 35.24±11.25#*△ 384.32±86.83#*△
2.2 ⅣC、LN、HA及TBIL、γ-GT水平 见表2。
2.3 相关性分析 IL-17、IL-22分别与HA、LN和ⅣC水平呈正相关,见表3;肝癌组 IL-22水平与TBIL、γ-GT 水平均呈正相关,r分别 =0.384、0.358,P 均 <0.05。
表2 各组ⅣC、LN、HA及TBIL、γ-GT水平比较(±s)

表2 各组ⅣC、LN、HA及TBIL、γ-GT水平比较(±s)
注:与健康组比较,▲P <0.05,与急性肝炎组比较,#P <0.05,与慢性肝炎组比较,*P <0.05,与肝硬化组比较,△P <0.05
组别 n ⅣC(ng/mL) LN(ng/mL) HA(ng/mL) TBIL(μmol/L) γ-GT(IU/L)急性肝炎组 18 106.21±21.70*△ 98.46±10.12*△ 98.54±31.25*△ 112.31±15.34*△ 76.14±21.02*△慢性肝炎组 26 265.56 ±32.21▲#△ 122.24 ±12.10#△ 148.42 ±22.10▲#△ 68.64 ±22.13# 246.54 ±20.32#肝硬化组 24 450.68 ±52.27▲#* 348.20 ±76.28▲#* 368.39 ±13.27▲#* 70.28 ±31.22# 269.36 ±41.16#肝癌组 16 786.91 ±16.28▲#*△ 753.45 ±20.15▲#*△ 743.19 ±58.03▲#*△ 116.46 ±32.24▲*△ 501.26 ±42.38▲#*△健康组 40 94.42 ±56.21 92.43 ±13.22 85.12 ±12.24 14.26 ±6.31 34.26 ±12.23
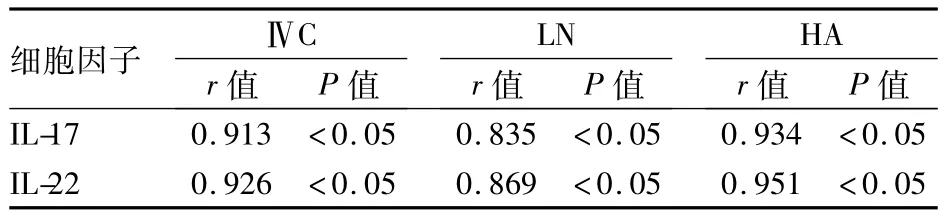
表3 IL-17、IL-22与ⅣC、LN和HA的相关性
3 讨论
Th17细胞是2005年新发现的第三种效应性Th细胞亚群[4]。Thl7细胞的提出是对Th1和Th2细胞介导的组织损伤假说的第一次修订,具有里程碑意义[5]。在肝脏相关疾病中,Th17细胞分泌的IL-17、IL-17F、IL-21、IL-6、IL-22 等细胞因子通路与肝脏损伤的密切关系得到越来越多的证据支持。
IL-17是Th17细胞分泌的重要细胞因子之一。具有促炎症作用,可诱导促炎细胞因子(如IL-6、TNF)、趋化因子和基质金属蛋白酶表达,引起组织细胞浸润和破坏;亦参与中性粒细胞的增殖、成熟和趋化,对T细胞的活化起协同刺激作用。IL-22是Th17细胞分泌的另一重要细胞因子,属IL-10家族成员。在Th17细胞中,IL-22与IL-17一起分泌,有研究显示,IL-22与IL-17共同表达可以认为是自身攻击性T细胞的标志,两者协同作用促进炎性发生造成组织损伤[6];但另有研究显示,IL-22在急性肝损伤中起保护作用[7]。Th17细胞正是通过其分泌的多种细胞因子参与宿主防御、感染、肿瘤、自身免疫性疾病、移植排斥等病理过程。
本研究结果显示,随着肝病的进展、肝损害严重程度加重,外周血IL-17及IL-22水平依次增高,以肝癌患者表达水平最高。肝纤维化或肝硬化是由于胶原和其他细胞外基质(ECM)的合成与降解失衡、在肝内过量沉积所致。近年来细胞外基质HA、LN和ⅣC用于临床纤维化的辅助诊断。有文献报道,肝组织内Thl7细胞主要集中于汇管区及纤维化区[8],本研究结果显示,随肝病进展,HA、LN 和ⅣC水平逐渐升高,且IL-17、IL-22分别与HA、LN和ⅣC水平呈正相关;IL-22与TBIL、γ-GT均呈正相关。不仅提示Thl7细胞分泌的IL-17、IL-22在病毒感染后引起的免疫反应与组织损伤有关,也进一步提示IL-17、IL-22可能参与了肝纤维化的发生,尤其是IL-22在肝癌的形成中起重要作用。有报道,急性肝组织损伤时IL-22有限制肝细胞损伤的作用,此可能与IL-22可保护肝细胞免遭活化T细胞的破坏作用有关,具体机制有待进一步研究。
目前,临床上对各种肝病,尤其是肝纤维化、肝癌的诊断主要根据影像及肝组织活检。虽然已开展血清学相关免疫指标及ECM检查,但尚未能建立全面反映肝病全貌的血清学指标。本研究结果提示,检测IL-17、IL-22结合相关指标对慢性肝炎、肝纤维化和肝癌流行病学调查、临床诊断、病情分析及预后判断均具有重要价值;对IL-17、IL-22等细胞因子通路与肝脏损伤机理的深入研究,将为各类肝病的免疫干预治疗提供新的靶点。
[1]Park H,Li I,Yang Xo,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[2]Ge J,Wang K,Meng QH,et al.Implication of Th17 and Th1 cells in patients with chronic active hepatitis B[J].J Clin Immunol,2010,30(1):60-67.
[3]病毒性肝炎防治方案.中华传染病杂志,2001,19(1):56-62.
[4]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17 producingeffector T cells develop via a lineage distinct from the The helper type1 and 2 lineage[J].Nat Immunol,2005,6(11):1123-1132
[5]Bettelli E,Oukka M,Kuchroo VK.Th17 cells in the circle of immunity and autoimmunity[J].Nat Immunol,2007,8(4):345-350.
[6]Zheng Y,Danilenko DM,Valdez P,et al.Interleukin-22,a T(H)17 cytokine,mediates IL-23-induced dermal inflammation and acanthosis[J].Nature,2007,445(7128):648-651.
[7]Zenewicz LA,Yancopoulos GD,Valenzuela DM,et al.Interleukin-22 but not interleukin-17 provides protection to hepatocytes during acute liver inflammation[J].Immunity,2007,27(4):647-659.
[8]张耿林,高志良.Th17细胞在肝脏疾病的研究进展[J].中国病毒病杂志,2011,1(3):227-230.
