一种从富含多糖果实中提取RNA的方法
2012-07-31宋红苗徐祥彬
宋红苗,马 杰,徐祥彬
(杭州师范大学 生命与环境科学学院,浙江 杭州 310036)
从植物组织中提取纯度高、完整性好的RNA是进行分子生物学方面研究,如 cDNA合成、Northern杂交、mRNA分离、RT-PCR、cDNA文库构建及体外翻译等的必要前提和关键。许多生物材料在提取核酸时,都会遇到多糖的污染问题。多糖的许多理化性质与RNA很相似,很难将它们分开,在去除多糖的同时RNA也容易被裹带走,造成RNA产量的减少。在沉淀RNA时,也容易产生含有多糖的RNA凝胶状沉淀,这种RNA沉淀难溶于水,或溶解后产生粘稠状的溶液。此外,多糖还可以抑制许多酶的活性[1],因此污染了多糖的 RNA样品无法用于进一步的分子生物学研究。
果实中富含多糖类物质,在提取过程中能与RNA共同沉淀,很难将其分开,从而影响RNA的质量,影响进一步的分子生物学研究。为了能获得高质量的RNA,我们对果实RNA提取技术进行了探索。通过反复探索,我们利用醋酸钾沉淀多糖,结合多次氯仿抽提和LiCl沉淀RNA的方式,得到了一个可以在冬枣、葡萄、甜樱桃、桃、番茄等含不同丰度多糖的果实中适用的RNA提取方法。
1 材料与方法
1.1 材料
供试果实有葡萄,甜樱桃,冬枣,桃子和番茄。
供试生物化学试剂有水饱和酚、氯仿、醋酸钾、Tris碱、70% 乙 醇、SDS、DEPC、NaCl和LiCl。
溶液配制参照分子克隆实验指南第2版。
RNA 提 取 液 配 制:50 mmol·L-1Tris-HCl(pH 值 9.0),100 mmol NaCl,1%SDS。
1.2 RNA提取和检测
取果实10 g,置液氮中研磨成粉末,转移至经DEPC处理过的50 mL离心管中,然后加入20 mL预热到65℃的水饱和酚/RNA提取液(7 mL水饱和酚,13 mL RNA提取液),混匀后剧烈振荡10 min,再加入10 mL氯仿,混匀,4℃静置5 min,10 000 g离心20 min,然后取上清液转移至一个新的经DEPC处理过的50 mL离心管,再加入1/3体积醋酸钾(pH值4.8,5 mol·L-1),混匀,再剧烈振荡5 min,4℃静置30 min,10 000 g离心20 min,再将上清液转移至另一个新的经DEPC处理过的50 mL离心管,加入等体积氯仿,抽提10 min,10 000 g离心30 min(氯仿抽提步骤重复2~3次)。最后取上清液,加入1/3体积的 LiCl(8 mol·L-1),混匀,于4℃ 放置 12 h以上沉淀RNA,然后4℃下10 000 g离心20 min,弃上清留沉淀,用70%的乙醇洗涤后,吹干沉淀,用适量DEPC处理的ddH2O溶解RNA。
分光光度法检测RNA。分别取1 μL葡萄、冬枣、甜樱桃、桃和番茄的RNA,用Nanodrop分光光度计测定 D260、D280和 D230,通过 D260/D280和D260/D230的比值来检测果实 RNA含量、质量和纯度。
电泳法检测 RNA。分别取2 μL葡萄、冬枣、甜樱桃、桃和番茄的RNA,用1%的琼脂糖凝胶电泳检测其完整性。
2 结果和分析
2.1 分光光度法检测果实总RNA的含量和质量
表1结果表明,用分光光度法在5种含糖量较高的果实中提取的RNA都具有较高的质量和含量。
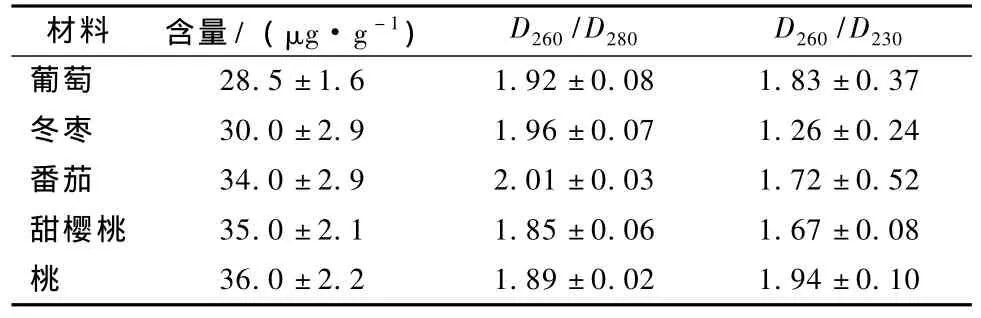
表1 分光光度法检测的果实总RNA含量和质量
2.2 凝胶电泳检测总RNA的完整性
取2 μL提取的葡萄、冬枣、甜樱桃、桃、番茄RNA,用1%的琼脂糖凝胶电泳检测,通过凝胶成像可以观测到比较完整的 RNA(图1),其中28S RNA的亮度大约是18S RNA的2倍。
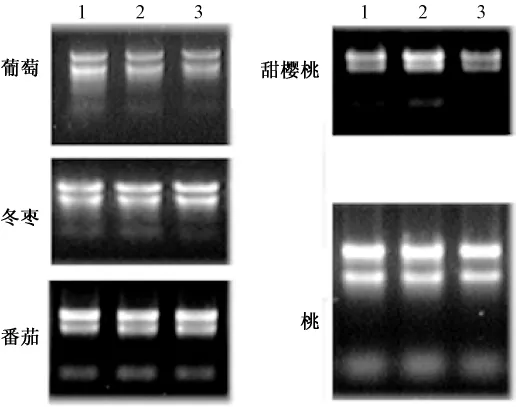
图1 不同果实提取的RNA凝胶电泳
3 小结和讨论
果实成熟是一个复杂的发育调控过程,伴随着许多生理生化变化,除呼吸上升、乙烯合成、果实软化和色素转变外,糖等风味物质的含量也产生了很大的变化。果实采收前以淀粉的方式积累的碳水化合物,随着果实成熟的进程,被淀粉酶水解成可溶性糖,使其含糖量升高[2-4]。冬枣、葡萄、甜樱桃、桃、番茄等果实含有不同程度的多糖,其中冬枣含有34%~40%的多糖,葡萄含有15%~30%的多糖,甜樱桃含有12%~15%的多糖,桃含有6%~15%的多糖,番茄含有2%左右的多糖。为了在果实中能获得高质量的RNA,有效去处多糖,本文我们对含不同程度多糖的果实RNA提取技术进行了探索。
通过醋酸钾(pH值 4.8,5 mol·L-1)沉淀多糖,再经过3次的氯仿重复抽提,最后经过LiCl(8 mol·L-1)沉淀RNA,结果证明,用该方法提取的果实总RNA完整性好,纯度高,提取的RNA的数量也比较大,可以在1 g果实中提取到大约35 μg左右的总RNA。RNA样品纯度也已达到标准的D260/D280为1.8~2.2和 D260/D230>1.0,完全可以满足基本的分子生物学实验要求,可以用来进行RT-PCR和Northern杂交。
本方法的优点是先利用醋酸钾(pH值4.8,5 mol·L-1)沉淀多糖,在较低的pH下,高浓度的K+有利于将多糖沉淀至下层,而RNA则保留在上层溶液,从而去除RNA中的部分多糖,并造成上层RNA液相中高浓度的 K+,有利于随后氯仿抽提,进一步去除RNA中的多糖成分。经过以上2个步骤以后,RNA中的多糖成分可以被去除很大一部分,最后再通过 LiCl沉淀可以得到较高质量和数量的RNA。在提取糖含量不同的果实RNA过程中,提取方法可以灵活变化,比如在对含糖量较低的桃和番茄果实RNA提取过程中,我们用醋酸钾(pH值4.8,5 mol·L-1)沉淀多糖后,仅仅经过1次氯仿抽提,然后LiCl沉淀,就可以得到较高质量和数量的RNA。
然而,在提取含糖量较高的果实RNA的过程中,需要多步骤去除多糖,因此提取时间过长(15~19 h)是本方法的1个弱点,容易使得提取过程中的RNA降解,造成RNA提取的失败。因此,在提取RNA过程中,应该尽量使用0.1%DEPC处理过的塑料器皿和高温烘烤过的玻璃器皿,以去除可能存在的RNase造成的影响。
总之,用本方法提取含糖量较高的果实总RNA,排除了多糖的干扰,取得良好的效果。所提RNA可以满足分子生物学试验操作,如RT-PCR和Northern杂交等,为我们进一步研究富含多糖果实采后相关分子机理奠定了重要基础。
[1]Fang G,Hammar S,Grumet R A.Quick and inexpensive method for removing polysaccharides form plant genomic DNA[J].Biotechniques,1992,13:52 -56.
[2]Hatzfeld W D,Stitt M.A study of the rate of recycling of triosphosphates in heterotrophic Chenopodium rubrum cells,potato tubers and maize endosperm[J].Planta,1990,180:198-204.
[3]Geigenberger P,Stitt M A.Futile cycle of sucrose synthesis and degradation is involved in regulating partitioning between sucrose,starch and respiration in cotyledons of germinating RicinuscommunisL.seedlingswhen phloem transportis inhibited[J].Planta,1991,185:81 -90.
[4]王贵禧,韩雅珊,于梁.猕猴桃软化过程中阶段性专一酶活性变化的研究[J].植物学报,1995,37:198-203.
