野生与仿生栽培刺五加叶浸出物中多糖与黄酮含量分析
2012-07-31曲春风周燕霞
曲春风,张 倩,田 芯,周燕霞
(山东大学 威海分校海洋学院,山东 威海 264209)
刺五加(Acanthopanax senticosus)属于刺五加科植物,其干燥根[1]、茎、叶可作药用[2]。刺五加主要分布于中国(东北、华北)、远东、朝鲜及日本[3],前苏联将刺五加作为人参代用品而广泛载培[4]。我国吉林、黑龙江省野生资源丰富,蕴藏量大。
2000年以前之历代本草专著及新中国以来之各版《中国药典》均记载其药用部位为根。2000年版《中国药典》将其药用部位规定为根及地上茎枝。在中国医药学中,刺五加被作为药物广泛应用已有悠久的历史。其有特异性香气,性温,味辛,微苦,有益气健脾,补肾安神之功效。《神农本草经》将刺五加列为上品,并初步认识到其有“益气”的作用;至《名医别录》中就指出五加有“补中,益精;坚筋骨,强志意”的功效;久服“轻身耐老”,与它药配伍,亦可“进饮食,健气力,不忘事”。另雷斅著《炮灸论》记五加皮有“阳人使阴,阴人使阳”的作用。《甄权本草》还记载它能“破逐恶风血……治内不足”。
现代药理研究表明刺五加可增强机体非特异性防御能力,除具有免疫调节、抗肿瘤、抗衰老、抗辐射、抗损伤及抗疲劳作用外,还可治疗心脑血管疾病、糖尿病、神经衰弱、益气健脾、补肾安神、益精壮骨之功效[5]。近年来,经过对刺五加生理活性和化学成分方面的研究,表明刺五加有效成分为苷类,其中丁香苷,异秦皮啶是主要有效成分[6-20]。为了探讨野生刺五加与仿生栽培刺五加的性状及内在质量,提高其有效成分的利用率,我们对野生刺五加与仿生栽培刺五加依据药典中浸出物含量测定的方法,分别对刺五加不同部位中的水提浸出物和醇提浸出物的含量进行了分析测定。
1 材料与方法
1.1 试验样品及来源
采自吉林省通化地区。试验样品均由山东大学威海分校海洋学院张崇禧教授鉴定为刺五加(表1)。
1.2 试验仪器及试剂
试验仪器:752型紫外-可见分光光度计(上海光谱仪器有限公司),KQ-250DB型超声波清洗器(昆山市超声仪器有限公司),电子计数天平(500 g/0.001 g,金羊天平仪器厂),百灵 LAI14型电子天平(110 g/0.000 1 g),常熟市百灵天平仪器有限公司,101-2A型数显电热鼓风干燥箱,上海锦屏仪器仪表有限公司通州分公司。无水乙醇为分析纯、蒸馏水。
试验试剂:蒽酮、葡萄糖、浓硫酸、盐酸、无水乙醇、三氯化铝溶液、醋酸钠溶液、乙醇等,均为分析纯。蒸馏水自制,芦丁对照品购于中国药品生物制品检定所。
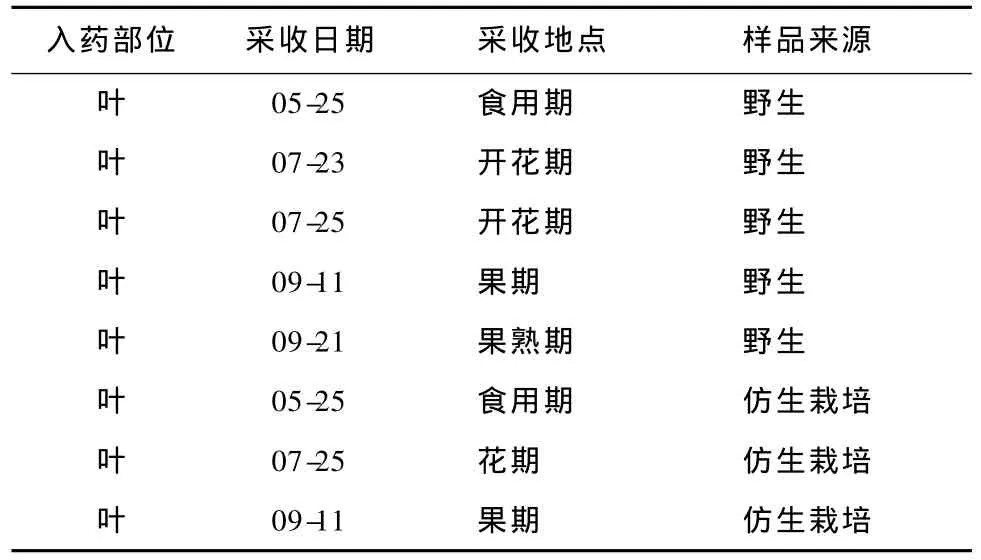
表1 刺五加的样品来源
1.3 试验方法
1.3.1 浸出物的制备
水提浸出物的制备。分别精密称取刺五加叶粉末(恒重)2.000 g,每个样品称取3份(3次平行),分别置于100 mL具塞三角瓶中,加蒸馏水50 mL,浸泡30 min,超声提取30 min,静置过滤,重复提取2次,过滤3次,滤液分别置蒸发皿中蒸干(蒸发皿在105℃下恒重,称重)。浸出物重量=总重-蒸发皿净重。
醇提浸出物的制备。精密称取刺五加叶粉末(恒重)2.000 g,每个样品称取3份(3次平行),分别置于100 mL具塞三角瓶中,加70%EtOH 50 mL,浸泡30 min,超声提取 30 min,静置过滤,重复提取2次,过滤,3次滤液分别置蒸发皿中蒸干(先在105℃下恒重),再把带浸出物的蒸发皿恒重,称重。浸出物重量=总重-蒸发皿。
1.3.2 浸出物中可溶性多糖分析
显色剂(蒽酮-浓硫酸)的制备。取98%的浓硫酸76 mL,稀释成100 mL溶液;精密称取蒽酮0.100 0 g,放入100 mL容量瓶中,逐渐加入上述配制的硫酸溶液至刻度并摇匀,冷却至室温,备用(需临用前现配)。
标准曲线的制备。将葡萄糖于60℃烘1 h,再逐渐升温至105℃干燥至恒重。精密称取10.55 mg,置100 mL容量瓶中,用蒸馏水溶解并稀释至刻度,取16支试管,除空白试液外,其余5组都做3次平行实验,按表2加试剂,于620 nm处测定吸光度,记录数据,绘制标准曲线。将所得数据进行统计处理,得回归方程:
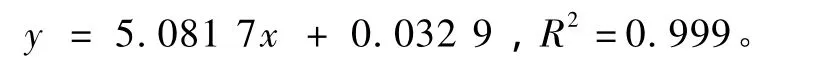
样品液的制备与测定。各取水提浸出物0.25 mg,分别置于25 mL容量瓶中,用50%的乙醇定容至刻度,混匀。分别取1.0 mL加入具塞试管中,再加入蒽酮-浓硫酸试剂5.0 mL,混匀。同时另取1支具塞试管加50%EtoH 1 mL,再加入蒽酮-浓硫酸试剂5.0 mL,作为空白实验。置沸水浴中加热10 min,冷却至室温。于620 nm处测定吸光度,记录数据。
1.3.3 醇浸出物中总黄酮的分析
显色剂溶液的配制。0.1 mol·L-1三氯化铝溶液的配制:取结晶三氯化铝2.46 g于100 mL容量瓶中,用无水乙醇定容,摇匀,备用。
1 mol·L-1醋酸钠溶液的配制:取结晶醋酸钠13.6 g于100 mL容量瓶中,用蒸馏水定容,摇匀,备用。
对照品溶液的制备。精密称取干燥至恒重的芦丁对照品5.8 mg,置50 mL容量瓶中,以75%乙醇定容至刻度。
标准曲线的制备。吸取对照品溶液0.0,1.0,1.5,2.0,2.5,3.0,3.5 mL于 7支 25×250 mL试管中,按表2加试剂,混匀,静置40 min。在420 nm处测吸光度,3次平行,以吸收值D为纵坐标,质量mg为横坐标,绘制标准曲线,将所得数据进行统计处理,得回归方程y=0.103 5 x+0.129 9,R2=0.999
样品溶液的制备与测定。取醇浸提物0.25 mg分别置于25 mL容量瓶中,用75%的乙醇定容至刻度。吸取5 mL于试管中,加入75%乙醇1 mL,0.1 mol三氯化铝溶液3.0 mL及1 mol·L-1醋酸钠溶液5.0 mL,摇匀,静置40 min,取样品溶液于420 nm处测吸光度,3次平行,记录数据。
2 结论与分析
2.1 刺五加叶浸提物成分及含量
刺五加叶浸提物成分及含量见表2。
2.2 方法学考查
2.2.1 多糖含量分析方法学考查
回收率试验:称取6份已知多糖含量的样品粉末约0.6 g,精密称定,置于磨口锥形瓶中分别加入27.53 mg·mL-1的葡萄糖对照品溶液0.5 mL,按前面样品处理法提取,并按样品测定项操作,计算总多糖含量和回收率。平均回收率为100.32%,RSD=0.223%(n=6)。
精密度试验:称取已知多糖含量样品粉末约0.6 g,精密称定,按样品测定方法,连续测6次,测得吸光度并计算含量,RSD=0.223%(n=6)。
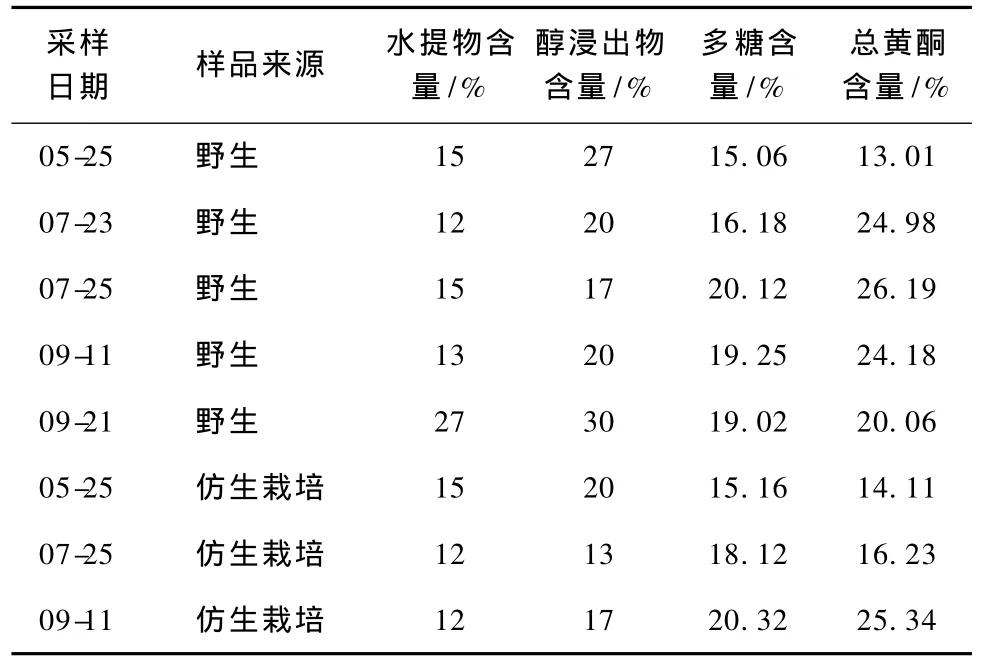
表2 刺五加叶浸提物成分及含量
稳定性试验:取样品溶液,每隔10 min测1次吸光度,记录在60 min内的吸光度值,求得RSD值为1.23%(n=6)。
2.2.2 总黄酮含量分析方法学考查
回收率试验:精密称取5份已知总黄酮含量的刺五加醇浸出物约0.25 mg,置于磨口锥形瓶中分别加入0.034 3 mg·mL-1的芦丁标准品溶液2 mL,提取后按样品测定项操作,计算黄酮含量和回收率。平均回收率为100.46%,RSD=0.77%。
精密度试验:精密称取已知总黄酮含量的刺五加粉末约0.5 g,连测5次,测得RSD为0.278%。
稳定性试验:取样品溶液,每隔10 min测1次60 min内的吸光值,求得RSD=1.32%(n=6)。
3 小结和讨论
刺五加叶的水提物浸出率和醇提物浸出率较高,其中刺五加叶的水提物中浸出率最高的是9月21日采收的野生刺五加含量为27%,最低的是9月11日采收的仿生刺五加含量为12%;醇提物浸出率最高的也是9月21日采收的野生刺五加含量为30%,最低的是7月25日采收的仿生刺五加含量为13%。综合分析:野生刺五加叶中水,醇浸出物含量相对都高于仿生刺五加叶浸出物含量。
水浸出物中可溶性多糖的含量最高的是9月11日采收的仿生栽培刺五加叶浸出物含量为20.32%,最低的是5月25日采收的野生刺五加叶浸出物含量为15.09%。
醇浸出物中总黄酮的含量最高的是7月25日采收的野生刺五加叶浸出物含量为26.19%,最低的是5月25日采收的野生刺五加叶浸出物含量为13.01%。
由于浸出物的含量与药材质量密切相关,可以作为刺五加质量评价标准之一。
[1]药典委员会.中华人民共和国药典(一部)[M].广州:广东科技出版社,2005.
[2]赵敏,王炎,康莉.刺五加果实及种子内源萌发物质活性的研究[J].中国中药杂志,2001,26(8):534.
[3]李时珍著:图解本草纲目(明)[M].文光图书公司印行1973:405-412,1205-1206.
[4]高风兰.无梗五加化学成分提取分离鉴定[J].中国中医药科技,1997:4(2):107.
[5]曹先兰,李珠莲.刺五加国外实验研究(综述)[J].中草药,1980,11(6):277.
[6]周以良主编.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社,1986.
[7]卫平,于高麦.短柄五加化学成分的研究[J].中草药,1989,20(4):8.
[8]王志睿,林敬明,张忠义.刺五加化学成分与药理研究进展[J].2003,26(8):603-606.
[9]张芳红.齐墩果酸在甘肃产八种五加科植物中的分布规律[J].中药材,1994,17(9):29.
[10]吴立军,郑健,姜宝虹,等.刺五加茎叶化学成分[J].药学学报,1999,34(4):294.
[11]吴立军,阮丽军,郑健,等.刺五加茎叶化学成分[J].药学学报,1999,34(11):839.
[12]刘起华,朱礼,李文兰.刺五加主要活性成分化学与药理研究[J].时珍国医国药,1999,10(4):305.
[13]苗明三,李振国.现代实用中药质量控制技术[M].北京:人民卫生出版社,2000.
[14]曹先兰.刺五加微量元素的测定[J].黑龙江医药,1980(3):20.
[15]卫平.短柄五加茎中氨基酸和金属元素分析[J].中药材,1998,11(6):37.
[16]赵余庆.刺五加活性成分Liricdendrin结构研究[J].中草药,1990,21(3):44.
[17]赵余庆.刺五加中异秦皮啶和芪类化合物的分离鉴定[J].中草药,1991,22(11):516.
[18]陈貌连,宋风瑞,郭明全,等.刺五加叶中黄酮类化合物的结 构 鉴 定[J].高 等 学 校 化 学 学 报,2002,23(5):805.
[19]陈貌连,宋风瑞,郭明全,等.刺五加叶中黄酮类化合物的分析[J].分析化学,2002,30(6):690.
[20]江西新医学院编.中药大辞典[M].上海:上海科学技术出版社,1989:29-36,380-383.
