槲皮素固体脂质纳米粒体外释放度考察
2012-07-30常明泉
肖 琴 陈 芳 常明泉 王 刚
湖北医药学院附属医院,湖北 十堰 442000
固体脂质纳米粒(solid lipid dnanopartcles,SLN)系指以生理相容性的高熔点脂质为骨架材料制备而成的纳米粒。该制剂具有细胞亲和性、靶向性、缓释性、低毒性和稳定性的特点,制成脂质体的药物其生物利用度可获得大幅度提高[1-3]。槲皮素固体脂质纳米粒是一种以山嵛酸甘油酯、胆固醇、大豆卵磷脂为载体材料,以丙酮-三氯甲烷(1∶1)为混合溶剂,以槲皮素为主药,吐温-80为乳化剂,采用熔融-匀化法制备而成的一种抗癌制剂,该制剂主要通过槲皮素对细胞的增殖作用及对血管的新生作用而对肿瘤细胞产生抑制和预防作用,从而达到抗癌目的[4-5]。考察脂质体的体外释放度对优化处方结构、筛选制备工艺及合理用药具有指导意义。本实验拟用透析袋-高效液相色谱法对槲皮素固体脂质纳米粒的体外释放度进行考察。
1 仪器与试药
1.1 仪器
RCZ-1A型溶出试验仪(上海黄海药检仪器厂,220 V,50 Hz);戴安3000型高效液相色谱仪(美国戴安公司);分析天平(精度0.000 1 g);透析袋(上海源叶生物科技公司,MWCO 7000,22 mm×1 m);TGL-16G 离心机(上海安亭科学仪器厂);UPS-200H 型超声波震荡仪(500 W,50 Hz,南京熊猫电子仪器有限公司);LG-冰箱(LTR-B2071GTBC)。
1.2 试药
槲皮素对照品(中国药品生物制品检定所,批号:100081-200406);生理盐水(安徽丰原淮海制药有限公司,批号:20111011);槲皮素固体脂质纳米粒(太和医院自制,批号:20120323);甲醇为色谱纯;无水乙醇、乙酸均为分析纯。
2 方法与结果
2.1 系统适用性[6]
色谱柱:迪马 C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-4.3%乙酸溶液(55∶45);流速:1.0 mL/min;检测波长:254 nm;进样量:20 μL;柱温:30℃。
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取槲皮素对照品20.0 mg,置100 mL容量瓶中,先加无水乙醇约50 mL超声震荡溶解,再加无水乙醇至刻度,摇匀,即得200 μg/mL对照品溶液。
2.2.2 供试品溶液的制备 精密称取样品1 g,置适宜烧杯中,加入无水乙醇约15 mL超声震荡,直至破乳分散均匀后将溶液转入50 mL量瓶中,用无水乙醇分3次洗涤烧杯,每次10 mL,洗液并入量瓶中,定容,摇匀,取溶液适量,在离心机中离心15 min,转速1.0×104r/min,取上清液用微孔滤膜(0.45 μm)过滤,取续滤液即得(该溶液在 5~10℃的冰箱中保存)。
2.2.3 空白溶液的制备 精密称取不含槲皮素的固体脂质纳米粒样品1 g,按上述供试品溶液的制备方法制备,即得。
2.3 干扰试验
分别取“2.2”项下的各溶液,参照“2.1”项下色谱条件将溶液各进样20 μL,记录色谱图,结果对照品溶液、供试品溶液在相同时间内有同样色谱峰出现,空白溶液无色谱峰出现,说明该脂质体中的其他成分对主药含量测定无干扰。见图1。
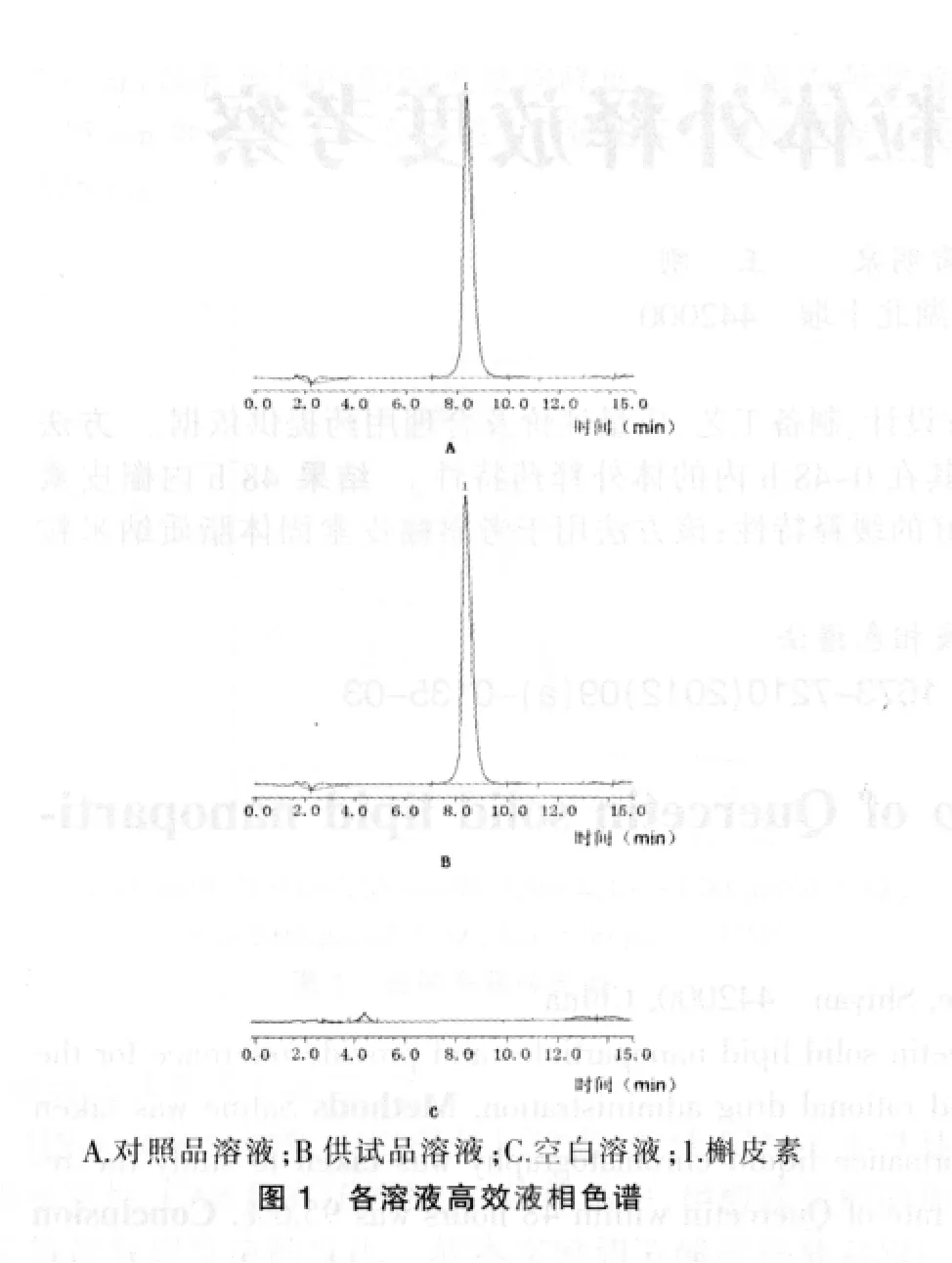
2.4 线性关系考察
分别精密吸取“2.2”项下的槲皮素对照品溶液(200 μg/mL)1.0、2.0、4.0、6.0、8.0 及 10.0 mL,置 10 mL 量瓶中,用甲醇稀释至刻度, 即得 20.0、40.0、80.0、120.0、160.0、200.0 μg/mL的各溶液,各溶液按照“2.1”项下色谱条件分别进样3次,以峰面积为纵坐标,浓度为横坐标,进行线性回归,得曲线方程为 A=1.343 5C-1.490 4(r=0.999 6),提示槲皮素在 20.0~200.0 μg/mL范围内线性关系良好。
2.5 精密度试验
取“2.2”项下的对照品溶液,按照“2.1”项下色谱条件分别进样6次,记录峰面积,计算平均值,RSD为0.79%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.2”项下的对照品溶液,在冰箱中保存(5~10℃),于0、4、12、24、36、48 h 分别取样,按照“2.1”项下色谱条件进样,记录峰面积,计算平均含量为198.8 μg/g,RSD为1.38%。提示槲皮素溶液在低温条件下48 h内稳定。
2.7 重复性试验
精密称取样品6份,每份1 g,按“2.2”项下供试品溶液的制备方法制备溶液,按照“2.1”项下色谱条件进样,测得槲皮素平均含量为 100.9 μg/g,RSD=1.29%(n=6),表明该方法重复性良好。
2.8 加样回收率试验
精密称取已测知含量的样品(批号:20120323)6份,各0.5 g,分别加入浓度为 80 μg/mL 对照品溶液 1 mL,按“2.2”项下供试品溶液的制备方法制备溶液,按照“2.1”项下色谱条件进样,记录色谱图,计算槲皮素回收率,结果见表1。
2.9 体外释放度考察[7-8]
精密称取槲皮素固体脂质纳米粒10 g,置直径为22 mm、长约10 cm的透析袋中,除去袋内空气,两头用线绳扎紧,盘绕固定于溶出仪搅拌桨上,将搅拌桨置于距溶出杯底约1.5 cm处,以生理盐水500 mL为释放介质,保持温度(37.0±0.5)℃,搅拌桨转速至 50 r/min,分别 0.5、1.0、2.0、4.0、6.0、8.0、12.0、24.0、36.0、48.0 h定时取样2 mL(同时补加同体积的释放介质),用 0.45 μm 微孔滤膜过滤,取续滤液,按照“2.1”项下色谱条件进样,记录峰面积,计算出各时间槲皮素的累计释放百分率,以释放率为纵坐标,时间为橫坐标,用Excel拟合释放曲线,结果见图2。
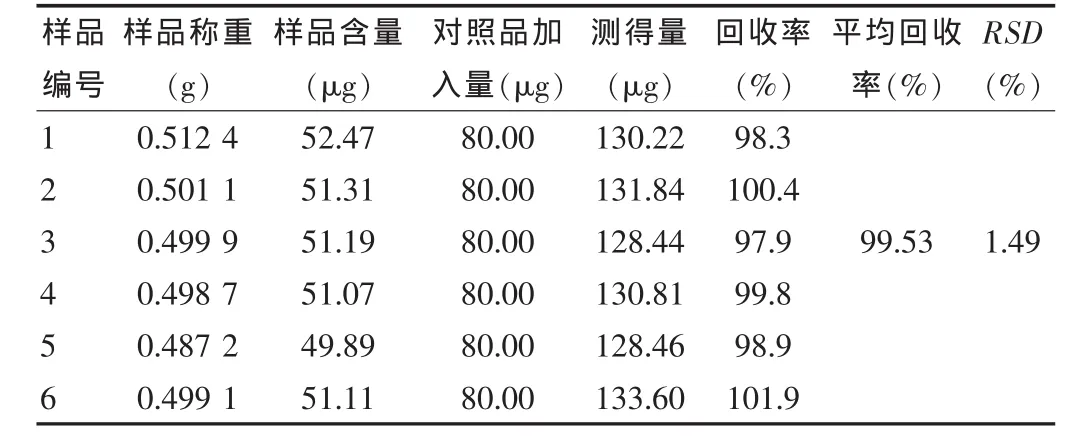
表1 槲皮素固体脂质纳米粒加样回收率试验结果(n=6)

图2 槲皮素固体脂质纳米粒体外累积释放度曲线
结果槲皮素固体脂质纳米粒中的槲皮素在48 h时累积释放率为95.6%,具有显著的缓释特性。
3 讨论
SLN的制备主要有熔融-匀化法、冷却-匀化法、纳米乳化法及薄膜超声法。根据各药物的性质及临床用途选用适宜方法,药物制成SLN后具有物理稳定性高、药物泄露少、缓释性好、低毒性、易于规模生产的特点。槲皮素固体脂质纳米粒系采用熔融-匀化法制备而成。该制剂以山嵛酸甘油酯、胆固醇、大豆卵磷脂为载体材料,上述3种包材均为疏水性载体材料,这些材料在乳化冷却过程中形成网状骨架结构,槲皮素溶液以分子状态分散于骨架内保持稳定状态,在模拟人体温度和适度运动状态条件下(50 r/min)脂质体被软化,药物的释出必须首先通过载体材料的网状骨架扩散,从而形成缓释效应[9]。
流动相以甲醇-4.3%乙酸溶液(55∶45)组成,含量测定时洗脱分离效果好[10]。槲皮素的分子量为338.27,在选用透析袋时,考虑到脂质体的基质具有一定的黏度,可能对药物向外释放产生阻滞作用,故选用截留分子量较大的CE透析袋(MWCO 7000),以使在透析过程中药物能够充分释出。
实验结果显示,槲皮素固体脂质纳米粒中的槲皮素48 h内累积释放率为95.6%,说明该脂质体具有良好的缓释特性。应用透析袋-高效液相色谱法考察槲皮素固体脂质纳米粒的体外释放度操作便利,方法稳定,结果重复性好。
[1]崔福德.药剂学[M].6版.北京:人民卫生出版社,2008:421-426.
[2]李志浩,李鹏,郑芳,等.白术内酯Ⅰ脂质体的制备工艺[J].中国药师,2010,13(4):473-475.
[3]张洪.大黄素固体脂质纳米粒的制备及理化性质研究[J].中国药师,2010,13(3):326-328.
[4]舒毅,谭陶,张思宇,等.槲皮素的药理学研究进展[J].华西药学杂志,2008,23(6):689-691.
[5]Pugundla N,Engelberth A,Vandhana RS,et al.Switchgrass water extracts: Extraction,Separation and Biological activity of Rutin and Quercetin[J].J Agric Food Chem,2009,57(17):7763-7767.
[6]常明泉,孙运娥,蒋安荣,等.槲皮素固体脂质纳米粒的制备与含量测定[J].医药导报,2011,30(8):1069-1070.
[7]杨跃辉,丁平田,何浦汉.氢定乳膏制备工艺的优化及体外释放度考察[J].中国医院药学杂志,2008,28(10):790-793.
[8]刘硕,仵文英,席枝侠,等.RP-HPLC法测定黄芩苷脂质体的体外释放度[J].中国药房,2007,18(33):2594-2596.
[9]刘硕,仵文英,席枝侠,等.黄芩苷脂质体的包封率测定和体外释放度考[J].中国医院药学杂志,2008,28(5):342-345.
[10]常明泉,黄良永,叶立红,等.槲皮素固体脂质纳米粒的包封率与载药量测定[J].中国药房,2011,22(27):2525-2526.
